Digitalisierung in der Dermatopathologie
Digitalisierte Histologie
Die histologische Aufarbeitung von Hautpräparaten ist ein relevanter Eckpfeiler im diagnostischen Armamentarium der Dermatologie. Diese Aufarbeitung erfolgt in der Regel in histologischen Labors, mit einem Objektträger als Endresultat, der am Mikroskop betrachtet wird. Auf Basis dieser analogmikroskopischen visuellen Information wird schließlich in Zusammenschau mit den klinischen Angaben und Bildern ein Befund erstellt. Seit einigen Jahrzehnten gibt es Entwicklungen in der Digitalisierung, die es auch im Bereich der Dermatopathologie ermöglichen, digital tätig zu werden. Das Konzept: Der Glasobjektträger, der normalerweise am Mikroskop betrachtet und physisch transportiert werden muss, wird zentral im Labor durch einen Slide Scanner digitalisiert. Dadurch kann er örtlich und zeitlich unabhängig von Dermatopatholog:innen beurteilt werden. Es ist jedoch keineswegs selbstverständlich, dass dies möglich ist. Es bedarf auch der Evidenz dafür, dass diese digitalisierte Prozessierung und Begutachtung in Bezug auf die diagnostische Qualität – sowohl die Sensitivität als auch die Spezifität betreffend – der bisherigen Arbeitsweise äquivalent ist. Hier gibt es mittlerweile eine hohe Anzahl von Studien, die viele diagnostische Schritte einschließen.1
Konkrete Vorteile: Die Digitalisierung ist natürlich kein Selbstzweck, sondern soll konkrete Vorteile liefern: zeitlich und örtlich flexiblere Berufsrealitäten, Kompensationsmöglichkeit fachlicher Engpässe durch digitale Zusammenlegung entfernter Standorte, Nutzung von automatisierten Verarbeitungsschritten (siehe „Künstliche Intelligenz“) sowie digitale und asynchrone Lehre.
Technische Herausforderungen: Neben der Evidenz der diagnostischen Gleichwertigkeit gibt es organisatorische technische Herausforderungen, die von Institutionen im Rahmen der Digitalisierung der Dermatopathologie gelöst werden müssen.2 Eine davon ist die Sicherheit in Bezug auf Datenschutz, da Patientendaten potenziell über das Internet übertragen werden. Insgesamt muss davon ausgegangen werden, dass Organisation und Arbeitsabläufe im Zuge der Digitalisierung grundsätzlich überarbeitet werden müssen.3 Ein sehr spezifisches Beispiel für eine technische Herausforderung im Bereich der digitalen Diagnostik ist die Farbwiedergabe. Durch unterschiedliche Scanner, Lampen und Bildschirme werden Farben unterschiedlich dargestellt. Diese unterschiedlichen Farben können in der Routinediagnostik relevant sein – bei zu schwachen Farbtönen können etwa eosinophile Granulozyten mit neutrophilen Granulozyten verwechselt werden. Um dies zu lösen, werden in der Regel Farbprofile durch Slide Scanner hinterlegt, die durch die Ansichts-Software und entsprechend farbkalibrierte Bildschirme verarbeitet werden können.4 Für die Verwendung von Bildschirmen im diagnostischen Prozess gibt es mittlerweile Studien, die unterschiedliche Qualität und Nutzbarkeit dieser untersucht haben.5 Es hat sich gezeigt, dass vor allem Pixeldichte und Abdeckung von Farbräumen in der Diagnostik relevante Qualitäten sind.
Neue technologische Methoden: Abseits der konventionellen histologischen Aufarbeitung gibt es andere neue technologische Methoden, die auch ohne ein eigenes Labor histologieartige Bilder liefern sollen.
Bei der konfokalen Ex-vivo-Mikroskopie6 wird das native Exzisionsmaterial mit Acridinorange getränkt und anschließend, ähnlich wie bei einer konfokalen In-vivo-Mikroskopie, durch einen Laser gescannt. Das Ergebnis wird mit einer errechneten „Pseudofarbe“ versehen und kann schließlich innerhalb weniger Minuten wie ein digitaler histologischer Schnitt betrachtet werden – gleich im Operationssaal. Diese Methode hat das Potenzial, den Gefrierschnitt zu ersetzen, und wird bereits in vielen Spitälern Europas eingesetzt.
Die Stimulated RamanHistology7 ist derzeit hauptsächlich auf die Neuropathologie ausgerichtet und ermöglicht es innerhalb weniger Minuten in einem einzelnen Gerät, allein mit nativem Gewebe ohne weitere Färbung Bildmaterial zu erstellen, das in der Qualität den konventionellen HE-Schnitten in bisherigen Studien in nichts nachsteht. Aufgrund der langsamen Verarbeitungszeit und der kleinen Abbildungsgröße ist diese Methode vorerst noch nicht für die Dermatopathologie geeignet.
Die Line-Field-OCT8, 9, eine Weiterentwicklung der bisherigen optischen Kohärenztomografie, bietet im Gegensatz zur konfokalen In-vivo-Mikroskopie eine größere Eindringtiefe bei nahezu histologieähnlicher räumlicher Auflösung. Diese Methode erlaubt es, Hautveränderungen sowohl quer („en-face“) als auch vertikal zu betrachten – es bleibt abzuwarten, in welcher Form sich diese Methode im klinischen Alltag und in der Forschung durchsetzen wird.
Künstliche Intelligenz
Die Digitalisierung der Dermatopathologie hat aber natürlich einen speziellen Effekt – die Möglichkeit der Anwendung von automatisierter Datenverarbeitung, wie z. B. dem maschinellen Lernen, wobei sich in den letzten Jahren eine Vielzahl von möglichen Anwendungsfeldern herauskristallisiert hat. Ein häufig untersuchtes Thema ist die Detektion von epithelialen Hauttumoren am histologischen Schnitt (Abb.).10–12
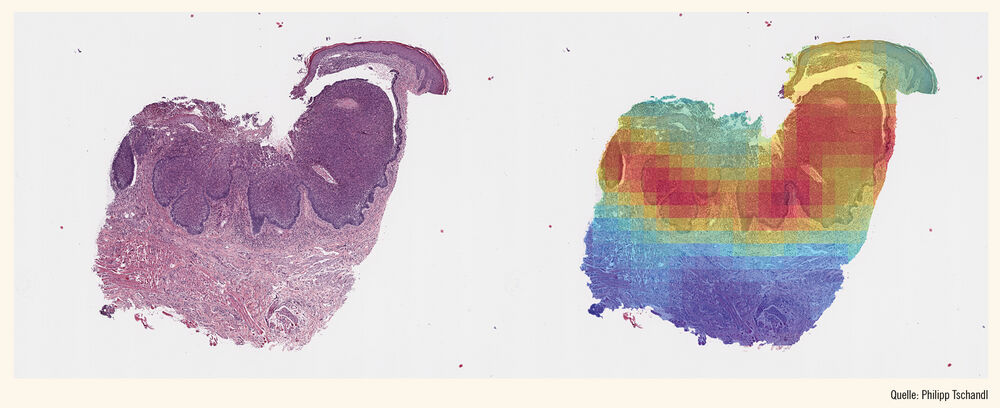
Abb.: Digitaler histologischer Schnitt eines Basalzellkarzinoms (A), wobei die erkrankten Areale (B; gelb-rote Farbe) durch ein auf diagnostische Klassifizierung trainiertes neuronales Netzwerk (CLAM10) erkannt werden können
Neben der sehr präzisen Detektionsmöglichkeit dieser Tumoren gibt es nun auch Entwicklungen, bei denen die Detektion am histologischen Schnitt mit Rekonstruktionen des OP-Situs kombiniert wird, um in einer räumlichen Rekonstruktion den Chirurg:innen während der Mohs-Chirurgie die noch befallenen Areale automatisiert anzeigen zu können.13 Bisher wurden in diesem Forschungsfeld hunderte oder tausende von Fällen zum Training von Algorithmen verwendet. Jüngste Arbeiten aber zeigen, dass Start-ups mittlerweile mit mehr als einer Million Slide Scans arbeiten.14 Da man aus früheren Arbeiten weiß, dass mehr Daten eine „unvernünftige“ Steigerung der Leistungsfähigkeit von Algorithmen bedeuten15, bleiben hier zukünftige Arbeiten zur Nutzbarkeit solcher Systeme jedenfalls interessant.
Neben der Diagnostik gibt es natürlich noch weitere Anwendungsfälle für Algorithmen. Ein Beispiel dafür ist die automatisierte und objektivierte Aktivierung von Scores. Beispielsweise muss in bestimmten Situationen der PD-L1-Tumor-Positivity-Score für Behandlungsmethoden in Prozent bestimmt werden, was mitunter relativ aufwendig sein kann. Hierzu konnte bereits vor einigen Jahren eine Studie zeigen, dass ein automatisiertes Scoring am digitalen Schnitt nicht nur möglich ist, sondern vielleicht auch eine Qualitätsverbesserung bieten kann.16 Eine besonders spannende und neue Entwicklung ist der Einsatz von sogenannten generativen Sprachmodellen, im Speziellen in zwei Anwendungsfeldern: Eine Möglichkeit, die für Ärzt:innen manchmal etwas bedrohlich klingt, ist die automatisierte Befunderstellung auf Basis von Bilddaten.17 Die zweite interessante Möglichkeit ist der Einsatz von generativen Sprachmodellen als Ansprechpartner für Patient:innen, um komplexe Befunde erklären zu können.18






















































































