Eine personalisierte Roadmap für die KI-Revolution
Der Gesundheitssektor im Wandel
Aufgrund der Größe, der verschiedenen Datenarten und des Gesamtwertes für die Gesellschaft erweist sich der Gesundheitssektor als zunehmend attraktiver Zielmarkt für den nichtmedizinischen KI-Sektor. Während sich im Gesundheitswesen üblicherweise evolutionäre Entwicklungen innerhalb der Medizin ergeben, kann das zunehmende Interesse von KI- und Technologiegiganten derzeit als früher Hinweis auf einen grundlegenden Wandel gewertet werden.
Momentan verfügen die meisten medizinischen Fachkräfte aber leider nicht über die entsprechende Ausbildung, um sich dem abzeichnenden Wandel durch externe Markteinflüsse auf gleicher Augenhöhe und versiert zu stellen. Wir stehen also vor einer Revolution im Gesundheitswesen.
Da Technologie jedoch an sich nicht zur Verantwortung gezogen werden kann, verbleibt die Verantwortlichkeit für ihre sinnvolle Anwendung auf absehbare Zeit primär bei den Heilberufen. Mit anderen Worten: Der Gesundheitssektor befindet sich mitten in einem Paradigmenwechsel, und es liegt in unserer persönlichen Verantwortung, uns darauf vorzubereiten.
Der große Durchbruch der KI in der Medizin steht noch aus
Derzeit ist ein gewisser Hype um das Thema künstliche Intelligenz zu vermerken. Leider stehen aber trotz zahlreicher Errungenschaften die großen Durchbrüche der KI in der Medizin noch aus. Die Einführung von Large Language Models (LLMs) hat z. B. das Programmieren grundsätzlich verändert und damit neue Möglichkeiten im Umgang mit großen Textdatensätzen eröffnet (z. B. Suche in Terabyte großen Patientenakten).
Bereits vor der Einführung dieser LLMs stellte die Vorbereitung der Daten mit 79% des Arbeitsaufwandes den Löwenanteil der Gesamtarbeit eines KI-Projektes dar.1 Durch die Vereinfachung der Entwicklung hochkomplexer KI-Algorithmen steigert sich nun die Bedeutung der Datenakquise sowie Datenvorbereitung weiter, da sorgfältige Auswahl, Aufbereitung und Annotation der Daten einen entscheidenden Schritt im KI-Entwicklungsprozess darstellen und damit erheblichen Einfluss auf die spätere KI-Funktion haben.
Die Rolle der Datensätze
Wechseln wir zum Dateninhalt, gibt es zwei prinzipielle Herangehensweisen: große Datensätze („more is better“) oder hochspezifische kleine Datensätze („specificity rules“).
Beide Extreme führen zu unterschiedlichen Problemen: Einer generellen Modellierung auf Populationsebene fehlt häufig die notwendige Relevanz auf Patientenebene („underfitting“), wohingegen Modellen, die auf kleinen „fallbasierten“ hochspezifischen Datensätzen beruhen, möglicherweise die Relevanz in größeren Kollektiven fehlt („overfitting“). Kurzum, es gilt den goldenen Schnitt zwischen Datenmenge und Spezifität zu erlangen.2
In diesem Zusammenhang sind Initiativen wie die Schaffung eines Europäischen Gesundheitsdatenraumes („European Health Data Space“, EHDS)sowie nationale, aber auch internationale Initiativen entscheidend.
Zusammenfassend ist der Zugang zu großen Populationsdaten und die Fähigkeit, diese dann in hochrelevanteDatensätze mit spezifischen Fragestellungen umzuwandeln, entscheidend. Diese technischen Überlegungen sind der Ausgangspunkt für die folgenden 6 Schlüsselbotschaften dieser Arbeit:
1. KI erfordert Fokus.
Bei der Translation von der Grundlagenforschung in die klinische Anwendung muss bei der Integration von KI-Anwendungen die Bedeutung des Qualitätsmanagements hervorgehoben werden.
Qualitätsmanagement beinhaltet die konkrete Definition einer klaren Zielsetzung für die KI-Anwendung. Die Spezifikation einer Anwendungszielsetzung ist notwendige Voraussetzung, um die passenden Qualitätssicherungsmaßnahmen etablieren zu können. Dies mag zunächst theoretisch und nach bürokratischem Mehraufwand klingen, aber Notfallpläne, Sicherungsmaßnahmen, Daten- und Ergebnis-Back-ups, Server-Auditierung, Zugriffsmanagement und Vertretungsregelungen können Leben retten.
Ein etabliertes Modell, um die Anwendung eines KI-Models zu kategorisieren, ist die Unterscheidung von Aufgabe, Prozess und Service.3 Nehmen wir einen COVID-19-Test als Beispiel. Hier besteht die „Aufgabe“ oder Primärfunktion darin, ein Ergebnis zu erhalten („negativ“ oder „positiv“). Der Test erfordert einen „Prozess“, also die Art, wie das jeweilige Probenmaterial gewonnen wird (z. B. Nasenabstrich oder Speichelprobe). Je nach Verfügbarkeit stehen dann Kombinationen aus Aufgaben und Prozessen als Gesundheitsleistungen („Services“) zum Beispiel in einem Krankenhaus zur Verfügung.
Diese Kategorisierung erstreckt sich auch auf KI-Anwendungen, die unterschiedliche Funktionen erfüllen können. Einige bieten Vorhersagen, wie z. B. ein COVID-19-Testergebnis-Prädiktor (Aufgabe), während andere Empfehlungen für bestimmte Prozesse geben, wie z. B. automatische Empfehlung einer Blutabnahme für ein Sepsis-Screening durchzuführen.
Darüber hinaus gibt es KI-Anwendungen, die dazu dienen, Servicekomponenten zu vereinfachen; wie etwa die Automatisierung administrativer Prozesse („Terminbots“).
Diese Kategorisierung zeigt auf der einen Seite, dass die Gesamtqualität der medizinischen Leistung aus einer Kombination von Aufgabe, Prozess und Service besteht: Ein:e unfreundliche:r Arzthelfer:in an der Rezeption oder ein nerviger Chatbot (Service) können die Gesamtqualität einer ansonsten hochwertigen Radiologiepraxis mindern.
Auf der anderen Seite kann die Implementierung einer KI-Anwendung in einer dieser ineinandergreifenden Ebenen unbeabsichtigte Konsequenzen in anderen Ebenen haben: Ein falsch funktionierendes KI-Empfehlungssystem für Sepsis-Screening verhindert den Zugang zu einem funktionierenden diagnostischen Test. Daher erfordert die Implementierung von KI sorgfältige Abwägungen und Berücksichtigungen („Fokus“), um sicherzustellen, dass die Gesamtqualität im Gesundheitssystem verbessert wird.3
2. Die KI-Implementierung erfordert menschliche Governance-Strukturen.
KI-Algorithmen können auf vielfältige Weise in das Gesundheitssystem integriert werden.
Föderierte KI-Modelle lernen und agieren beispielsweise in lokalen Umgebungen, ohne Daten exportieren zu müssen. Daraus ergibt sich ein enormes Potenzial, aber auch die Notwendigkeit einer menschlichen Leitstruktur.
An einem Beispiel verdeutlicht: Die Forschungsgruppe von Professor B hat Zugang zu lokalen Daten sowie ein KI-Modell entwickelt und angemessene Leistungsmerkmale etabliert. Das Modell steht bald zur lokalen klinischen Integration zur Verfügung, und eine mögliche Ausgründung ist geplant.
Gleichzeitig hat eine andere Forschungsgruppe der Nachbaruniversität (Professor A) einen ähnlichen Algorithmus entwickelt, war etwas schneller und fordert nun Zugang zu den Daten an der Universität B an. Die Daten gehören nicht ausschließlich der Gruppe von Prof. B, jedoch sind die widersprüchlichen Interessen klar. Mit anderen Worten: Konzeptionell müssen wir Daten- und Modellbesitzer:innen sowie ein Leitungsgremium als drei personelle Kernkomponenten einer Governance-Struktur definieren, um in der Lage zu sein, Prioritäten festzulegen, rationale kontextuelle Entscheidungen zu treffen und diese durch entsprechende Zuständigkeiten zu koordinieren (Abb., Punkt 2).4
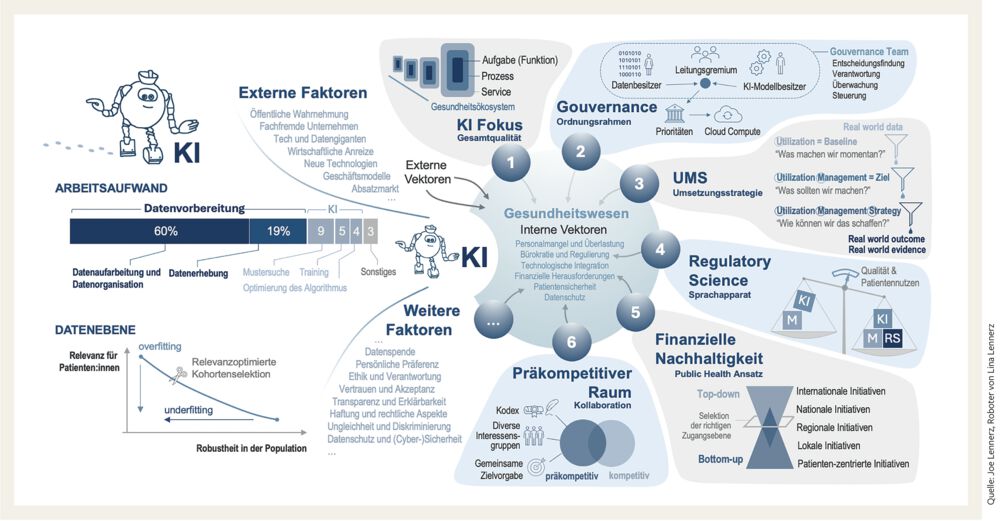
Künstliche Intelligenz (KI) auf dem Weg in die Medizin: KI ist als Roboter dargestellt. Der Arbeitsaufwand pro KI-Modell besteht vorwiegend aus Datenorganisation1, und auf der Datenebene gilt es, hohe Relevanz und hohe Robustheit durch einen goldenen Schnitt zu erreichen2. Externe Faktoren sowie interne Vektoren wirken derzeit auf das Gesundheitswesen. Die Kernaspekte der für die Implementierung von KI entscheidenden Vektoren sind in den Punkten 1–6 dargestellt und im Text mit Quellen erläutert. Abkürzungen: KI, künstliche Intelligenz; M, Medizin; RS, Regulatory Science; UMS, Utilization Management Strategy
Ohne derartige Leitungsstrukturen kann das Potenzial insbesondere von föderierten KI-Modellen nicht ausgeschöpft werden oder, ganz unbeabsichtigt, andere parallele Initiativen im Wert mindern oder gar zerstören. Derartige Leitungsstrukturen mit minimalem administrativem Aufwand in existierende Strukturen einzuweben kann als eine der großen Herausforderungen der KI-Revolution angesehen werden.
3. Vom Konzept zur Praxis erfordert bewährte Ansätze.
Bei der Umsetzung einer Idee (Vision) in eine funktionierende klinische Lösung (Praxis) benötigen wir einen bewährten Ansatz.
Ein etabliertes Konzept ist als UMS bekannt (Abb., Punkt 3).5 Hier steht das U für Nutzung (Utilization: „was wir derzeit tun“), UM für Nutzungsmanagement (Utilization Management: „was wir tun sollten“) und UMS für Nutzungsmanagementstrategie (Utilization Management Strategy: „wie wir dorthin gelangen“).
Diese drei Aspekte bieten die notwendige Basis für eine geradlinige Umsetzung. Die Baseline (U) ist notwendig, um erstens den Status quo zu quantifizieren und zweitens später erzielte Optimierungen quantitativ bewerten zu können.
Wenn wir dann im darauffolgenden UM-Schritt beispielsweise definieren: „Wir sollten X tun“, zwingen wir uns dazu, die spezifischen Änderungen in der notwendigen Detailtiefe als Zielvorgabe auszuformulieren. Dabei müssen Führungskräfte die nuancierten Diskussionen annehmen und gemeinsam mit dem Team identifizieren, welches Detail als zentraler Endpunkt relevant ist. Im Umkehrschluss ist auf der Praxisebene die Rückverfolgung der Details auf die Ergebnisebene gefragt.
Bei der Datenerhebung und Nutzungsoptimierung arbeiten wir mit realen Daten (Real World Data), welche die gleiche Qualität wie zukünftige Patient:innen haben. Durch diese beschriebene Umwandlung von Daten in messbare Behandlungserfolge (= Outcomes, Real World Evidence) können Optimierungsinitiativen eine Praxistransformation bewirken. Hierbei ist zu beachten, dass sich Behandlungserfolg keineswegs nur in z. B. Überlebenszeiten messen lässt, sondern auch in finan-ziellen Auswirkungen oder optimierten Behandlungszeiten erfassbar ist.
4. Die regulatorische Sprache als vereinigender Kraftvektor.
Bei der Etablierung von KI-Anwendungen ist eine der umstrittensten Fragen, wie man Risiko und Nutzen von künstlicher Intelligenz ausbalancieren kann. Dieses Gleichgewicht erfordert hochkritisches Hinterfragen und Überprüfung. Als Wissenschafter:innen folgen wir den Grundsätzen des Peer-Reviews, und die behördliche Zulassung ist, stark vereinfacht, ein ähnliches Review-System.
Viele Kolleg:innen fragen häufig – warum? Regulatorik verlangsamt doch nur den Fortschritt. Jedoch könnte man auch andersherum die folgenden kritischen Fragen stellen: Können wir der Wissenschaft ohne gesetzliche Regulierung vertrauen? Gibt es einen Entdecker-Bias? Schränkt dieser Entdecker-Bias meine Fähigkeit ein, eine Alternative zu sehen?
Ein kurzes Gedankenexperiment: Hätte die Veröffentlichung der SARS-CoV-2-Sequenz unsere Fähigkeit zum Schutz der öffentlichen Gesundheit verbessert? Diese pointierten Fragen verdeutlichen: Wissenschaft, so schön und sexy sie auch ist, kann allein nicht alle Probleme lösen.
Übertragen wir diese Erkenntnis auf unser Thema, können wir daraus schließen, dass in der Medizin eine KI, die entsprechenden regulatorischen Anforderungen entspricht, einen höheren Patientennutzen bringt als eine KI ohne regulatorische Komponenten (Abb., Punkt 4).
Um die Kluft zwischen Vorschriften und wissenschaftlicher Innovation zu überbrücken, gibt es zwei Möglichkeiten: Entweder beklagen wir uns vehement über die Sinnhaftigkeit der Vorschriften, oder wir beteiligen uns aktiv an der Erstellung neuer oder der Verbesserung vorhandener Vorschriften. Konkret bedeutet dies:
- Wir müssen den regulatorischen Sprachapparat beherrschen, um KI spezifische Funktionen adäquat zu beschreiben.6 Zum Beispiel folgt die Ausformulierung der Zweckbestimmung („intended use“) ganz bestimmten Regeln, die sich aus der Kennzeichnung, der Gebrauchsanweisung und den Werbematerialien ergeben.
- Mittels wissenschaftlich fundierter Daten kann die regulatorische Wissenschaft auch als Zugang verstanden werden, um Behörden über neue Kenntnisse zu informieren und dadurch sinnvolle Vorschriften voranzutreiben.
Damit ergibt sich eine erweiterte Regulatory-Science-Definition, die nicht nur von Mitarbeiter:innen in Behörden ausgeführt, sondern auch von Wissenschafter:innen durch robuste Daten mitgesteuert werden kann.
5. Public-Health-Ansätze zur Förderung finanzieller Nachhaltigkeit
Ähnlich wie bei der personalisierten Medizin sind auch bei der Realisierung von KI individuelle finanzielle Anreizstrukturen erforderlich. Dies ist nicht intuitiv, da viele gut gemeinte Ansätze unbeabsichtigte Konsequenzen mit sich bringen.
Zum Beispiel sind Kostenübernahmeanträge (ein Genehmigungsprozess für bestimmte Leistungen vor deren Anwendung) eine personalisierte Strategie zur sinnvollen Nutzung finanzieller Ressourcen. Die Idee: Wenn als notwendig dargelegt, erfolgt die Genehmigung durch den Kostenträger, was in der Konsequenz unnötige Nutzung und Kosten verhindern soll.
Leider stellt sich dies in der klinischen Praxis aber als äußerst umständlich heraus und führt zu erheblich erhöhtem verwaltungstechnischem Aufwand sowie Versorgungsverzögerungen und Frustrationen. Diese unbeabsichtigten Versorgungsauswirkungen stellen eine klare Warnung dar: Eine sinnvolle Kostenreduktion erfordert nicht nur eine administrative Maßnahme („Idee“), sondern auch die sinnvolle praktische Umsetzung (siehe Punkt 3).
In der Gesundheitsbranche ist es ähnlich: Neue Technologien wie KI stellen nicht automatisch Lösungen dar. Daher ist es wichtig, dass KI-Anwendungen gezielt und mit echtem Nutzen integriert werden, anstatt rein aus technischem Enthusiasmus vorangetrieben zu werden.
Im vorigen Beispiel wird KI zunehmend für die Erstellung und Auswertung von Kostenübernahmeanträgen eingesetzt, eine Tendenz, die sich bald auch bei Versicherern durch KI fortsetzen wird. Obwohl es zunächst so scheint, als würde diese Arbeitserleichterung die Kosten reduzieren, löst sie das Problem nur teilweise – denn während zwei KI-gesteuerte Systeme zusammenarbeiten, um Kostenübernahmeanträge zu bearbeiten und damit Kosten zu senken, entstehen gleichzeitig zusätzliche Kosten für die Implementierung und Wartung dieser Systeme.
Überzeichnet beschreiben wir hier das Hauptproblem des Versorgungsmanagements in der öffentlichen Gesundheit. Als Teil unserer unterhaltsamen Diskussion können wir damit Public Health als einen Hochseilakt definieren, bei dem das Wohlergehen der Gesellschaft geschützt wird, indem wir sowohl mikroskopische Bedrohungen als auch makroskopische Herausforderungen in einem statistischen Zirkus ausbalancieren.
Wie können wir nun diese Überlegungen auf die finanzielle Nachhaltigkeit von KI in der Medizin anwenden?
Initiativen im Public-Health-Bereich bewegen sich in verschiedenen Ebenen: vom individuellen Fall (Index-Patient:in) über lokal-regionale Initiativen bis hin zur nationalen und internationalen Ebene.
Die Selektion der richtigen Interventionsebene stellt dabei den zentralen Lösungsansatz dar, der leicht auf unsere finanziellen Nachhaltigkeitsüberlegungen angewandt werden kann. Ein robustes lokales (z. B. institutionelles) Anschubfinanzierungsprogramm kann eine effektive Initialstrategie sein.
Um Fortschritte aber längerfristig zu gewährleisten, muss die Finanzierungsebene graduell gewechselt werden (z.B. Drittmittel und später lokal-regionale Unterstützungsverfahren).7
Um das zu erreichen, kommen zwei Ansätze zum Tragen.
Der erste patientenzentrierte und datenbasierte Ansatz kann, wie zuvor geschildert, unter Erarbeitung der notwendigen Evidenz durch klare Auswirkungen in der klinischen Routineversorgung praxisverändernd sein. Dieser sogenannte Bottom-up-Ansatz erzielt schnell greifbare Ergebnisse. Andere lokale Beispiele sind intelligente Vertragsverhandlungen („smart contracting“) sowie selbstkritische Abrechnungsanalysen und Pilotprojekte mit Krankenkassen.
Der zweite Ansatz versucht die finanzielle Nachhaltigkeit auf Systemebene anzugehen. Der Schwerpunkt liegt dabei auf groß angelegten Initiativen in fachübergreifenden Leitungs-, Landes-, National- oder gar internationalen Ebenen. Dieser Top-down-Ansatz, obwohl komplex und zeitintensiv, bietet breite Handlungsspielräume und langfristige, tiefgreifende Auswirkungen. Der Top-down-Zugang gelingt beispielsweise durch Öffentlichkeitsarbeit, Forschung zur Gesundheitspolitik, Gesundheitspolitik selbst sowie eine enge Zusammenarbeit mit Interessengruppen oder Patientenvertreter:innen.
Ein weiterer Zugang, der jedoch in der Medizin weitgehend ignoriert wird, ist die …
6. … Nutzung des vorwettbewerblichen Raums
Haben Sie sich je gefragt, wo eigentlich der USB-Adapter herkommt? Vielleicht erinnern Sie sich an Ihren ersten USB-Stick oder die Frustration, als Ihr Ladekabel vor kurzem einfach nicht in den Adapter passte? Aber woher stammt dieser Standard?
Der USB-Adapter wird hier als ein erfolgreiches Implementationsbeispiel für eine Harmonisierung im sogenannten „precompetitive space“ herangezogen. Dieser Ansatz hat sich vor allem dann bewährt, wenn Interessengruppen eine technische Hürde nicht allein überwinden können.
Der „Raum“ ist schwierig zu definieren, kann aber folgendermaßen gedanklich visualisiert werden: Stellen Sie sich einen Konferenzraum vor. Darin befinden sich Vertreter:innen verschiedener Interessengruppen, die alle erkannt haben, dass ein gewisses Problem nicht allein lösbar ist. Statt dies lautstark innerhalb einer Fachgruppe zu lamentieren, treffen sich hier Personen aus diversen Bereichen unter Berücksichtigung gewisser Regeln, um dieses Problem gemeinsam interdisziplinär anzugehen.
Alle Anwesenden haben ein gemeinsames Interesse an Innovation, konkreten Lösungen und unter bestimmten Bedingungen auch an Zusammenarbeit. Jede:r bringt spezifisches Fachwissen mit in den Prozess ein.
Handelt es sich hier um ein einfaches Gespräch? Absolut nicht. Hier prallen Welten aufeinander. Es zeigen sich schnell konzeptionelle Inkompatibilitäten, Designfehler, Umsetzungs- und Finanzierungsherausforderungen.8
Mit dem richtigen Format, einer diplomatischen Herangehensweise und vorabgestimmten Regeln (sog. Verhaltenskodex) kann dieser Ansatz jedoch erstaunliche Fortschritte erzielen. Wichtig ist, alle Interessengruppen frühzeitig miteinzubeziehen. Sobald die Gruppe einen Plan spezifiziert hat, kann dieser als harmonisierter Ansatz von allen Beteiligten z. B. im Labor oder Wettbewerbsraum umgesetzt werden. Dieser Ansatz des präkompetitiven Raums hat mit gezielten Initiativen zu phänomenalen Errungenschaften des modernen Alltags wie z. B. WLAN oder Bluetooth geführt.
Es gibt auch medizinische Initiativen, z. B. die Collaborative Communities mit FDA-Beteiligung, wie die kollaborative Gemeinschaft für implantierbare Brain-Computer-Schnittstellen (iBCI-CC) oder die Gemeinschaft für Pathologieinnovationen (PIcc Alliance).
Ein weiteres Beispiel ist die Data-for-Health-Initiative, die gemeinsam mit dem deutschen Bundesgesundheitsministerium organisiert wurde. Ziel dieser Initiative ist es, verschiedene Interessengruppen zusammenzubringen und mit Expert:innen aus den Vereinigten Staaten und Europa die Prinzipien der medizinischen Datennutzung zur erarbeiten (z. B. die Forderung nach Gesundheitsdatenintegrität).9
Diese kurze Übersicht stellt den vorwettbewerblichen Raum als abstrakte Struktur mit Zielsetzung, Verhaltenskodex und Vertraulichkeitsrichtlinien dar, der einen beeindruckenden Mehrwert für die Gesellschaft durch Implementierung neuer Technologien erzielen kann. Leider ist das Agieren in diesem Raum in der Medizin derzeit unterbewertet. Auf Grund der bahnbrechenden Ergebnisse aus anderen Bereichen könnte man aber sogar so weit gehen und postulieren, dass das Handeln in diesem Raum als neue Kernkompetenz in der Medizin angesehen werden muss; insbesondere, weil die bevorstehende Implementierung von KI im Gesundheitssektor ganz klar eine interdisziplinäre Herausforderung darstellt.
Fazit
Zusammenfassend stehen wir vor enormen Herausforderungen im Gesundheitswesen.
Diese wirken sowohl von innerhalb als auch außerhalb des Gesundheitssektors auf uns ein. Die Umsetzung von KI ist und bleibt, trotz Hype, eine dieser Herausforderungen. Die KI-Implementierung in der Medizin braucht interne sowie externe Expertise, um eine angemessene Wertesteigerung in der Krankenversorgung zu ermöglichen. Dazu reichen interne Fach- und Finanzressourcen derzeit nicht aus.
Wir müssen daher effektive Personalstrukturen aus Fachkräften und Leitungsgremien (sog. Governance-Systeme) etablieren und bewährte Ansätze zur Umsetzung der diversen einrichtungsspezifischen Visionen anwenden. Mittels Nutzung des vorwettbewerblichen Raums und kollaborativer Einflussnahme durch die regulatorische Wissenschaft auf Behörden und Leistungserbringer:innen werden wir dann einer finanziellen Nachhaltigkeit näherkommen.
Die hier aufgezeigten Punkte zielen nicht auf Vollständigkeit ab. Vielmehr sollen sie als Leitgedanken dienen, um eine persönliche Auseinandersetzung mit dem Thema und Identifikation von Potenzialbereichen zu ermöglichen. Vielleicht ergeben sich einige Denkanstöße; vielleicht sogar Ideen für zugeschnittene Umsetzungsmaßnahmen.
Kurzum, das Ziel ist, unser gemeinsames Realisierungspotenzial von KI in der Patientenversorgung zu erhöhen.























































































