KI zur Diagnostik und Qualitätskontrolle
Der Einsatz von künstlicher Intelligenz (KI) hat sich in den letzten Jahren in vielen Lebensbereichen etabliert. Am prominentesten sind zweifellos Chatbots wie Chat-GPT, aber auch in der Medizin werden immer häufiger KI-Anwendungen eingesetzt. In der Gastroenterologie ist es im Speziellen der Bereich der Endoskopie und hier vor allem die Koloskopie,die sichals perfektes Feld für die Entwicklung und Anwendung von KI-Algorithmen erwiesen hat.1
Das liegt hauptsächlich daran, dass eine umfangreiche Menge an Daten benötigt wird, um ein ausreichend zuverlässiges KI-System zu entwickeln, und in der westlichen Welt, in der Screening-Programme für das kolorektale Karzinom etabliert sind, existieren für die Koloskopie die meisten Daten sowie der größte Markt bzw. Bedarf an KI-Systemen.2,3 Tatsächlich gibt es aktuell nur in der Koloskopie zugelassene und im Handel erhältliche KI-Systeme. Aber auch in anderen Bereichen der Endoskopie zeigen sich vielversprechende Ansätze für den Einsatz der KI. Dieser Artikel hat zum Ziel, einen kleinen Einblick in die zukunftsträchtige Welt der KI in der Endoskopie zu geben.
In der Koloskopie
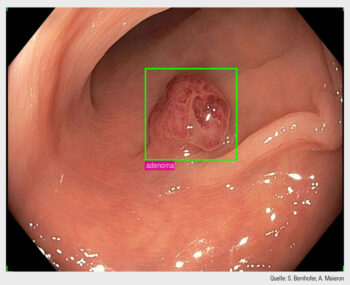
Im Allgemeinen wird in der Koloskopie zwischen zwei Kategorien der KI-Anwendung unterschieden – der computergestützten Detektion (CADe) und der computergestützten Charakterisierung (CADx). Die CADe-Anwendungen machen die Endoskopiker:innen mit Hilfe von Markierungen und/oder akustischen Signalen auf verdächtige Schleimhautbereiche aufmerksam, während CADx die Läsionin Echtzeit im Hinblick auf ihre Histopathologie im Sinne einer optischen Diagnose beurteilt.
Detektion: Für CADe gibt es bereits robuste Daten, die einen Anstieg der Adenom-Detektionsrate (ADR) unter Einsatz dieser Technologie nachweisen. Die ADR ist der wichtigste Qualitätsparameter in der Koloskopie und bezeichnet den Anteil von Untersuchungen, bei denen mindestens ein Adenom entdeckt wurde, verglichen mit der Gesamtzahl der durchgeführten Untersuchungen.
Die ADR korreliert invers mit dem Auftreten eines Intervallkarzinoms, das nach einer scheinbar negativen Koloskopie und vor der nächsten Kontrollkoloskopie auftritt. Jeder Anstieg der ADR um einen Prozentpunkt kann das Risiko für ein Intervallkarzinom um 3 % senken.4
Eine kürzlich veröffentlichte Metaanalyse fasste die Daten von 21 randomisiert kontrollierten Studien mit 18.232 Patient:innen zusammen. Hier zeigte sich eine höhere ADR in der CADe-Gruppe als in der Standard-Koloskopie-Gruppe (44,0 % vs. 35,9 %). Unerfahrene Endoskopiker:innen scheinen in größerem Ausmaß von der KI zu profitieren.5
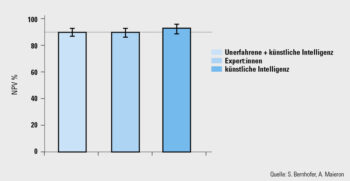
Charakterisierung: Da mit zunehmender Anzahl von entdeckten Polypen auch die Zahl der zu entfernenden Läsionen steigt, rückt die optische Diagnose von Polypen immer mehr in den Mittelpunkt des Interesses. Polypen sind nicht notwendigerweise Adenome, die per Definition prämaligne Läsionen sind, sondern können auch nichtneoplastische Läsionen sein und müssen daher nicht immer entfernt werden. In Anbetracht dessen wurden die „Diagnose-and-leave“-Strategie (vermutlich nichtneoplastische Läsionen werden belassen) oder die „Resect-and-discard“-Strategie (Polypen werden entfernt, aber nicht histopathologisch untersucht) formuliert. Voraussetzung für diese Ansätze ist eine ausreichend sichere optische Diagnose. CADx unterstützt die Endoskopiker:innen, indem es eine dichotome Einschätzung abgibt (Adenom oder Non-Adenom). Für die Unterscheidung zwischen Adenomen und harmlosen hyperplastischen Polypen im Rektosigmoid gibt es Daten, die eine ausreichend gute Aussagekraft für die Anwendung der „Diagnose-and-leave“-Strategie zeigen. Da die meisten Polypen in diesen Kolonsegmenten gefunden werden, stellt diese Anwendung einen relevanten Benefit dar. Auch in einer prospektiven Kohortenstudie an unserer Abteilung konnte der Nutzen von CADx in diesem Bereich nachgewiesen werden. In der noch nicht publizierten Studie waren unerfahrene Endoskopiker:innen mit CADx-Unterstützung Expert:innen ohne KI-Unterstützung ebenbürtig und erreichten einen negativen prädiktiven Wert von ≥ 90 % für Adenome im Rektosigmoid, der für die Anwendung der „Diagnose-and-leave“-Strategie gefordert wird (Abb. 1). Interessanterweise schnitt die KI-Anwendung allein besser ab als bei der Anwendung durch unerfahrene Endoskopiker:innen. Dieses Phänomen konnte auch im Hinblick auf die „Resect-and-discard“-Strategie in einer anderen Studie reproduziert werden.6
Einführung von Qualitätsparametern
Obwohl die Koloskopie seit einiger Zeit als geeignetes Mittel zur Darmkrebsvorsorge zur Verfügung steht, wird das volle Potenzial dieser Untersuchung aufgrund von großen Qualitätsunterschieden zwischen den Endoskopiker:innen oft nicht ausgeschöpft. In Anbetracht dieser Variabilität der Qualität ist ein angemessenes Qualitätsmanagement erforderlich. Um die Performance von Endoskopiker:innen vergleichbar zu machen und eine Standardisierung der Untersuchung zu erreichen, wurden Qualitätsparameter wie die bereits erwähnte ADR, die Zäkumerreichsrate, die Boston Bowel Preparation Scale (zur Beurteilung der Vorbereitungsqualität), die Rückzugszeit und andere Parameter als Qualitätsmaßstab eingeführt.7 Ein KI-Algorithmus, der diese Parameter automatisch berechnet, dokumentiert und in weiterer Folge einen standardisierten Befund erstellen könnte, würde zum einen die Koloskopiequalität transparenter machen und zum anderen Mindeststandards in der Dokumentation gewährleisten. Erste Schritte in diese Richtung gibt es bereits. So wurde ein KI-System entwickelt, das die Rückzugszeit exklusive der für die Polypektomien aufgewendeten Zeit berechnet und die Fotodokumentation für die Befunderstellung übernimmt.8
Des Weiteren wird aktuell auch an Algorithmen, die Schleimhautexposition und Polypengröße messen können, geforscht.9, 10 Beides würde eine große Hilfestellung für Endoskopiker:innen darstellen, da nur im Sichtfeld befindliche Polypen erkannt werden können und sich die Risikoeinschätzung für die Entwicklung von zukünftigen Neoplasien und folglich auch die Festlegung von Kontrollintervallen zum Teil an der Größe der Polypen, die bisher auf einer rein subjektiven Einschätzung beruht, orientiert.11
In der Gastroskopie
Im oberen Verdauungstrakt konzentriert sich die Entwicklung von KI-Anwendungen hauptsächlich auf die Früherkennung von Ösophaguskarzinomen und hier vor allem auf Barrett-Läsionen.
Barrett-Ösophagus: In den letzten Jahren hat der Barrett-Ösophagus als Präkanzerose für ein Adenokarzinom nicht nur in der westlichen Welt, sondern auch in Asien zugenommen, was den dringenden Bedarf an einer effizienten Diagnostik verdeutlicht.12 Aktuell basiert das Screening auf optischer Diagnose und (un)gezielter Biopsieentnahme, deren Qualität sehr von den Untersuchenden abhängig ist. Ansätze, in denen KI-Algorithmen die Endoskopiker:innen unterstützen können, beschäftigen sich neben der genauen Lokalisation und der prognostisch relevanten Bestimmung der Ausdehnung des Barrett-Ösophagus vor allem mit der Erkennung von neoplastischen Arealen. Erste Daten von KI-Algorithmen, die Barrett-Läsionen erkennen und richtig klassifizieren (CADe und CADx), sind vielversprechend.13–15
Magenkarzinom: Auch zur Früherkennung von Magenkarzinomen werden KI-Algorithmen entwickelt. Frühkarzinome wären prinzipiell einer endoskopischen Resektion durch eine endoskopische Submukosadissektion zugänglich, werden aber oft nicht erkannt, da sie schwer von entzündeter Schleimhaut zu unterscheiden sind. In einer Auswertung zeigte sich, dass bei 11,3 % der Magenkarzinome in den drei Jahren vor der Diagnose eine scheinbar negative Gastroskopie durchgeführt wurde.16
Auch hier gibt es Daten, die zeigen, dass KI-Algorithmen die Erkennung und in einem nächsten Schritt die Abschätzung der Invasionstiefe von frühen Magenkarzinomen verbessern können.17
In der Videokapselendoskopie
Pathologien im Jejunum und Ileum sind selten, stellen aber eine diagnostische Herausforderung dar, da sie über konventionelle endoskopische Untersuchungen (Gastro- und Koloskopie) nicht suffizient erreichbar sind. Als häufiges diagnostisches Mittel, um diesen „blinden Fleck“ zu beurteilen, wird auf die Videokapselendoskopie zurückgegriffen.
Bei mehreren tausend Einzelbildern ist die Auswertung der Videokapsel herausfordernd. KI-Algorithmen können hier eine große Hilfe darstellen, indem sie auffällige Bilder vorselektieren und somit die Auswertungszeit verkürzen können.18
Zusammenfassung
KI-Anwendungen haben in der Koloskopie bereits Fuß gefasst und werden in den kommenden Jahren auch in anderen Bereichen der Endoskopie im klinischen Alltag eine Rolle spielen. Festzuhalten bleibt auch, dass KI niemals als Ersatz, sondern nur als Unterstützung betrachtet werden kann, da letztendlich immer die Untersuchenden für die Qualität der Untersuchung verantwortlich sind.