Muskelgewebe vom Bioingenieur
Scheitern konventionelle klinische Behandlungen daran, die fortschreitende Verminderung einer Organfunktion zu verhindern, werden Organtransplantationen erforderlich. Die Nachfrage nach Organtransplantationen ist jedoch deutlich höher als das vorhandene Angebot an Spenderorganen. Dies führt zu langen Wartezeiten auf Organspenden und in weiterer Folge zu einem negativen Krankheitsverlauf für viele Patient:innen.
Tissue Engineering ist eine innovative Methode, um das Fortschreiten der Erkrankung frühzeitig zu bremsen und die Abhängigkeit von Spenderorganen zu reduzieren. Dabei gilt es, neue Gewebe und weitere künstliche Organe im Labor zu entwickeln, welche die Struktur und Funktion natürlicher Gewebe und Organe nachahmen.1
Von der Holzzehe zum Kunstherz
Das Konzept künstlicher Organe lässt sich bis zur antiken Zivilisationen zurückverfolgen, in denen Versuche unternommen wurden, Körperteile zu replizieren und zu ersetzen. Beispielsweise stellten die alten Ägypter hölzerne Zehen, Gliedmaßen und sogar künstliche Augen als Ersatz für das natürliche Organ her.
Die moderne Ära künstlicher Organe begann im späten 20. Jahrhundert, als bedeutende Fortschritte auf dem Gebiet der Biomaterialwissenschaften, Biotechnologie und des Gewebe-Ingenieurwesens erzielt wurden. Eine frühe daraus resultierende Innovation war die Entwicklung des ersten implantierbaren künstlichen Herzens durch Dr. Robert Jarvik in den 1980er-Jahren.2
Dieser Erfolg war wegweisend, jedoch ist im Bereich des Tissue Engineering und der regenerativen Medizin noch ein langer Weg zu beschreiten, bis komplette biokompatible und funktionale künstliche Organe erschaffen werden können.
Gerüst für Stammzellen
Tissue Engineering umfasst verschiedene Technologien, die vor allem zur Produktion von Gerüsten (Scaffolds) verwendet werden. Diese fungieren als Rahmen oder Struktur zur Unterstützung des Wachstums neuer Gewebe (Abb. 1).3, 4
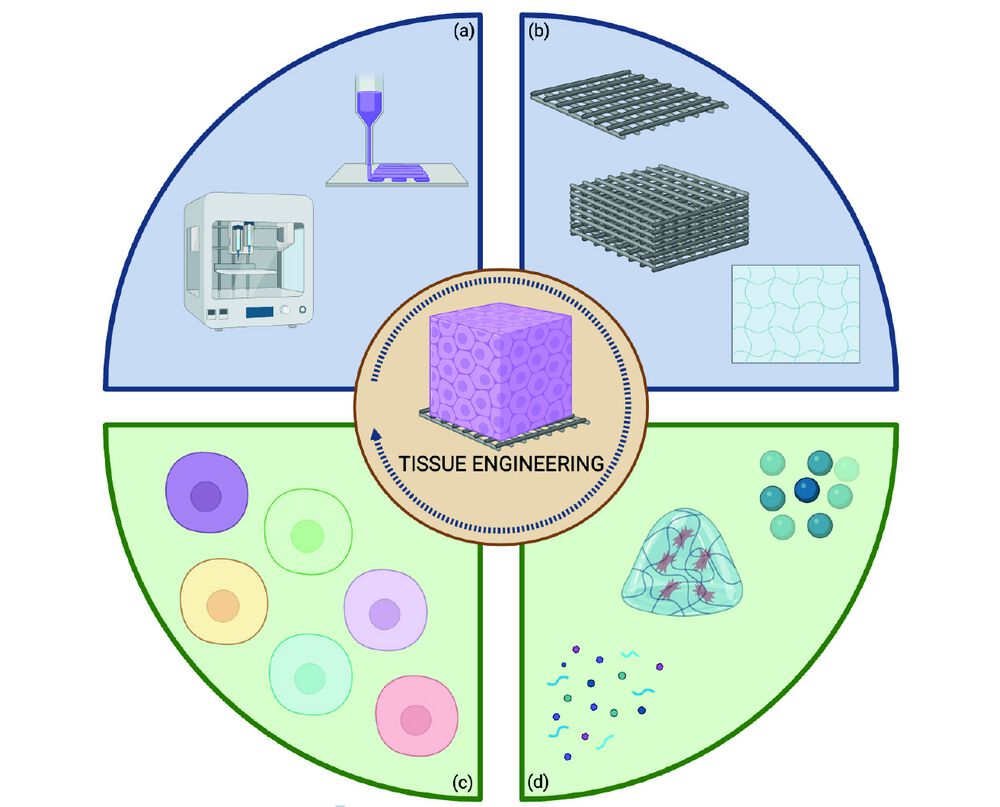
Abbildung 1: Grundpfeiler des Tissue Engineering: (a) Technologien zur Erstellung von Gerüsten, (b) Gerüste (Scaffolds), (c) Zellen und (d) Wachstumsfaktoren
Zellen wie Stammzellen oder Primärzellen werden auf das Gerüst übersiedelt, wo sie sich in weiterer Folge vermehren und in die gewünschten, für das jeweilige Zielorgan passenden Zelltypen differenzieren können. Dabei werden Wachstumsfaktoren als Signalstoffe eingesetzt, die das Zellverhalten regulieren und die Geweberegeneration stimulieren. Zusammen wirken diese Komponenten synergistisch, um die natürliche biologische Umgebung nachzuahmen und die Entwicklung gesunder, funktionaler künstlicher Gewebe zu fördern. Dieser Ansatz ist besonders vielversprechend für die regenerative Medizin und zukünftige Organtransplantation.5
Schritt 1: Biomaterial auswählen
Der erste Schritt beim Gerüstbau besteht darin, ein geeignetes Biomaterial zur Interaktion mit biologischen Systemen auszuwählen. Die verwendeten Biomaterialien werden basierend auf ihrer Herkunft in zwei Gruppen unterteilt: natürliche und synthetische Biomaterialien. Natürliche Biomaterialien, die von lebenden Organismen stammen, umfassen Substanzen wie Kollagen, Chitosan und Alginat, die für verschiedene medizinische Anwendungen Biokompatibilität und Bioaktivität bieten. Im Gegensatz dazu umfassen synthetische Biomaterialien, die im Labor chemisch hergestellt werden, Materialien wie Polymere (z.B. Polymilchsäure, Polyethylenglykol) und Keramiken, die anpassbare Eigenschaften und kontrollierte Abbauraten bieten und somit für spezifische biomedizinische Anforderungen geeignet sind.6
Schritt 2: Technologie auswählen
Der zweite Schritt beim Gerüstbau besteht darin, die geeignete Technologie zur Erstellung der 3D-Konstrukte auszuwählen. Das Ziel ist es, die extrazelluläre Matrix (ECM) von natürlichem Gewebe nachzuahmen und dabei individuelle patientenspezifische Merkmale zu berücksichtigen. Die neueste hierfür verwendete Technik ist der 3D-Druck, der sich zudem durch eine bemerkenswerte Präzision und Anpassungsfähigkeit auszeichnet.
3D-Bioprinting
Bei dieser Technik werden die Biomaterialien/Bio-Inks, Zellen und Wachstumsfaktoren schichtweise aufgetragen und so komplexe dreidimensionale gewebemäßige Strukturen hergestellt. Durch die Nutzung von medizinischen Bildgebungsdaten aus CT- oder MRT-Scans können Bioprinter Implantate generieren, die genau auf die Spezifikationen einzelner Patient:innen zugeschnitten sind, was eine perfekte Passform gewährleistet und die Behandlungsergebnisse verbessert. Dadurch ergibt sich in verschiedenen medizinischen Bereichen wie dem kardiovaskulären Tissue Engineering, der Orthopädie und der Zahnmedizin ein großes Potenzial. Der 3D-Druck bietet so die Möglichkeit, die Patientenversorgung zu revolutionieren, indem personalisierte Lösungen für vielfältige klinische Bedürfnisse angeboten werden können.7
Stand der Technik
Unsere Forschungsgruppe am Zentrum für Biomedizinische Forschung und Translationale Chirurgie der Medizinischen Universität Wien arbeitet an einer 3D-Druckplattform, die Gerüste für die Konstruktion sowohl harter als auch weicher Gewebe aus Biomaterialien herstellen soll. Sowohl synthetische als auch natürliche Materialien werden dabei von uns verwendet (Beispiele siehe Abbildung 2).

Abbildung 2: Beispiele 3D-gedruckter Konstrukte an der Medizinischen Universität Wien: (a) Konstrukt zur gezielten Medikamentenverabreichung (b) Gitterstrukturen (c) Cardiac Patch (d) Design einer Herzklappe (e) Herzklappe (f) Muskelfasern (g) 3D-gedruckte Nase
Zum Beispiel zeigte Polycaprolacton (PCL), ein von der FDA zugelassenes bioabbaubares Polymer, vielversprechende Ergebnisse als Kandidat für die Erstellung eines hochauflösenden Cardiac Patch mit mechanischem nichtlinearem Verhalten, das die Anisotropie des Herzmuskels nachahmt.
Darüber hinaus haben Seiden-Gelatine-Extrazellulärmatrix-(ECM-)Komposithydrogele (SGE) großes Potenzial für die Entwicklung von Weichgewebe gezeigt. Diese Hydrogele zeichnen sich durch einstellbare mechanische Eigenschaften, gleichbleibende Elastizität und bioaktive Funktionen aus.
Biotinte für den 3D-Drucker
Ein Hauptbestandteil dieses Komposits ist die extrazelluläre Matrix (ECM) mit hoher Affinität zur Zelladhäsion, -proliferation und -regeneration als Biotinte für das 3D-Bioprinting.8 Die Entwicklung von ECM-Biotinten umfasst die Dezellularisation, dabei werden die zellulären Komponenten aus natürlichen Geweben entfernt, wodurch nur noch die extrazelluläre Matrix zurückbleibt, die aus Proteinen, Glykoproteinen und anderen Biomolekülen besteht, die strukturelle Unterstützung und Signalgebung für Zellen bieten.9 Diese zellfreie ECM dient als Biotinte beim 3D-Bioprinting und bietet eine natürliche und biokompatible Umgebung für das Zellwachstum und die Gewebebildung.8 Die Entwicklung von entzellter extrazellulärer Matrix (ECM) und 3D-Bioprinting steht jedoch vor mehreren Herausforderungen in der Bioingenieurwissenschaft.
Vom Labor in die Klinik
3D-Bioprinting erfordert eine präzise Kontrolle über Druckparameter wie Druckgeschwindigkeit, Düsengröße und Bio-Ink-Viskosität, um komplexe Gewebestrukturen mit hoher Genauigkeit herzustellen. Die Erreichung einer adäquaten Vaskularisierung und die Schaffung von Gefäßnetzwerken und Zell-Zell-Interaktionen innerhalb gedruckter Konstrukte zur Unterstützung des Zellüberlebens und der -funktion bleiben eine bedeutende Herausforderung, um die Komplexität biologischer Organe zu imitieren. Allerdings könnten eine aktive interdisziplinäre Zusammenarbeit, Fortschritte in den Biomaterialwissenschaften, innovative Fertigungstechniken und umfangreiche präklinische Tests künstliche Organe und Gewebe effektiv vom Labor in die Klinik bringen. Die Zukunft der künstlichen Organ- und Gewebeingenieurwissenschaft birgt großes Potenzial, die Gesundheitsversorgung zu transformieren, indem sie innovative Lösungen zur Bewältigung von Organmangel bietet und die Patientenergebnisse verbessert. Diese bioingenieurtechnisch hergestellten Konstrukte haben das Potenzial, Transplantationen zu revolutionieren, indem sie personalisierte, sofort einsatzbereite Lösungen bieten, die den Bedarf an Spenderabstimmung und Immunsuppression beseitigen.






















































































