ASAS-Kriterien und Diagnose der peripheren Spondyloarthritis
Spondyloarthritiden (SpA) sind eine Gruppe von klinisch und genetisch verwandten Erkrankungen1. Zur Gruppe der SpA werden die ankylosierende Spondylitis als typischer Vertreter dieser Erkrankungsgruppe, die Arthritis psoriatica, die Arthritis bei chronisch entzündlichen Darmerkrankungen, die reaktive Arthritis und eine Form der juvenilen idiopathischen Arthritis gezählt. Klinisch manifestieren sich die SpA mit einem entzündlichen Rückenschmerz, mit einer die unteren Extremitäten bevorzugt befallenden Arthritis, mit Enthesitiden und Daktylitiden sowie mit extraskelettalen Manifestationen wie Uveitis, Psoriasis vulgaris, chronisch entzündlicher Darmerkrankung und manchmal nach gastrointestinalen oder urogenitalen Infektionen in der Anamnese. Genetisch ist bei allen Erkrankungen der Gruppe das Major Histokompatibilitätsantigen HLA-B27 überhäufig oft nachweisbar2. Die niedrigste Prävalenz mit 6 % findet sich bei chronisch entzündlichen Darmerkrankungen mit peripherer Skelettbeteiligung, die höchste bei ankylosierender Spondylitis mit über 90 %.
Frühere Kriterien und Notwendigkeit der Adaption
Dem Konzept der SpA folgend haben Amor und Mitarbeiter und anschließend auch die european Spondyloarthropathy Study Group (ESSG) vor zwei Jahrzehnten versucht, Kriterien zur Klassifikation der gesamten Gruppe der SpA zu entwickeln3, 4. Während in den Amor-Kriterien jede Kombination an typischen SpA-Symptomen zur Klassifikation einer SpA beiträgt, muss für die Erfüllung der ESSG-Kriterien zumindest ein entzündlicher Rückenschmerz oder eine periphere Arthritis vorliegen.
Mit der Einführung der Magnetresonanztomographie (MRT) und der Tumornekrosefaktor-Blocker (TNF-Blocker) in der Behandlung der SpA entstand die Notwendigkeit, die bisherigen Kriterien zu adaptieren und gleichzeitig eine umfassendere Klassifikation für frühe Krankheitsstadien zu entwickeln. Um insbesondere die frühen Stadien der ankylosierenden Spondylitis zu charakterisieren, wurden von der Gruppe um Sieper und Mitarbeiter in Berlin Klassifikationskriterien für die axiale SpA entwickelt5, 6. Im Zentrum dieser Kriterien stehen der radiologische Nachweis einer Sakroiliitis und die Detektion von HLA-B27. Da diese Kriterien Spondyloarthritiden mit ausschließlichem peripheren Skelettbefall und fehlender HLA-B27-Expression nicht inkludieren, war es erforderlich, auch Kriterien für ausschließlich periphere SpA zu formulieren. Diese Arbeit wurde ebenfalls von der Gruppe um Rudwaleit und Sieper in Zusammenarbeit mit anderen Mitgliedern der ASAS-Gruppe, einer weltweiten Vereinigung von Rheumatologen mit speziellem Interesse an SpA, durchgeführt7 und ist zentraler Gegenstand dieses Artikels.
Klassifikationskriterien für die periphere SpA
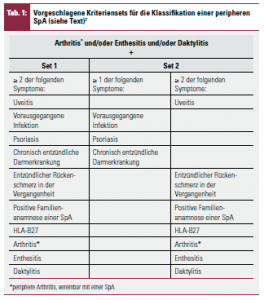
Für die Entwicklung der Klassifikationskriterien für die periphere SpA wurden von Mitgliedern der ASAS-Gruppe zwei Sets an Parametern zusammengestellt und diese anhand von 35 Patientenkarteien getestet. Die Patienten mussten an einer für eine SpA typischen Arthritis und/oder Enthesitis und/oder Daktylitis leiden und zusätzlich mindestens zwei Symptome (Set 1) oder mindestens eines der Symptome vorausgegangene Infektion, Psoriasis oder chronischentzündliche Darmerkrankung (Set 2a) oder zwei der Symptome Uveitis, entzündlicher Rückenschmerz in der Vergangenheit, positive Familienanamnese einer SpA, HLA-B27, Arthritis, Enthesitis oder Daktylitis (Set 2b) aus den in Tabelle 1 aufgelisteten Parametern aufweisen. Diese Sets an Parametern wurden dann an 266 Patienten ohne Rückenschmerzen, die jünger als 45 Jahre waren, an 24 Zentren in 15 Ländern getestet. Patienten wurden in die Auswertung einbezogen, wenn sie erstmals einem rheumatologischen Zentrum vorgestellt worden waren und lediglich der Verdacht auf eine SpA bestand. Die Patienten litten im Durchschnitt 10 ± 19 Monate an einer peripheren Arthritis, die in 86 % asymmetrisch an den unteren Extremitäten aufgetreten war. Bei 176 (66 %) der 266 untersuchten Patienten konnte eine periphere SpA diagnostiziert werden, wobei bei 85 % der untersuchenden Rheumatologen die Sicherheit der Diagnose mit > 7 auf einer 10-teiligen Skala angegeben wurde. Interessanterweise war – obwohl klinisch stumm – bei 20 % der mit einer peripheren SpA klassifizierten Patienten eine nativradiologisch und in 44 % eine MR-tomographisch nachweisbare Sakroiliitis zu finden.
Einigung auf neue Kriterien. Das Set 1 an Parametern klassifizierte die in die Studie eingeschlossenen Patienten mit einer Sensitivität von 63 % und einer Spezifität von 90 % als SpA-Patienten. Auch Set 2 an Parametern klassifizierte die Patienten mit einer Sensitivität von 67 % und einer Spezifität von 84 % ähnlich gut. Da beide Sets an Kriterien eine hohe Spezifität für eine periphere SpA aufwiesen, die Sensitivität des Sets 2 für eine periphere SpA jedoch höher war, wurde durch Einfügen von weiteren für eine SpA typischen Parametern wie dem HLA-B27, der Uveitis und der radiologisch nachweisbaren Sakroiliitis versucht, die Sensitivität weiter zu erhöhen. Dies gelang am besten durch die Einfügung aller zusätzlichen Parameter, also dem HLA-B27, der Uveitis und der radiologisch nachweisbaren Sakroiliitis (Abb.). Der radiologische Nachweis einer Sakroiliitis erfolgte entweder nativradiologisch nach den modifizierten New-York-Kriterien oder MR-tomographisch nach der ASAS/OMERACT-Definition8, 9. Durch die Modifikation des Sets 2 erhöhte sich die Sensitivität auf 78 %, wobei die Spezifität für eine SpA nur von 84 % auf 82 % absank. In einer Abstimmung unter ASAS-Mitgliedern wurde dieses Set an Parametern mit einer Zustimmungsrate von 67 % als neue ASAS-Kriterien für eine periphere SpA akzeptiert.
Somit stehen nun Kriterien für die Klassifikation von SpA-typischen Symptomen als axiale oder periphere SpA zur Verfügung. Diese Klassifikationen ermöglichen uns, die Wirksamkeit von therapeutischen Interventionen, die für axiale und periphere SpA verschieden sein können, in einheitlichen Kohorten zu studieren. Es ist aber zu bedenken, dass eine scharfe Trennung in eine axiale oder periphere SpA mit der Etablierung der nun vorliegenden Klassifikationskriterien nicht gelingt, da in der untersuchten Kohorte 44 % der als periphere SpA klassifizierten SpA-Patienten mit einer MR-tomographisch nachweisbaren Sakroiliitis – also einem typischen Symptom der axialen SpA – einhergingen. Da die ASAS-Kriterien für eine periphere SpA das Bestehen einer Arthritis, einer Enthesitis oder einer Daktylitis für die Klassifikation der Erkrankung voraussetzen, ist zu berücksichtigen, dass klinische Krankheitsbilder ohne die genannten Symptome bei Vorliegen z. B. einer Uveitis weiterhin nicht klassifizierbar sind. Mit der Entwicklung von unterschiedlichen Kriterien für die axiale und periphere SpA wurde zudem das Ziel eines einheitlichen klinischen Konzeptes für die SpA verlassen, obwohl wir ihm im klinischen Alltag bevorzugt begegnen.
Diagnose der peripheren SpA
Die Diagnose der meisten entzündlich-rheumatischen Erkrankungen erfolgt nicht durch die Erhebung eines spezifischen Befundes, sondern als ärztliche Leistung in der Zusammenschau von für eine SpA typischen Symptomen. Ein solches Vorgehen wurde für die Diagnose einer axialen SpA bereits postuliert10, wobei prospektive Langzeitstudien über die Wertigkeit des vorgeschlagenen diagnostischen Pfades noch fehlen.
Für das Vorgehen bei der Diagnose einer peripheren SpA liegen bisher keine ähnlichen Empfehlungen vor. Da die periphere SpA eine Gruppe von heterogenen Krankheitsbildern, wie das mit einer Psoriasis assoziierten SpA, umfasst und eine periphere SpA häufig in eine axiale SpA übergehen kann, stellt sich die Frage nach dem Sinn einer solchen Diagnose. Außerdem wird die Stellung der Diagnose einer peripheren SpA den unterschiedlichen diagnostischen und therapeutischen Erfordernissen bei einer reaktiven Arthritis, einer Arthritis psoriatica oder einer mit einer chronisch entzündlichen Darmerkrankung assoziierten SpA nicht gerecht. Somit könnte derzeit der Begriff der peripheren SpA im klinischen Alltag lediglich den Begriff der undifferenzierten SpA ablösen.
Es sei auch angemerkt, dass der Begriff „periphere Spondyloarthritis“ in sich widersprüchlich ist. „Spondylos“ leitet sich aus dem Griechischen her und bedeutet Wirbelknochen. Spondyloarthritis bedeutet folgerichtig „Wirbelknochenentzündung“, eine Veränderung, die bei Vorliegen einer peripheren SpA nicht beobachtet werden kann. Ein Ausweg aus dem beschriebenen diagnostischen Dilemma könnte in Zukunft in einer Änderung der Nomenklatur der SpA bestehen, die neben den Begriffen axiale Spondyloarthritis und periphere Spondyloarthritis auch die Begriffe axiale/periphere Spondyloarthritis bei Psoriasis, bei chronisch entzündlichen Darmerkrankungen sowie reaktive axiale/periphere Spondyloarthritis beinhaltet. Sollte ein Patient sowohl axiale als auch periphere Symptome der SpA aufweisen, könnte der Präfix „axiale“ oder „periphere“ weggelassen und nur von einer Spondyloarthritis gesprochen werden.
1) Dougados M, Baeten D, Spondyloarthritis. Lancet 2011; 377:2127–2137.
2) Calin A, Ankylosing spondylitis. In: Hochberg MC et al., Rheumatology. 4th ed., Saunders, Philadelphia 1998; 1021–1037.
3) Amor B, Dougados M, Mijiyawa M, Criteria of the classification of spondylarthropathies. Rev Rhum Mal Osteoartic 1990; 57:85–89.
4) Dougados M, van der Linden S, Juhlin R et al., The European Spondyloarthropathy Study Group preliminary criteria for the classification of spondyloarthropathy. Arthritis Rheum 1991; 34:1218–1227.
5) Rudwaleit M, Landewé R, van der Heijde D, et al., The development of Assessment of SpondyloArthritis International Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009; 68:770–776.
6) Rudwaleit M, van der Heijde D, Landewé R, et al., The development of Assessment of SpondyloArthritis Iternational Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68:777–783.
7) Rudwaleit M, van der Heijde D, Landewé R et al., The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011; 70:25–31.
8) Rudwaleit M, Jurik AG, Hermann KG et al., Defining active sacroiliitis on magnetic resonance imaging (MRI) for classification of axial spondyloarthritis: a consensual approach by the ASAS/OMERACT MRI group. Ann Rheum Dis 2009; 68:1520–1527.
9) Van der Linden S, Valkenburg HA, Cats A, Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum 1984; 27:361–368.
10) Rudwaleit M, van der Heijde D, Khan MA et al., How to diagnose axial spondyloarthritis early. Ann Rheum Dis 2004; 63:535–543.