Grundlagen der Pharmakoökonomie
Methoden der gesundheitsökonomischen Evaluation
Diese umfassen sowohl die rein deskriptive Erhebung von Krankheitskosten als auch die Berechnung von Kostenminimierungsmöglichkeiten beim Vergleich von Therapien mit ähnlichem klinischen Effekt. Weiters kann mithilfe von Kosteneffektivitätsstudien evaluiert werden, ob das langfristig bessere klinische Outcome einer Intervention die im Lauf der Jahre anfallenden Kosten aufwiegt. Eine Kosten-Nutzwert-Analyse verwendet im Unterschied zur Kosteneffektivitätsstudie hierfür nicht klinische Parameter (wie z. B. Remissionsraten oder gewonnene Lebensjahre), sondern den QALY (s. u.) als Outcome. Meist werden die Begriffe Kosteneffektivitäts- bzw. Kosten-Nutzwert-Analyse allerdings synonym verwendet (in der Folge abgekürzt als CEA). Die beiden letzteren Methoden können für eine konkrete therapeutische Fragestellung einen Vergleich aller bestehenden Behandlungsoptionen mit ihren jeweiligen Trade-offs zwischen langfristigen Kosten und Nutzen liefern, was Entscheidungsträgern als Grundlage für die Auswahl der kosteneffektivsten Therapie dient. Kosten Hier sind direkte Kosten, die sich aus medizinischen (Diag nostik, Therapie, …) und nichtmedizinischen Kosten, z. B. für notwendige Umbauten bei Behinderung, zusammensetzen, von indirekten Kosten zu unterscheiden. Letztere werden auch volkswirtschaftliche Kosten genannt, sie beinhalten Belastungen, die für die Gesellschaft entstehen, wie z. B. Arbeitsausfälle. Die Tabelle gibt einen Überblick. Mit der Auswahl der berücksichtigten Kostenträger in einem gesundheitsökonomischen Modell wird die Perspektive der Berechnungen festgelegt, die sowohl gesamtgesellschaftlich alle anfallenden Kosten beinhalten, als auch zum Beispiel als „provider’s perspective“ nur Teilaspekte der finanziellen Belastungen einschließen kann.
Nutzen
Dieser ergibt sich aus der Effektivität der analysierten Therapie, die meist in Form von so genannten QALY in die Berechnungen eingeht. QALY (für „Quality Adjusted Life Years“) werden ermittelt, indem Lebensabschnitten in unterschiedlichen Gesundheitszuständen ein subjektiver Wert zwischen 0 (ein Zustand, der vom Patienten als gleichwertig mit dem Tod gesehen wird) und 1 (für „perfekte Gesundheit“) zugeordnet wird1. Anders als bei der Verwendung krankheitsspezifischer Outcomes, wie ACR-Responseraten etc., wird es durch den QALY theoretisch auch möglich, „krankheitsübergreifend“ zu bestimmen, mit welcher Investition der größte Nutzen für Patienten erkauft werden kann.
Rheumatologische Fragestellungen
Um ein Beispiel aus der Rheumatologie anzuwenden, bietet sich vor allem die rheumatoide Arthritis (RA) an, die ein lohnendes Feld für pharmakoökonomische Modelle darstellt: mit einer Prävalenz von 1 % weltweit ist es eine relativ weit verbreitete Erkrankung, die zudem wegen des frühen Beginns und möglicherweise invalidisierenden Verlaufs hohe Folgekosten für Gesellschaft und Individuum verursacht. Durch den Einsatz von Biologika sind entscheidende therapeutische Fortschritte möglich, allerdings verbunden mit deutlich höheren Behandlungskosten als bei alleiniger Verwendung von synthetischen DMARD. Biologika verbessern durch effiziente Unterdrückung der Krankheitsaktivität die funktionelle Kapazität, wodurch eine höhere Lebensqualität erreicht wird und die Patienten auch länger im Arbeitsprozess gehalten werden können.
Beispiel für ein gesundheitsökonomisches Modell von Biologika
Aufgrund von Registry-Beobachtungen wird ein „natürlicher“ Krankheitsverlauf postuliert. In ein Modell wird dieser Verlauf mithilfe von Wahrscheinlichkeiten implementiert, die den Übertritt von einem Krankheitsstadium (zum Beispiel einem HAQ von 1 bis 2) in ein anderes (z. B. die Verschlechterung des HAQ auf einen Bereich zwischen 2 und 3 im nächsten Jahr) beschreiben. Die Effektivität eines Biologikums geht dann als mathematischer Faktor in die Berechnungen ein, der diese Wahrscheinlichkeit beeinflusst (z. B. im Sinne einer größeren Chance auf funktionelle Besserung). Daten zur Effektivität von Therapien werden einerseits aus randomisierten klinischen Studien, anderseits aus observationellen Studien und Krankheitsregistern abgeleitet, QALY werden dabei meistens indirekt aus dem HAQ berechnet2. Mithilfe solcher Modelle wird es möglich, sowohl Kosten als auch Nutzen auf längere Zeiträume zu extrapolieren als Studiendaten üblicherweise zur Verfügung stehen. Idealerweise kann eine Vorhersage über das lebenslange therapeutische Outcome getroffen werden, womit auch die Auswirkung von Therapien auf das Gesamtüberleben berücksichtigt wird. Das Ergebnis der CEA wird in Form von „Incremental Cost Effectiveness Ratios“ (ICER) angegeben. Dieser Wert beschreibt die zusätzlichen Kosten pro gewonnenem QALY für jede geprüfte Intervention. Als Referenz werden die Langzeitkosten und Nutzen einer Monotherapie mit DMARD berechnet und ein Ranking der ICER aller zur Verfügung stehenden Biologika abgeleitet. Als Richtwert für eine Refundierung von Therapien wird üblicherweise ein ICER von < 100.000 US-Dollar (manchmal < 50.000 US-Dollar) in Relation zur nächstgünstigeren therapeutischen Alternative angegeben.
Limitationen
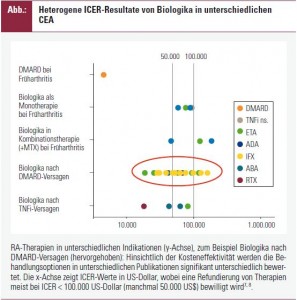
Eine Reihe von Einschränkungen sind zu nennen: QALY für RAModelle werden wie erwähnt meist aus dem HAQ indirekt berechnet2, was eigentlich nicht der ursprünglichen Definition entspricht, nach der QALY aus Bewertungen der Lebensqualität abzuleiten sind3. Diese werden aber in klinischen Studien nicht in ausreichendem Maß erhoben. Weiters ist der oben angesprochene „natürliche Krankheitsverlauf“ ein Postulat, das nicht unproblematisch ist, da in der RA bekanntermaßen sehr unterschiedliche Verläufe beobachtet werden, die nur bedingt vorhersagbar sind. Auch die Extrapolation der Wirkung von Therapien weit über den Zeitraum von klinischen Studien hinaus, die ja ebenfalls ein Kernstück der ökonomischen Evaluation darstellt, beruht auf Annahmen, die auf Basis der derzeitigen Datenlage nicht absolut zu verifizieren sind: eine offene Frage ist zum Beispiel, wie ausgeprägt im Fall einer jahrelangen Therapie die eventuell eintretende Wirkungsabschwächung angenommen werden muss. Weiters birgt die Synthese inhomogener Studienendpunkte zur Ermittlung der therapeutischen Effizienz Probleme: teils sind primäre Outcomes als Responseraten, teils als das Erreichen von Krankheitsstadien definiert; Head-to- Head-Studien sind weitgehend ausständig. Diese und andere offene Fragen machen gesundheitsökonomische Evaluationen einerseits zu einem methodologisch spannenden Feld, stellen aber andererseits RezipientInnen vor das Problem, manchmal sehr heterogene Resultate verschiedener Analysen einander gegenüberstellen zu müssen. Die Abbildung illustriert dies anhand einer Zusammenstellung der ICER von Biologika in verschiedenen Indikationen bei RA Patienten7: CEA bewerten die Kosteneffektivität durchaus unterschiedlich – beachtenswert ist, dass als Richtwert für die Kostenerstattung üblicherweise ein ICER von 100.000 US-Dollar angegeben wird: in unterschiedlichen Analysen fallen dieselben Biologika teils weit unter, teils über diese Grenze (Abb.). Lösungsansätze bestehen in der Erstellung von Standards für pharmakoökonomische Modelle, wie sie zum Beispiel von OMERACT publiziert wurden4. Weiters ist eine möglichst transparente Beschreibung der verwendeten Methoden und Datenquellen gefordert sowie die Durchführung von Sensitivitätsanalysen, um die Robustheit von Resultaten zu untermauern.
Resümee
Kosteneffektivitätsanalysen stellen eine Grundlage für die Bewilligung von Kostenerstattungen in der Medizin dar und fließen zunehmend auch in klinische Behandlungsrichtlinien ein. Im Spannungsfeld zwischen medizinisch wünschenswerten und finanziell machbaren Therapien bieten sie eine Entscheidungshilfe zur rationellen Investition von Ressourcen. Methodologische Limitationen und eine teilweise unzureichende Datenlage erfordern jedoch eine vorsichtige Interpretation der Ergebnisse.
1 Sox HC, Blatt MA, Higgins MC, Marton KI, Medical Decision Making 2007, American College of Physicians
2 Boggs R, Sengupta N, Ashraf T, 20. Estimating health utility from a physical function assessment in rheumatoid arthritis (RA) patients treated with adalimumab (HUMIRA). 2002, International Society of Pharmacoeconomics and Out – comes Research.
3 Marra CA et al., Not all “quality-adjusted life years” are equal. J Clin Epidemiol. 2007 Jun; 60(6):616–24
4 Maetzel A, Tugwell P, Boers M et al., on behalf of the OMERACT 6 Economics Research group. Economic evaluation of programs of interventions in the management of rheumatoid arthritis: defining a reference case. J Rheumatol 2003; 30:891–6
5 Weber C, Lauterbach KW, Internist 2000; 41:349–354 Springer-Verlag 2000
6 Drummond M, Stoddart G, Rorrance G, Methods for the Economic Evaluation of Health Care Prgrammes, 1997
7 Schoels M, Wong J, Scott DL, Zink A, Richards P, Landewe R, Smolen JS, Aletaha D, Economic aspects of treatment options in rheumatoid arthritis: a systematic literature review informing the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis. 2010 Jun; 69(6):995–1003.
8 Smolen JS et al., EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis. 2010 Jun; 69(6):964–75.