Immunsuppressiva als Therapie schwerer COVID-19-Fälle – sind sie Zukunft oder Vergangenheit?
Univ.-Prof. Dr. Günter Weiss: Man geht davon aus, dass 20 % bis 50 % aller Infizierten asymptomatisch sind. Hier stellt sich jedoch die Frage, was der Begriff „asymptomatisch“ genau besagt. Oft sind sogenannte „Asymptomatische“ auch solche, die in Folge des „contact tracings“ positiv getestet werden, d. h. diese Personen haben vielleicht lokal nur wenig Virus abbekommen und das mit der lokalen Immunität entsprechend eliminiert, ohne dass jemals eine systemische Infektion aufgetreten ist.
Bei Personen, die wirklich asymptomatisch sind und das auch bleiben, liegt die Viruslast meistens auch unter der infektiösen Dosis. Dazu gibt es mittlerweile gute Studiendaten, beispielsweise von Kreuzfahrtschiffen, die zeigen, dass Personen, die in Folge des „contact tracings“ zwar positiv getestet wurden, aber ohne Symptomatik blieben, auch kaum jemanden angesteckt haben. Das heißt, bei ihnen ist entweder die „virus clearance“ schon lokal im Nasen-Rachen-Raum erfolgt, oder die Viruslast war so gering, dass es zu keiner Weiterverbreitung der Infektion gekommen ist.
Ja, das gilt als ein definierendes Symptom. Es gibt Betroffene, die eigentlich nur dieses Symptom angaben, aber kein Fieber hatten. Hier scheint es also sehr wohl unterschiedliche Manifestationen zu geben.
Es könnte mit einer individuell unterschiedlichen Verteilung der ACE-Rezeptoren zusammenhängen, die sich ja in vielen Organen finden, vielleicht aber auch mit immunologischen Prädispositionen. Auch Hormone könnten mit eine Rolle spielen.
Grob gerechnet haben etwa 80 % der Erkrankten leichte, etwa 20 % jedoch schwere Verläufe. Von diesen muss ein Drittel bis die Hälfte hospitalisiert werden. Und von diesen Patienten bedürfen wiederum 20–40 % einer Beatmungstherapie bzw. Atemunterstützung, sei sie nichtinvasiv oder invasiv.
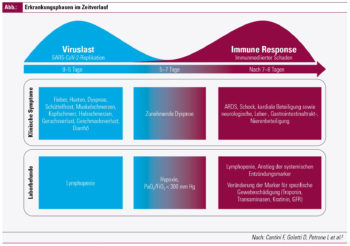
Man geht davon aus, dass die Viruslast im Zeitraum von 1 bis 2 Tagen vor dem Symptombeginn bis zu 5 Tage nach Ausbruch der Symptome am höchsten ist. Das ist somit auch die Phase, in der jemand infektiös bzw. für Dritte ansteckend ist. Wir sprechen hier von Personen, bei denen von einem halbwegs normalen Immunsystem auszugehen ist – auch da wird es individuelle Unterschiede geben, die noch nicht so gut untersucht sind und die dazu führen, dass das Virus mitunter auch länger ausgeschieden werden kann. Alter, Immunsuppression und Komorbiditäten werden hier eine Rolle spielen.
Ja, davon lässt sich aufgrund der 2 Phasen der Erkrankung in den meisten Fällen ausgehen. In der 1. Phase steht wie bei allen Virusinfektionen die gegen das Virus gerichtete Immunaktivierung im Vordergrund. Deren Ziel ist es, das Virus zu eliminieren. Hier spielen vor allem Interferone eine entscheidende Rolle. Wenn das gut gelingt, ist die Infektion mitunter ausgestanden. Diese 1. Phase, in der die Elimination des Virus im Vordergrund steht, dauert vielleicht eine Woche nach Symptomenbeginn.
Kommt es nach 7 bis 10 Tagen zu einer Verschlechterung der Lungenfunktion, dann scheint in den meisten Fällen eine Hyperinflammation im Vordergrund zu stehen. Und diese ist weniger durch das Virus, sondern vor allem durch die Immunantwort getriggert. Möglicherweise gibt es auch genetische Prädispositionen und hormonelle Einflüsse, vielleicht spielt auch die Komedikation eine Rolle. In den meisten Fällen ist es also diese Hyperinflammation, die sich mit ARDS– dem akuten respiratorischen Versagen – mit Dyspnoe, Atemnot und schlechter Sauerstoffsättigung bemerkbar macht und die zur stationären Aufnahme führt. In dieser Phase, in der eigentlich das Virus nicht mehr im Vordergrund steht, sind die Patienten vermutlich auch nur mehr gering infektiös.
Von den hospitalisierten Patienten, das sind also jene mit Hyperinflammation, benötigen 20 bis zu 40 % irgendwann Atemunterstützung.
Das kann man so nicht sagen. Manchmal schafft man mit dem „high-flow“ keine Verbesserung – vor allem in der initialen Phase. Die Betroffenen brauchen dann sehr rasch eine nichtinvasive Beatmung mit CPAP oder BIPAP oder sogar eine invasive Beatmung. Mit dem „high-flow“ versucht man das ein bisschen zu bridgen. Den Einsatz von High-Flow-Sauerstoff sehe ich eher in der Situation, wenn Patienten von der ICU wieder auf die Normalstation zurückkommen.
Leider nein. Es würde uns jedoch sehr helfen, wenn auch auf Normal-Spezial- oder Normal-Infekt-Stationen die Möglichkeit der nichtinvasiven Beatmung mit CPAP bestünde. Davon profitieren die Betroffenen wirklich, und dadurch könnte man auch Intensivressourcen sehr effektiv einsparen. Ferner wäre es eine verbesserte Behandlungsoption v. a. für Patienten, die nicht auf die ICU aufgenommen werden können.
Das ist leider eine Frage der Kategorisierung der Betten entsprechend dem Strukturplan. Dieser legt fest, wie viele Intensivbetten es in jeder Region geben darf. Jedes Bett mit nichtinvasiver Beatmung auf einer Normalstation würde als Intensivbett zählen und somit dem Strukturplan Gesundheit nicht mehr entsprechen.
Nein, eigentlich nicht, das ist ein österreichweites Thema.
Die schlechte Nachricht zuerst: Es gibt bis jetzt kein spezifisch für COVID zugelassenes Medikament. Zu betonen sind zunächst symptomatische Therapieansätze, um die Lungenfunktion zu verbessern – sei es mit pharmakologischen oder nichtpharmakologischen Maßnahmen, dazu zählen die inhalative Therapie, High-Flow-Sauerstoff und nichtinvasive Beatmungsverfahren. Weiters gilt es, Grunderkrankungen oder deren Exazerbationen optimiert zu behandeln. Bei schweren Erkrankungsverläufen muss eine Antikoagulation erfolgen, und im weiteren Verlauf müssen Super-infektionen, v. a. bakterielle, rechtzeitig erkannt und möglichst gezielt behandelt werden.
In der Frage der spezifischen Therapie ist zwischen den Erkrankungsphasen zu unterscheiden. Während der Frühphase, in der die Auseinandersetzung mit dem Virus im Vordergrund steht, ergibt eine antivirale Therapie eher Sinn, während in der Spätphase, in der es um die Hyperinflammation geht, eine Therapie, die diese überschießende Immunantwort eindämmt, angezeigt ist.
In der früheren Phase kommen antivirale Medikamente zum Einsatz, die teilweise in an
derer Indikation schon zugelassen sind. Eine bedingte Zulassung bei COVID-19 hat nur Remdesivir. Dieses zählt wie Favipiravir, das derzeit im Rahmen von Studien untersucht wird, zu den RNA-Polymerase-Inhibitoren. Einzelne Studien zu Remdesivir zeigten, dass damit möglichweise der Krankenhausaufenthalt verkürzt werden kann, wenngleich kein signifikanter Benefit im Überleben gezeigt werden konnte.
Ich denke, dass der Zeitpunkt, zu dem eine antivirale Behandlung erfolgt, entscheidend ist. Für Remdesivir oder Favipiravir wird wahrscheinlich nur dann ein Effekt gegeben sein, wenn sie sehr früh im Krankheitsverlauf eingesetzt werden, solange das Virus noch eine Rolle spielt. Bei einem Einsatz im späteren Krankheitsverlauf ist wahrscheinlich kein Benefit zu erzielen, weil das Virus nur mehr eine untergeordnete Rolle spielt.
APN01 ist eine interessante Substanz, die als rekombinantes ACE-2 über die Blockade des Spikeproteinrezeptors das Andocken des Virus an die Zelle blockiert, darüber hinaus aber auch gewisse antiinflammatorische Effekte zu haben scheint. APN01 wird im Rahmen von klinischen Studien untersucht, an denen auch wir teilgenommen haben. Die Rekrutierung ist seit Jänner abgeschlossen, hier sollten bald Ergebnisse zu erwarten sein.
Weiters untersucht wurden Lopinavir/Ritonavir aus der HIV-Medizin, bislang konnte in Studien jedoch kein Benefit gezeigt werden. Camostat, das die Virusaufnahme in die Zelle verhindert, wird derzeit ebenfalls im Rahmen von klinischen Studien untersucht. Weiters gibt es den Fusionsinhibitor Umifenovir (Arbidol), ein russisches Medikament, das die Fusion des Virus mit der Zelle verhindern soll und in Russland seit den 1970er-Jahren in der Influenzabehandlung zum Einsatz kommt. Wenn man ein antivirales Medikament gibt, sollte man es meiner Meinung nach früh im Krankheitsverlauf geben. Bei uns erhalten Patienten maximal bis zum 10. Tag nach Symptomenbeginn ein antivirales Medikament.
Die Therapien werden in Österreich im Rahmen des ACOVACT1-Trial untersucht, einer großen klinischen Studie mit mehreren Therapiearmen.
Auch Rekonvaleszentenplasmen werden ebenso wie Antikörper als mögliche antivirale Behandlung untersucht. Bis jetzt gibt es keine klare Empfehlung und auch noch wenig Evidenz. Auch hier gilt vermutlich: wenn es etwas bringt, dann eher früher im Erkrankungsverlauf beziehungsweise bei Patienten mit Antikörpermangel wie hämatoonkologischen Patienten mit Lymphom oder unter immunsuppressiver Therapie.
Genau, diese Studien zeigten jedoch keinen durchschlagenden Erfolg. Jetzt wird bei Patienten mit hohem Risiko für schweren Verlauf im niedergelassenen Bereich evaluiert, ob damit das Hospitalisierungsrisiko gesenkt werden kann. Es ist jedoch eine sehr teure Therapie, deren Wirksamkeit aus meiner Sicht noch nicht geklärt ist.
In der 2. Phase, in der es um die Hyperinflammation geht, muss die individuelle Situation laufend evaluiert werden: Wie eingeschränkt ist der Patient, wie geht es ihm mit der Atmung, ist die Oxygenierung bereits beeinträchtigt, braucht er High-Flow-Sauerstoff etc. In dieser Phase werden häufig Glukokortikoide gegeben, beispielsweise Dexamethason. Zu beachten ist, dass der Benefit für Dexamethason bei sauerstoffpflichtig Patienten oder jenen, die aufgrund einer Verschlechterung auf die ICU kommen, am größten ist. Patienten, die keinen Sauerstoff brauchen, profitieren davon nicht.Generell sollte man am Beginn der Infektion mit einer Kortisontherapie zurückhaltend sein, um damit nicht die antivirale Immunantwort abzuschießen. Wir geben es eigentlich nie vor dem 7. Tag nach Symptomenbeginn, eher erst nach dem 10. Tag.
Tocilizumab wurde am Anfang sehr propagiert. Wir haben es nicht eingesetzt, weil ich anfangs skeptisch war, ein Medikament, das so lange nachwirkt, bei einer Erkrankung– die akut ist und über die wir noch wenig wissen – zu geben, weil man sich ja damit auch gewisse Arme des Immunsystems abschießt, die eine Rolle bei der Infektionsabwehr haben. Mittlerweile liegt eine Reihe von randomisierten, kontrollierten Studien mit teilweise sehr unterschiedlichen Ergebnissen vor. Es kann in Einzelfällen angezeigt sein.
Auch hierzu gibt es mittlerweile einige publizierte Studien mit keinen klaren Ergebnissen im Hinblick auf eine Empfehlung für diese Medikamentengruppe.
Derzeit laufen in der späteren Erkrankungsphase auch mehrere Studien zum Einsatz von TNF-Blockern sowie anderen Zytokininhibitoren. Hoffnungen richten sich derzeit auch auf die Januskinaseinhibitoren.
Zu Baricitinib gibt es bereits Studien, die einen Benefit gezeigt haben. So konnte in einer NIH-gesponserten Studie mit der Kombination von Baricitinib mit Remdesivir ein besseres Recovery und eine kürzere Hospitalisierungsdauer gezeigt werden als mit Remdesivir allein. Die endgültigen Daten sollten in Kürze publiziert werden. Einen Vorteil zeigt auch eine kleine retrospektive Studie mit Lopinavir und Baricitinib, die bereits publiziert ist. Baricitinib dürfte also im späteren Verlauf durchaus einen Benefit haben, allerdings muss hier auf andere Virusinfektionen, wie Herpes- und Zosterinfektionen, geachtet werden. Auch diese Substanz sollte daher gezielt eingesetzt werden.
Für entscheidend halte ich die Abstimmung der Behandlung auf den Krankheitszeitpunkt, die klinische Präsentation und bestehende spezifische Patientenfaktoren, denn die Behandlung ist immer eine individuelle Entscheidung. Es gibt viele Faktoren, die eine Rolle spielen. Und so, wie wir es in der Infektiologie und auch in der Rheumatologie kennen, gilt: Man muss sich mit dem Patienten befassen und ihn sehen. Fast jeder braucht ein individuelles Management, basierend auf der spezifischen Krankheitspräsentation und auf den Vorerkrankungen.
Die Zukunft liegt in den besprochenen „small molecules“ oder auch möglicherweise bei einzelnen Biologika, entscheidend ist das richtige Timing und die Identifizierung jener Patienten, die davon auch potenziell profitieren. Manche Biologika, die am Anfang sehr gehypt wurden, sind heute schon wieder Vergangenheit. Aber die Entwicklung ist im Fluss, es gibt jeden Tag neue Überraschungen.
Vielen Dank für das Gespräch!
- Austrian CoronaVirus Adaptive Clinical Trial. https://clinicaltrials.gov/ct2/show/NCT04351724
- Cantini F, Goletti D, Petrone L et al., Immune Therapy, or Antiviral Therapy, or Both for COVID-19: A Systematic Review. Drugs 2020; 80: 1929–1946; doi: 10.1007/s40265-020-01421-w