Impfungen und Basistherapie: Was muss sein, was darf nicht sein?
Das Konzept der Impfung – präzise gesagt, der aktiven Immunisierung – zählt zu den großen Erfolgsgeschichten der Medizin: durch flächendeckende Programme ist es gelungen, die Pocken in den 70er-Jahren des 20. Jahrhunderts auszurotten, in den nächsten Jahren könnte es gelingen, auch die Poliomyelitis endgültig in den Bereich der Medizingeschichte zu verweisen. Voraussetzung für diese Erfolge war und ist eine konsequente Immunisierung eines möglichst großen Teiles der Bevölkerung („Herdenimmunität“, die auch bis zu einem gewissen Grad Nichtgeimpfte schützt). Laut Empfehlung der Weltgesundheitsorganisation (WHO) soll jeder Arztkontakt dazu genutzt werden, zu prüfen, ob die empfohlenen Impfungen durchgeführt worden sind und fehlende Impfungen nachzuholen. Dies gilt insbesondere für PatientInnen unter Basistherapeutika.
Warum RheumapatientInnen impfen?
Personen mit chronischen entzündlich-rheumatischen Erkrankungen (autoimmun-inflammatorisch entzündlich-rheumatischen Krankheiten, AIIRK) haben ein erhöhtes Infektionsrisiko1, 2. Multiple Faktoren tragen dazu bei: vor allem Komorbiditäten wie chronische Herz-/Nieren-/Leber- oder Lungenerkrankungen, Alkoholismus, organische Hirnerkrankungen, Diabetes mellitus und die Einnahme von Glukokortikoiden erhöhen die Wahrscheinlichkeit einer klinisch relevanten Infektion deutlich3. Durch den immer häufiger werdenden Einsatz von profund immunsuppressiv wirkenden Medikamenten wie z. B. Biologika wird das Infektrisiko zumindest zu Beginn der Therapie weiter angehoben4, 5. Vor allem für diese PatientInnen sind Impfungen eine wesentliche präventive Maßnahme. Andererseits kann unter Immunsuppression die Effektivität von Impfungen vermindert sein und es besteht zumindest das theoretische Risiko eines durch die Impfung ausgelösten Krankheitsschubes, das allerdings sehr gering sein dürfte6. Die Europäische Rheumaliga (EULAR) hat 2011 Empfehlungen zu Impfungen bei Personen mit AIIRK formuliert, die im Folgenden referiert werden7. In Österreich gibt das Nationale Impfgremium jährlich aktualisierte und auf die epidemiologische Situation in Österreich abgestimmte Empfehlungen heraus8. Ebenso wurde für Österreich im April 2010 unter Vorsitz von Burgmann und Wenisch ein Expertenstatement „Impfungen bei Immunschwäche & Immunsuppression“ publiziert (Supplementum der Österreichischen Ärztezeitung). Gerade die regelmäßigen Kontrollen, die für Rheumakranke unter Basistherapie notwendig sind, geben Gelegenheit für die von der WHO empfohlenen Impfstatusüberprüfungen (s. o.).
Wann impfen?
Insbesondere zu Beginn der diagnostischen Aufarbeitung sollte in Übereinstimmung mit den WHO-Empfehlungen der Impfstatus bei allen PatientInnen mit AIIRK überprüft und Aktualisierungen empfohlen werden. Die EULAR empfiehlt, „stabile Krankheitsperioden“ für Impfungen zu nützen. Dies wird wohl nicht immer machbar sein. Insbesondere vor einem Wechsel zu „intensiverer“ Immunsuppression (z. B. Addition eines Biologikums zu bestehender und nicht ausreichender Basistherapie) sollte den PatientInnen die Aktualisierung des Impfstatus empfohlen und diese auch durchgeführt werden.
Welche Impfungen können gefährlich sein?
Von „Lebendimpfungen“ (Mumps, Masern, Röteln [MMR], Varicella zoster [VZV], Polio oral, Typhus oral, Gelbfieber, Rota) wird im Allgemeinen abgeraten. Allerdings ist nicht bekannt, welcher „Grad“ der Immunsuppression (z. B. welche Methotrexat- Dosis, wenn überhaupt) eine erhöhte Gefährdung darstellt, an einer durch die Lebendvirusimpfung ausgelösten Infektion zu erkranken. So sind z. B. bei knochenmarktransplantierten oder HIV-infizierten Kindern MMR bzw. VZV ohne nachfolgende Infektion geimpft worden. Bei erwachsenen RheumapatientInnen besteht ein erhöhtes Herpes-zoster-Risiko, Studien der VZV-Impfung bei systemischem Lupus erythematosus (http://clinicaltrials.gov/show/NCT01474720), chronischer Polyarthritis (http://clinicaltrials.gov/show/NCT015066 61) und Glukokortikoidtherapie (http://clinicaltrials.gov/show/ NCT00546819) sind daher im Laufen und sollten wertvolle Informationen betreffend Sicherheit liefern. Für einige andere Lebendimpfungen gibt es als Alternative Totimpfstoffe (Typhus und Polio). Von der Gelbfieber- (Reiseimpfung) und der Rotavirusimpfung (lediglich bis zum 2. Lebensjahr empfohlen) wird trotz fehlender konklusiver Daten über Nebenwirkungen bei Immunsupprimierten abgeraten.
Welche Impfungen sind empfehlenswert?
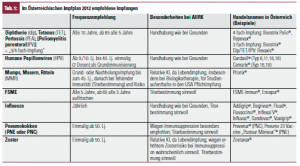
Der erwähnte EULAR-Konsens empfiehlt für erwachsene RheumatikerInnen folgende Impfungen, die auch im österreichischen Impfplan enthalten sind (Tab. 1): Influenza (jährliche Auffrischung/Neuimpfung), 23-valentes Pneumokokkenpolysaccharid (23-PPV, PNE, einmalig), Tetanustoxoid (alle 10-Jahre). Hepatitis A und/oder B werden nur bei erhöhtem Infektrisiko (Gesundheits-/Sicherheitspersonal, häufige Transfusionen, Dialyse etc.) empfohlen. Bei Hypo-/Asplenie sollte gegen Influenza, Pneumokokken, Haemophilus influenzae B und Meningokokken geimpft werden.
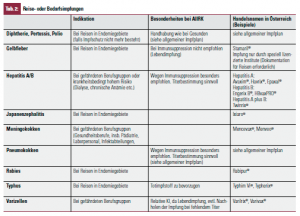
Der konjugierte Pneumokokkenimpfstoff (PNC, stärkere Immunogenität bei Kindern) wird im österreichischen Impfplan 2012 auch für Erwachsene ab 50 Jahren empfohlen. Dies stellt eine Veränderung gegenüber den bisherigen Empfehlungen dar, die eine Immunisierung mit unkonjugiertem Impfstoff (PNE) ab 65 enthielten. Auch eine Pertussisauffrischung (in Form der „3-fach-Impfung“ mit Diphtherie und Tetanus oder „4-fach- Impfung“ mit Diphtherie, Tetanus und Poliomyelitis) sollte alle 10 Jahre, ab 65 alle 5 Jahre erfolgen. Reise- bzw. Bedarfsimpfungen sind Immunisierungen, die für bestimmte Weltregionen oder bestimmte Berufs- oder Risikogruppen empfohlen werden: Diphtherie, Hepatitis A/B, MMR für Studienaufenthalte in den USA, Meningokokken, Pneumokokken, Polio, Pertussis, Japanencephalitis, Rabies, Typhus und Varizellen sowie Gelbfieber (Tab. 2). Für Personen mit AIIRK gelten die gleichen Empfehlungen wie für die Normalbevölkerung. FSME ist insbesondere in Österreich endemisch, daher sollte ebenfalls ein Impfschutz bei AIIRK angestrebt werden (Tab. 1). Die Impfung gegen humane Papillomviren (HPV) ist im österreichischen Impfplan ab dem 9./10. Lebensjahr bis zum 40. Lebensjahr enthalten und sollte dementsprechend auch bei AIIRK in der entsprechenden Altersgruppe empfohlen werden.
Was ist zu beachten?
Unter DmARD. Da naturgemäß die Mehrzahl der PatientInnen mit AIIRK unter Basistherapeutika (DMARD) steht, könnte die Impfantwort (humoral oder zellulär) vermindert sein, dies gilt vor allem für einzelne Impfpräparationen (Influenza, Pneumokokken) unter Methotrexat9, 10. Das österreichische nationale Impfgremium schließt sich daher der Empfehlung des deutschen Robert-Koch-Instituts an: In diesen wird bei „Personen mit Immundefekten“ empfohlen, wegen des möglichen unzureichenden Impferfolgs diesen zu kontrollieren11.
Unter B-Zell-depletierender-Therapie.
Eine spezielle Situation stellt die Therapie mit B-Zell-depletierenden Substanzen (Rituximab, andere in klinischen Studien befindliche Entwicklungen) dar. Mehrere Studien haben sowohl bei RheumatikerInnen als auch bei LymphompatientInnen unter Rituximab verminderte humorale Immunantwort gegenüber Impfungen dokumentiert12, 13. Es wird daher von der EULAR empfohlen, Impfungen wenn möglich vor Beginn einer B-Zell-depletierenden Therapie abzuschließen.
Tuberkulose.
Das erhöhte Tuberkulose- bzw. Tuberkulosereaktivierungsrisiko durch TNF-Blockade hat dazu geführt, die BCG-Impfung (seit 1998 nicht mehr erhältlich) neu zu überdenken. Da die protektive Immunantwort auf BCG unsicher ist und unangenehme Impfreaktionen („BCGitis“, insbesondere bei Immunsupprimierten) auftreten können, wird diese Impfung weiterhin nicht empfohlen. Hier muss man wohl neue Entwicklungen (mehrere TB-Vakzinen sind derzeit in klinischen Studien) abwarten.
Resümee
Zusammenfassend sind Impfungen für RheumapatientInnen wegen des erhöhten Infektrisikos noch sinnvoller und nötiger als für „Gesunde“. Auch die Sicherheit der aktiven Immunisierung steht heute, auch wenn gelegentlich Berichte/Gerüchte über Folgeschäden auftauchen (wie jüngst in Bezug auf eine bestimmte H1N1-Impfung oder die mittlerweile falsifizierte Autismusgeschichte14, 15 außer Zweifel. ÄrztInnen und PatientInnen sollten die während der Basistherapie zwangsläufig häufigen Kontakte auch zur Aktualisierung des Impfstatus nützen.
1) Falagas ME, Manta KG, Betsi GI, Pappas G, Infection-related morbidity and mortality in patients with connective tissue diseases: a systematic review. Clin Rheumatol 2007; 26(5):663–70.
2) Doran MF, Crowson CS, Pond GR, O‘Fallon WM, Gabriel SE., Frequency of infection in patients with rheumatoid arthritis compared with controls: a populationbased study. Arthritis Rheum 2002; 46(9):2287–93.
3) Doran MF, Crowson CS, Pond GR, O‘Fallon WM, Gabriel SE., Predictors of infection in rheumatoid arthritis. Arthritis Rheum 2002; 46(9):2294–300.
4) Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Feltelius N et al., Time-dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists. Ann Rheum Dis 2007; 66(10):1339–44.
5) Bernatsky S, Hudson M, Suissa S., Anti-rheumatic drug use and risk of serious infections in rheumatoid arthritis. Rheumatology (Oxford) 2007; 46(7):1157–60.
6) Avery RK. Vaccination of the immunosuppressed adult patient with rheumatologic disease, Rheum Dis Clin North Am 1999; 25(3):567–84, viii.
7) van Assen S, Agmon-Levin N, Elkayam O, Cervera R, Doran MF, Dougados M et al., EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2011; 70(3):414–22.
8) http://bmg.gv.at/cms/home/attachments/3/3/6/CH1100/CMS1327680589121/ impfplan_2012_final,_1.2.2012.pdf. 2012.
9) Ribeiro AC, Guedes LK, Moraes JC, Saad CG, Aikawa NE, Calich AL et al., Reduced seroprotection after pandemic H1N1 influenza adjuvant-free vaccination in patients with rheumatoid arthritis: implications for clinical practice. Ann Rheum Dis 2011; 70(12):2144–7.
10) Kapetanovic MC, Roseman C, Jonsson G, Truedsson L, Saxne T, Geborek P, Antibody response is reduced following vaccination with 7-valent conjugate pneumococcal vaccine in adult methotrexate-treated patients with established arthritis, but not those treated with tumor necrosis factor inhibitors. Arthritis Rheum 2011; 63(12):3723–32.
11) (http://www.rki.de/cln_091/nn_196438/DE/Content/Infekt/EpidBull/ Archiv/ 2005/Sonderausgaben/Sonderdruck__STlKO-Hinweise__Nov-2005,tem plateId=raw,property=publicationFile.pdf/Sonderdruck_STlKO-Hinweise_Nov- 2005.pdf). 12) Yri OE, Torfoss D, Hungnes O, Tierens A, Waalen K, Nordøy T et al., Rituximab blocks protective serologic response to influenza A (H1N1) 2009 vaccination in lymphoma patients during or within 6 months after treatment. Blood 2011; 118(26):6769–71.
13) Arad U, Tzadok S, Amir S, Mandelboim M, Mendelson E, Wigler I et al., The cellular immune response to influenza vaccination is preserved in rheumatoid arthritis patients treated with rituximab. Vaccine 2011; 29(8):1643–8.
14) Wakefield AJ, Murch SH, Anthony A, Linnell J, Casson DM, Malik M et al., Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. Lancet 1998; 351(9103):637–41.
15) Retraction–Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. Lancet 2010; 375:445.