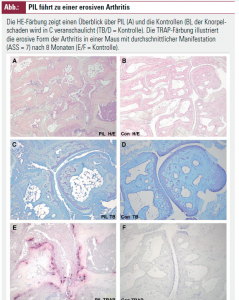
Pristaninduzierter Lupus bei Mäusen: Ein Modell für Lupusarthritis
Der systemische Lupus erythematodes (SLE) ist eine entzündliche, systemische Autoimmunerkrankung, die mit Hautbeteiligung, Arthritis, Myositis und mit einem lebensbedrohenden Befall innerer Organe einhergehen kann (Niere, Lunge, ZNS, Herz, Gastrointestinaltrakt etc.). Die klinisch manifeste Erkrankung „SLE“ resultiert aus einem Zusammentreffen von genetischen Anlagen, immunregulatorischen Defekten, hormonellen Faktoren und bisher nur unzureichend charakterisierten exogenen Faktoren.
Feldstudien legen nahe, dass auch Mineralöle bzw. deren Bestandteile zu diesen exogenen Faktoren zählen können. So kann das Isoprenoid-Alkan Pristan (2,6,10,14-Tetramethylpentadecan), das Bestandteil von Mineralölen ist, in Mäusen Lupus hervorrufen, sowohl hinsichtlich typischer Autoantikörper als auch der Organbeteiligung. In älteren Publikationen wurde gezeigt, dass Pristan auch eine Arthritis hervorrufen kann.
Die Pathogenese des SLE ist noch nicht geklärt. CD4+-Teffector– Zellen (TH1, TH2, TH17) spielen eine wichtige Rolle, wobei nach neueren Ergebnissen v. a. IFNγ-produzierende TH1 und IL-17-produzierende TH17-Zellen involviert sind. Autoreaktive CD4+-Teffector -Zellen gegen nukleäre Antigene (Ag; wie das Histon H1) sind im peripheren Blut von SLE-Patienten nachweisbar und können B-Zellen zur Proliferation von Auto-Ak stimulieren. Doch auch eine unzureichende periphere Toleranz durch funktionseingeschränkte CD4+-Treg begünstigt den Autoimmunprozess.
Pristaninduzierter Lupus
Das Mineralöl Pristan wird dafür verantwortlich gemacht, beim Menschen Autoimmunphänomene und bei Mäusen eine lupusähnliche Erkrankung auszulösen. Der murine PIL ähnelt dem menschlichen SLE in vielen Aspekten, wie zum Beispiel der Präsenz von Anti-Chromatin-Antikörpern und der Mitbeteiligung innerer Organe. Im humanen SLE ist die Arthralgie ein häufiges Symptom, das oft von einer Arthritis (in 35 % bis 95 % der Patienten) begleitet wird.
Methoden
Zur Krankheitsinduktion wurde BALB/c-Mäusen intraperitoneal entweder 0,5 ml Pristan (PIL-Gruppe) oder 0,5 ml PBS (Kontrollen) injiziert. Nach 8 Monaten wurden die Mäuse analysiert. Die Tiere wurden bezüglich des Auftretens SLE-typischer Auto- Antikörper im Serum und klinischer Symptome der Arthritis (Pfotenschwellung, Griffstärke) untersucht, und die klinisch am stärksten betroffene Pfote jeder Maus wurde mittels der folgenden histopathologischen Techniken analysiert: Färbungen mit HE (Überblick), TRAP (Osteoklasten) und Toluidinblau (Knorpel) sowie Antikörperfärbungen gegen B-Zellen (CD45R), T-Zellen (CD3), Monozyten (F4/80) und neutrophile Granulozyten (G1). Danach wurde die Pfote durch die Verwendung eines speziellen Computerprogramms zur Quantifizierung knochenhistomorphometrischer Parameter (OsteoMeasureTM) vermessen; die daraus entstehenden Resultate wurden verwendet, um einen „Arthritis severity score (ASS)“ zu definieren. Weiters erfolgte eine quantitative Analyse des inflammatorischen zellulären Infiltrats mittels HistoQuest®.
Ergebnisse
Nach 3 Monaten entwickelten die Mäuse erste Zeichen einer – im Verlauf zunehmenden – klinischen Arthritis; schlussendlich zeigten 79 % der PIL-Mäuse im Gegensatz zu den Kontrollen mindestens einmalig Zeichen klinischer Arthritis; die Klinik korrelierte gut mit den histologischen Ergebnissen (Fläche des entzündlichen Infiltrats, Fläche der Erosion, Knorpelschaden, Anzahl der Osteoklasten und ASS; Abb.).
Die PIL-Gruppe zeigte histologisch in 58 % Zeichen einer erosiven Arthritis, das zelluläre Pannusgewebe setzte sich abgesehen von Fibroblasten hauptsächlich aus Granulozyten (17,7 %), in niedrigerer Anzahl aus Makrophagen (1,9 %), T-Zellen (1,7 %) und B-Zellen (0,3 %) zusammen.
Zwar nahm der Prozentsatz der betroffenen Mäuse im Zeitverlauf kontinuierlich zu (50 % nach 6 Monaten, 58 % nach 8 Monaten, 75 % nach 12 Monaten), jedoch kam es zu keinem Fortschreiten der Gelenkzerstörung oder Ankylose, der mittlere ASS zeigte im Verlauf keine Progression.
Dem erstmaligen Auftreten der Arthritis vorausgehend entwickelten die Mäuse Anti-Chromatin- und Anti-Histon-Antikörper (Rheumafaktor war nach 8 Monaten in beiden Gruppen erhöht).
Resümee
Die genaue Erforschung der Pathogenese des SLE ist klinisch von größter Bedeutung: sie könnte Aufschluss bringen, warum die meisten der bisher verwendeten Biologika nicht den gleichen Erfolg gehabt haben wie bei anderen Autoimmunerkrankungen (chronische Polyarthritis, Psoriasisarthritis etc.), und neue Therapiemöglichkeiten aufzeigen. Der pristaninduzierte Lupus ist ein geeignetes Modell, den humanen SLE, insbesondere die Lupusarthritis, widerzuspiegeln und somit ein brauchbares Mittel, die Pathogenese und den Verlauf dieser komplexen Erkrankung zu erforschen, sei es an Hand von weiteren