Prophylaxe des rheumatischen Fiebers: Aktuelle Richtlinien der AHA
Etwa 3 % der Weltbevölkerung haben eine genetische Prädisposition für das akute rheumatische Fieber (ARF). Bei Kontakten des Immunsystems mit M-Proteinen an der Oberfläche der β-hämolysierenden Streptokokken der Gruppe A (GAS) werden Antikörper gegen diese M-Proteine gebildet. Bei der aktuellen Hypothese zur Pathogenese der Erkrankung kreuzreagieren diese Antikörper mit myokardialen und anderen körpereigenen Proteinen und lösen eine inflammatorische Multisystemerkrankung aus. Bei jedem neuerlichen Kontakt des Immunsystems mit Streptokokken können Rezidive der Erkrankung ausgelöst werden, die letztlich unbehandelt als eine chronische rheumatische Erkrankung mit progredienter Rheumatic Heart Disease imponiert.
Diagnosekriterien
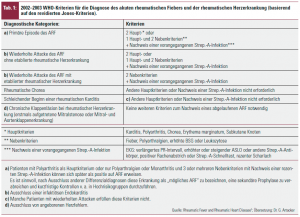
Seit der Definition der Jones-Kriterien für die Diagnose des ARF 1945 kam es zu insgesamt 5 Revisionen durch die AHA und die WHO, zuletzt 1992 und 2003 (Tab. 1):
1. Neu aufgenommen ist der Begriff des „probable ARF“: Die Diagnose eines Patienten mit Polyarthritis und mehrerer Nebenkriterien bedarf besonders kritischer Beobachtung, weil diese Kriterien durch eine Reihe anderer systemischer entzündlicher Erkrankungen erfüllt werden können.
2. Eine Monarthritis kann Teilsymptom eines ARF sein, eine migratorische Polyarthritis ist für die Diagnose ARF nicht unbedingt erforderlich.
3. Ein (ewiger) Diskussionspunkt ist die Validität der Echokardiografie: Die Jones-Kriterien bauen seit 1945 auf auskultatorischen Veränderungen der Herztöne auf. In den aktuellen Empfehlungen der AHA (2009) und WHO sind echokardiografische Veränderungen der Herzklappen weiterhin nicht in die Jones-Kriterien aufgenommen, weil die Echokardiografie weltweit v. a. in Hochrisikogebieten nicht in ausreichendem Maße verfügbar ist. Ein weiterer Kritikpunkt ist, dass nach echokardiografischen Kriterien bis zu 30 % einer lokalen Bevölkerung (Kambodscha, Mozambique) Residuen nach ARF aufweisen können. Echokardiografische Veränderungen sollen streng nach Kriterien klassifiziert werden (Tab. 2).
Therapie des floriden ARF
Die Therapie des floriden ARF ist seit 100 Jahren nahezu unverändert geblieben:
ASS: Neben Bettruhe ist Mittel der Wahl Acetylsalicylsäure (ASS) – bei Kindern 100–125 mg/kg/d, bei Erwachsenen 6–8g/d – die erst nach Sicherung der Diagnose (migratorische Polyarthritis) verabreicht werden soll.
Steroide haben gegenüber Salicylaten keine Vorteile bei Entwicklung einer späteren Rheumatic Heart Disease. Hochdosis-Prednisolon oder i. v. Methylprednisolon-Pulse sollen Patienten vorbehalten werden, die auf ASS nicht ansprechen und ein progredientes Herzversagen erleiden.
Penicillin: Der Durchbruch der Therapie von suppurativen Streptokokkenerkrankungen und der Vermeidung des ARF erfolgte mit der Penicillintherapie und der Entwicklung der Penicillinprophylaxe nach dem 2. Weltkrieg.
Impfung: Eine weitere Verbesserung kann eine in Entwicklung befindliche 26-valente M-Protein-basierte Impfung bringen, die bis zu 85 % der bakteriellen Isolate bei Streptokokkenpharyngitis in den Industriestaaten abdecken kann.
Prävention von ARF
Die WHO und AHA unterteilen die Prophylaxe des ARF in eine primäre und sekundäre Prävention:
Primäre Prävention
Die primäre Prävention des rheumatischen Fiebers ist die adäquate Diagnose und Therapie einer pharyngealen Infektion mit GAS:
Bei Epidemien vor der Penicillinära kam es bei 3 % der unbehandelten Patienten mit akuter GAS-Pharyngitis zu einem ARF. Eine adäquate antibiotische Therapie kann in den meisten Fällen ein ARF verhindern.
Die Symptome einer GAS-Pharyngitis wie Halsschmerzen, Schluckschmerzen, Fieber, Kopf- und Bauchschmerzen, Übelkeit und Erbrechen sind allerdings unspezifisch. Auch tonsillopharyngeale Erytheme mit oder ohne Exsudate, Petechien am weichen Gaumen, Uvulaödem oder scarlatiniforme Exantheme sind nicht beweisend für eine Infektion mit GAS. Ein Drittel der Episoden von ARF treten nach inapparenten pharyngealen Streptokokkeninfektionen auf.
Sicherung der Diagnose
Deshalb soll die Sicherung der Diagnose mit einem Streptokokkenschnelltest (Rapid Antigen Detection Test, RADT) durchgeführt werden. RADT haben eine hohe Spezifität, jedoch eine unakzeptabel niedrige Sensitivität. Bei einem negativen RADT soll daher ein Rachenabstrich durchgeführt werden. Patienten mit Pharyngitis mit positivem RADT oder Rachenabstrich sollen antibiotisch behandelt werden.
Für die Vermeidung eines ARF genügt ein Therapiebeginn bis 9 Tage nach Beginn der akuten Erkrankung.
Dieses diagnostische Vorgehen kann bei einer Mehrheit der Patienten mit Halsschmerzen eine antibiotische Therapie vermeiden. Bei Patienten mit fehlender Compliance und inapparenter pharyngealer GAS-Infektion ist eine primäre Prophylaxe eines ARF nicht möglich.
Streptokokkenantikörper wie ASLO und ADNAse B reflektieren vergangene und nicht aktuelle immunologische Ereignisse. Da sie ihr Maximum etwa 3–8 Wochen nach Beginn der Infektion erreichen, sind sie zur Diagnose einer aktuellen Infektion nicht sinnvoll. Bei GAS-Folgeerkrankungen können steigende oder (stark) erhöhte Antikörpertiter Hinweise für eine rezente GAS-Infektion geben. Auch nach einer unkomplizierten GAS-Infektion können hohe Titer ohne Hinweise für neuerliche oder persistierende Infektionen für Monate oder Jahre bestehen bleiben. Tabellen für Normalwerte für ASLO und ADNAse B sind wenig hilfreich, da sie für die Beurteilung der individuellen immunologischen Antwort zu wenig Aussage bieten.
Therapie einer GAS-Pharyngitis:
Keine Therapie kann bei 100 % der Patienten eine Eradikation erreichen, obwohl unverändert 100 % der GAS in vitro auf Penicillin empfindlich sind. Benzathin-Penicillin G intramuskulär oder Penicillin V oral für 10 Tage sind Mittel der ersten Wahl. Alternativen sind Amoxicillin, Cefalexin oder Cefadroxil, Clarithromycin oder Clindamycin für 10 Tage bzw. Azithromycin für 5 Tage.
24 h nach Therapiebeginn ist der Patient als nicht mehr infektiös anzusehen. Kontrollen der Rachenabstriche 2–7 Tage nach Therapieende sind nur bei Persistieren oder Wiederauftreten der Symptome oder nach ARF indiziert. Therapieversagen tritt häufiger nach oraler als nach intramuskulärer Therapie auf.
GAS-Träger („Carrier“) haben positive Rachenabstriche, aber keine klinischen Symptome bzw. keinen Anstieg der Antikörpertiter. Sie müssen üblicherweise nicht gesucht oder behandelt werden. Sie haben wenig Risiko für die Entwicklung eines ARF und keine Bedeutung für die Ausbreitung von GAS-Infektionen. Daher wird ein routinemäßiger Rachenabstrich bei Kontaktpersonen eines Patienten mit GAS-Pharyngitis nicht empfohlen, mit der Ausnahme bei Verwandten eines Patienten mit aktuellem ARF. Streptokokken der Gruppen C und G werden nicht als Risikofaktor für ein ARF angesehen.
Sekundäre Prävention
Die sekundäre Prävention ist die Vermeidung von weiteren Streptokokkeninfektionen nach einem ARF:
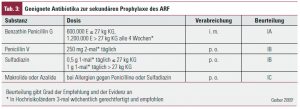
Die Verhinderung von weiteren GAS-Infektionen durch eine kontinuierliche antimikrobielle Prophylaxe ist sinnvoller als eine frühzeitige Erkennung von neuerlichen GAS-Infektionen. Geeignete Antibiotika und die empfohlene Dauer der antibiotischen Prophylaxe sind in den Tabellen 3 + 4 angegeben. Generell gilt, dass eine intramuskuläre Penicillinprophylaxe einer oralen Prophylaxe v. a. in Hochrisikogebieten überlegen ist, statistisch lassen sich Unterschiede auch zwischen 3- und 4-wöchentlicher intramuskulärer Penicillinprophylaxe darstellen.
Der Effekt der (häufig empfohlenen) Tonsillektomie auf die Reduktion des Risikos einer chronischen oder rekurrierenden Tonsillitis ist nicht klar. Eine Metaanalyse von Kindern und Erwachsenen mit chronischer Pharyngitis mit Vergleichsstudien von Tonsillektomie und konservativer Therapie war nicht schlüssig.
Eine Endokarditisprophylaxe ist bei Patienten nach ARF nicht mehr durchzuführen; mit den Ausnahmen nach Klappenersatz, nach Herztransplantation, nach vorangegangener Endokarditis oder bei angeborenen Herzfehlern, die eine Endokarditisprophylaxe benötigen.
Reaktive Poststreptokokkenarthritis (PSRA)
Die reaktive Poststreptokokkenarthritis (Poststreptococcal reactive arthritis, PSRA) wird definiert als Arthritis, assoziiert mit einer rezenten GAS-Infektion, die nicht die Jones-Kriterien für ein ARF erfüllt.
Im Gegensatz zum ARF tritt die Arthritis bis 10 Tage nach Beginn der Pharyngitis auf, sie dauert üblicherweise länger als 2–3 Wochen und es zeigt sich üblicherweise kein dramatisches Ansprechen auf Aspirin. Diese Beobachtungen wurden auf ihre statistische Signifikanz untersucht und als nicht relevant beurteilt. Statistische Unterschiede lassen sich nur in der Höhe von BSG und CRP, im schnelleren Ansprechen auf Aspirin bei ARF gegenüber PSRA sowie der Relapshäufigkeit nachweisen.
Da einzelne Patienten mit PSRA während der Beobachtungszeit von 1 Jahr passagere Herzgeräusche entwickelt haben, wird eine Penicillinprophylaxe für (bis zu) 1 Jahr empfohlen. Wenn während der Beobachtungszeit eine Herzklappenerkrankung auftritt, wird die Krankheit als ARF beurteilt und behandelt. Wenn keine Karditis nachgewiesen werden kann, kann die Penicillinprophylaxe beendet werden.
Gerber MA, Prevention of Rheumatic Fever and Diagnosis and Treatment of Acute Streptococcal Pharyngitis, Circulation 2009; 119. Rheumatic Fever and Rheumatic Heart Disease, World Health Organisation, Geneva 2004, Technical report series 923 (http://whqlibdoc.who.int/trs/WHO_TRS_923.pdf). Barash J, Differentation of Post-Streptococcal Reactive Arthritis from Acute Rheumatic Fever, Journal of Pediatrics – Volume 153, Issue 5, (November 2008). Choby BA, Diagnosis and Treatment of Streptococcal Pharyngitis, American Family Physician – Volume 79, Issue 5 (March 2009). Marijon E, Prevalence of Rheumatic Heart Disease Detected by Echocardiographic Screening, N Engl J Med 2007; 357:470 6.