Worauf in der Praxis achten? Extraartikuläre Manifestationen der RA
Extraartikuläre Manifestationen (EM) werden in 30-40% aller Patienten mit rheumatoider Arthritis (RA) beobachtet und treten häufiger bei hoher Krankheitsaktivität auf1,2. Die häufigsten EM der RA sind die Rheumaknoten und das sekundäre Sjögren-Syndrom, gefürchtet sind vor allem die Skleritiden/ Keratitiden, die rheumatoide Vaskulitis und andere RA-assoziierte Organbeteiligungen (Tab.).
| Tab: Übersicht der wichtigsten extraartikulären Manifestationen der rheumatoiden Arthritis |
|---|
|
Epidemiologie und Klinik
Die Prävalenzdaten zu EM stammen meist aus retrospektiven Analysen, und man kann davon ausgehen, dass heute bei früherer Diagnose und unter adäquater Therapie die Prävalenz niedriger anzusetzen ist. Prinzipiell sind Männer häufiger betroffen als Frauen.
Rheumaknoten
Normalerweise treten Rheumaknoten oberflächlich an Druckstellen der Haut auf, manchmal sind sie auch an anderen Stellen wie der Lunge, den Herzklappen und dem gastrointestinalen Trakt zu finden.
Rheumaknoten sind als Zeichen von hoher Krankheitsaktivität zu werten3. Außerdem korreliert ihr Auftreten mit schwerer Arthritis, hohem Rheumafaktor-Titer (RF-Titer) und einer höheren Inzidenz von rheumatoider Vaskulitis (RV). Das Vorhandensein von RF in den Knoten lässt darauf schließen, dass wohl eine immunkomplexmediierte Vaskulitis den Rheumaknoten zu Grunde liegt.
Sjögren-Syndrom und andere Augenmanifestationen
Prinzipiell sind Augenbeteiligungen bei RA häufig. Am häufigsten ist das sekundäre Sjögren-Syndrom (SS) mit dem Hauptsymptom einer Keratokonjunktivitis sicca (KCS), dessen Prävalenz mit 10-31% angegeben wird2,4. Auftreten und Schweregrad der KCS korrelieren nicht mit der Aktivität der zu Grunde liegenden RA5, das Auftreten von SS korreliert jedoch mit einem schlechteren funktionellen Outcome der RA2.
Eine schwere Komplikation der RA stellt die Skleritis dar, die mit einer Prävalenz von 0,2-6,3% auftritt6. Die Skleritis beginnt als plötzlich auftretender Schmerz in Kombination mit einer hyperämiebedingten Rötung des Auges und Photophobie. Die Entzündung kann sich sowohl in Richtung der Kornea als auch intraokulär ausbreiten. Im Falle einer Progression kann es sogar zu einer Perforation der Sklera kommen, was bis zu einem Verlust des Augenlichtes führen kann. Die häufigste Form der Skleritis ist die diffuse anteriore Skleritis, welche in ca. 60% aller Fälle vorkommt. Die Episkleritis weist eine Inzidenz von 0,17% unter den RA-Patienten auf, jedoch liegt bei 6% aller Episkleritis-Patienten eine RA zu Grunde7.
Selten ist auch die ulzerative Keratitis, jedoch sind 30-40% aller dieser Patienten gleichzeitig von einer RA betroffen. Als Risikofaktoren für die Entstehung werden eine lange Krankheitsdauer, ineffektive Therapie, ein hoher RF-Titer, Keratokonjutivits sicca sowie eine erosive Form der Arthritis genannt6. Die wichtigste Komplikation der peripher ulzerativen Keratitis sind Einschmelzungen, die zu einer Verdünnung der Kornea führen, die ebenfalls in einer Perforation mit Gefahr des dauerhaften Visusverlustes enden können.
Auf jeden Fall sind sowohl Skleritis als auch die ulzerative Keratitis bei RA als Notfälle anzusehen und einer sofortigen ophthalmologischen Therapie zuzuführen.
Rheumatoide Vaskulitis
Die rheumatoide Vaskulitis (RV) basiert auf einer Entzündung der Blutgefäße und betrifft die kleinen und mittleren Gefäße von bis zu 5% aller RA-Patienten. Positiver Rheumafaktor, HLA-DRB1*0401 und Rauchen sind die wichtigsten Risikofaktoren für die RV. Die Aktivität der RV muss nicht mit der synovialen Aktivität der RA korrelieren. Prinzipiell können somit alle Gefäße von einer RV betroffen sein, insbesondere auch der Haut, der Lunge, gastrointestinal und äußerst selten auch im ZNS.
RA-assoziierte Lungenerkrankung
Zu den RA-assoziierten Lungenerkrankung zählen vor allem die pleurale Beteiligung, die RA-assoziierte interstitielle Lungenerkrankung (RAILD), die organisierende Pneumonie und der RK-Befall der Lunge. Alle sind ein starker Prädiktor für die Mortalität der RA-Patienten2. Daraus resultierende Komplikationen sind direkt für 10-20% der Gesamtmortalität verantwortlich8. RA-Patienten mit Erstmanifestation ab dem 60. Lebensjahr sind häufiger von RA-assoziierten Lungenerkrankungen betroffen. Pleurale Beteiligung ist bei RA-Patienten häufig zu sehen, jedoch bleibt diese meist subklinisch9,10.
Die RAILD ist eine häufig EM und trägt signifikant zur Morbidität und Mortalität bei11. Neuere Studien haben keine Assoziation zwischen RAILD und Rauchen gezeigt12,13. Es ist aber davon auszugehen, dass das Rauchen mit einer höheren Prävalenz von Lungentumoren unter RA-Patienten einhergeht14,15.
Gastrointestinale Manifestationen
Etwa 10-38% der Patienten mit RV leiden an einer Darmbeteiligung16. Makroskopisch erkennbare RV im Darm ist selten, aber dann oft katastrophal mit ischämischen Ulzerationen und Darminfarkt. Eine Beteiligung des Kolons kann sich klinisch ähnlich der Colitis ulcerosa präsentieren. Rektale Biopsien mit submuköser Vaskulitis kommen bei bis zu 40% der Patienten vor. Abnorme Ösophagusmotilität und chronisch atrophe Gastritis sind weitere mögliche gastrointestinale Beteiligungen mit RV. Die Leberveränderungen bei RA sind üblicherweise gering, jedoch histologisch bei der Mehrheit der RA-Patienten verändert. Medikamenteninduzierte Leberveränderungen kommen bei Aspirin, Sulfasalazin und Methotrexat vor.
Kardiovaskuläre Beteiligung
Im Prinzip können bei RA alle Strukturen des Herzens betroffen sein. Die koronare Herzerkrankung ist jedenfalls eine der häufigsten Todesursachen von RA-Patienten17. RA-Patienten weisen zudem ein erhöhtes Risiko für Schlaganfall auf, möglicherweise ist das RA-bedingte Risiko somit vergleichbar dem Risiko eines Typ-2-Diabetes18,19. Eine erhöhte Blutsenkungsgeschwindigkeit, Schwellungen großer Gelenke, RV und RA-assoziierte Lungenerkrankung sind unabhängige Risikofaktoren für kardiovaskulär bedingte Mortalität bei RA20.
Die systemische Entzündung hat verschiedene Effekte auf die Entstehung der Atherosklerose wie Epithelschädigung mit Immunkomplex-Ablagerungen und Zytokinfreisetzung, was sekundär mit einer Hyperkoagulabilität einhergeht21. Zudem treten Dyslipidämie und ein veränderter Glukosemetabolismus gehäuft bei RA auf. Patienten unter wirksamer immunsuppressiver Therapie haben dementsprechend ein geringeres Risiko für eine kardiovaskuläre Manifestation22. In einer kürzlich erschienenen Studie wurde bei 31,7% der untersuchten RA-Patienten auch eine Versteifung der Aorta festgestellt23.
Weitere seltene extraartikuläre Manifestationen
Das Felty-Syndrom ist durch Neutropenie und Splenomegalie charakterisiert und kommt bei weniger als 1% der RA-Patienten vor.
Die RA ist die häufigste Ursache für eine sekundäre Amyloidose mit gastrointestinalen Symptomen und findet sich bei 22% der Patienten mit schweren Darmbeteiligungen. Meist findet sich dann Amyloid in der Leber, auch wenn die Leber klinisch nicht auffällig ist.
Raynaud-Syndrom
Das Raynaud-Syndrom wird oft als Begleitphänomen der RA angeführt. Tatsächlich liegt die Prävalenz des Raynaud-Syndroms bei der RA zwischen 2,7% und 17,2%24,25, was sich nicht sehr von den Daten der Gesamtbevölkerung (4,6-19%)26-27 unterscheidet. Somit muss ein direkter Zusammenhang zwischen RA und Raynaud-Syndrom meist hinterfragt werden.
Worauf in der Praxis achten?
Diagnostische Besonderheiten
Prinzipiell sind bei RA-Patienten organspezifische Untersuchungen notwendig, sobald eine entsprechende Klinik vom Patienten angegeben wird. Wegen der erhöhten Morbidität und Mortalität sollten Patienten mit EM je nach Manifestationsform engmaschiger kontrolliert werden. Sowohl die Skleritis als auch die ulzerative Keratitis sind als Notfälle anzusehen und einer sofortigen ophthalmologischen Therapie zuzuführen.
Rheumaknoten werden häufig schon vom Patienten selbst beobachtet und fallen bei der Untersuchung als warme, auf der Unterlage veschiebliche, druckindolente Knoten auf. Meist sind sie an Stellen, die häufig von einer mechanischen Irritation betroffen sind. Eine rezente Studie schlägt vor, dass bei differenzialdiagnostischen Schwierigkeiten zur Unterscheidung von Gichtknoten auch die Sonoelastographie herangezogen werden kann28.
Zum Labor: Patienten mit positivem RF und antinukleären Antikörpern (ANA) haben ein erhöhtes Risiko für eine EM29,30. Bei positivem ANA-Titer, ob leicht oder stark erhöht, wurde ein insgesamt erhöhtes Risikos für kardiovaskuläre Ereignisse nachgewiesen. Bei hohem ANA-Titer ist sogar mit einem 2-fach erhöhten Risiko zu rechnen31.
Schirmer-Test: Auch Patienten mit milden Formen der RA können von einer KCS betroffen sein, weshalb bei allen RA-Patienten ein Schirmer-Test durchgeführt werden sollte32. In einer Studie an 75 Patienten wurde ein abnormer Schirmer-Test bei 70,7% der RA-Patienten festgestellt, wovon aber nur 12% der Patienten bereits Tränenersatzpräparate verwendeten.
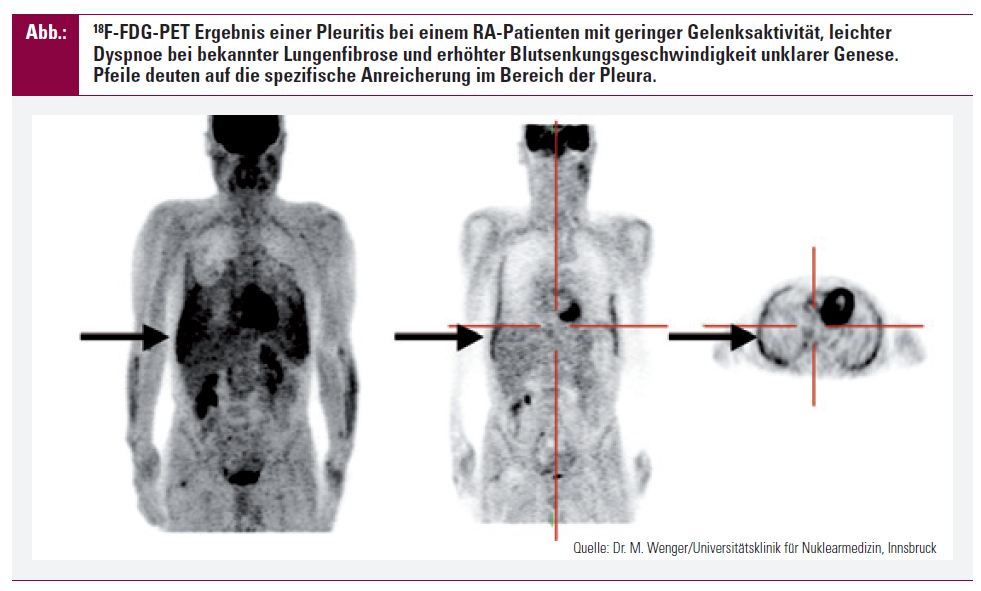
Bildgebung: Fluorodeoxyglukose-Positronen-Emissions-Tomographie (18F-FDG-PET) wird auch in der Rheumatologie eingesetzt, um Gewebe mit einem hohen Glukoseumsatz darzustellen33. Diese Methode ist zum Beispiel in der Diagnostik von erhöhter Blutsenkungsgeschwindigkeit unklarer Genese anerkannt, aber auch um maligne Knoten der Lunge von benignen, wie den Rheumaknoten, zu unterscheiden34. Entzündliche und maligne Zellen haben einen höheren Uptake an 18F-FDG in die Zelle, wo aber die Metabolisierung verlangsamt ist und somit ein stärkeres Signal zu finden ist (Abb.).
Anmerkung zur Therapie extraartikulärer Manifestationen
Das Hauptziel in der Therapie der RA ist die Remission, zumindest aber eine möglichst geringe Krankheitsaktivität35,36. Eine länger anhaltende Krankheitsaktivität ist immer verbunden mit einem erhöhten Risiko von EM und insbesondere von kardiovaskulären Ereignissen.
Generell ist mit dem Ansprechen auf Basistherapeutika das Auftreten von EM seltener. Eine Korrelation mit der synovialen Entzündung ist jedoch nicht immer vorhanden, sodass die EM neben der Gelenksbeteiligung separat zu beurteilen sind und unabhängig zu einer Therapieintensivierung führen können. Es besteht gewisse Evidenz dafür, dass MTX das Risiko einer kardiovaskulären EM vermindert37.
Zusammenfassung
Extraartikuläre Manifestationen (EM) finden sich in 30-40% aller RA-Patienten vor allem bei hoher Krankheitsaktivität. Am häufigsten sind Rheumaknoten, kardiovaskuläre und Augenbeteiligungen. Frühe Diagnostik verbessert die Mortalität der RAPatienten. Neben den organspezifischen Abklärungen und Interventionen ist meist eine Intensivierung der Basistherapie erforderlich.
1 Klippel JH, Stone JH, Crofford LJ, White PH, editors. Primary on the Rheumatic Diseases. 13th ed. New York: Springer; 2008:114-41.
2 Young A, Koduri G, Extra-articular manifestations and complications of rheumatoid arthritis. Best Pract Res Clin Rheumatol 2007; 21:907-27.
3 Veys EM, Keyser FD, Rheumatoid nodules: differential diagnosis and immunohistological findings. Ann Rheum Dis 1993; 52:625-6.
4 Fox RI, Stern M, Michelson P, Update in Sjogren syndrome. Curr Opin Rheum 2000; 12:391-439.
5 Fujita M, Igarashi T, Kurai T, Sakane M, Yoshino S, Takahashi H, Correlation Between Dry Eye and Rheumatoid Arthritis Activity. Am J Ophthalmol 2005; 140:808- 13.
6 Feist E, Pleyer U, Diseases of the outer eye in rheumatoid arthritis. Z Rheumatol 2010;69:403-10.
7 McGavin DD, Williamson J, Forrester JV, Foulds WS, Buchanan WW, Dick WC et al., Episcleritis and scleritis. A study of their clinical manifestations and association with rheumatoid arthritis. Br J Ophthalmol 1976; 60:192-226.
8 Amital A, Shitrit D, Adir Y, The lung in rheumatoid arthritis. Presse Med 2011; 40(1 Pt 2):31-48.
9 Chou CW, Chang SC, Pleuritis as a presenting manifestation of rheumatoid arthritis: diagnostic clues in pleural fluid cytology. Am J Med Sci 2003; 323:158-61.
10 Graham WR, Rheumatoid pleuritis. South Med J 1990; 83:973-5.
11 Young A, Koduri G, Batley M, Kulinskaya E, Gough A, Norton S, et al., Mortality in rheumatoid arthritis. Increased in the early course of disease, in ischemic heart disease and pulmonary fibrosis. Rheumatology(Oxford) 2007; 46:350-7.
12 Biederer J, Schnabel A, Muhle C, Gross WL, Heller M, Reuter M, Correlation between HRCT findings, pulmonary function tests and bronchoalveolar lavage cytology in interstitial lung disease associated with rheumatoid arthritis. Eur Radiol 2004; 14:272-80.
13 McDonagh J, Greaves M, Wright AR, Heycock C, Owen JP, Kelly C, High resolution computed tomography of the lungs in patients with rheumatoid arthritis and interstitial lung disease. Br J Rheumatol 1994; 33:118-22.
14 Tobón GJ, Youinou P, Saraux A, The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. J Autoimmun 2010; 35:10-4.
15 Khurana R, Wolf R, Berney S, Caldito G, Hayat S, Berney SM, Risk of development of lung cancer is increased in patients with rheumatoid arthritis: a large case control study in US veterans. J Rheumatol 2008; 35:1704-8.
16 Ebert EC, Hagspiel KD, Gastrointestinal and hepatic manifestations of rheumatoid arthritis. Dig Dis Sci 2011; 56: 295-302.
17 Turiel M, Sitia S, Atzeni F, Tomasoni L, Gianturco L, Giuffrida M et al., The heart in rheumatoid arthritis. Autoimmun Rev 2010; 9:414-8.
18 Voskuyl AE, Zwinderman AH, Westedt ML, Vandenbroucke JP, Breedveld FC, Hazes JM, Factors associated with the development of vasculitis in rheumatoid arthritis: results of a case-control study. Ann Rheum Dis 1996; 55:190-2.
19 van Halm VP, Peters MJ, Voskuyl AE, Boers M, Lems WF, Visser M, et al., Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross sectional study, the CARRE Investigation. Ann Rheum Dis 2009; 68:1395-400.
20 Maradit-Kremers H, Nicola PJ, Crowson CS, Ballman KV, Gabriel SE. Cardiovascular death in rheumatoid arthritis: a population-based study. Arthritis Rheum 2005; 52:722-32.
21 Sattar N, McCarey DW, Capell H, McInnes IB, Explaining how high-grade” systemic inflammation accelerates vascular risk in rheumatoid arthritis. Circulation 2003; 108: 2957-63.
22 Westlake SL, Colebatch AN, Baird J, Kiely P, Quinn M, Choy E et al., The effect of methotrexate on cardiovascular disease in patients with rheumatoid arthritis: a systematic literature review. Rheumatology(Oxford) 2010; 49:295-307.
23 Sliem H, Nasr G, Change of the aortic elasticity in rheumatoid arthritis: Relationship to associated cardiovascular risk factors. J Cardiovasc Dis Res 2010; 1:110-5.
24 Carroll GJ, Withers K, Bayliss CE, The prevalence of Raynaud’s syndrome in rheumatoid arthritis. Ann Rheum Dis 1981; 40:567-70.
25 Saraux A, Allain J, Guedes C, Baron D, Youinou P, Le Goff P, Raynaud’s phenomenon in rheumatoid arthritis. Br J Rheumatol 1996; 35:752-4.
26 Palmer KT, Griffin MJ, Syddall H, Pannett B, Cooper C, Coggan D, Prevalence of Raynaud’s phenomenon in Great Britain and its relation to hand transmitted vibration: a national postal survey. Occup Environ Med 2000; 57:448-52.
27 Silman A, Holligan S, Brennan, Maddison P, Prevalence of symptoms of Raynaud’s phenomenon in a general practice. Br Med J 1990; 301:590-2.
28 Sconfienza LM, Silvestri E, Bartolini B, Garlaschi G, Cimmino MA, Sonoelastography may help in the differential diagnosis between rheumatoid nodules and tophi. Clin Exp Rheumatol. 2010; 28:144-5.
29 Gordon DA, Stein JL, Broder I, The extra-articular features of rheumatoid arthritis. A systematic analysis of 127 cases. The Am J Med 1973; 54:445-52.
30 Gabriel SE, Crowson CS, Kremers HM, Doran MF, Turesson C, O’Fallon WM et al., Survival in rheumatoid arthritis: a population-based analysis of trends over 40 years. Arthritis Rheum 2003; 48:54-8.
31 Liang KP, Kremers HM, Crowson CS, Snyder MR, Therneau TM, Roger VL et al., Autoantibodies and the risk of cardiovascular events. J Rheumatol 2009; 36:2462-9.
32 Piper H, Douglas KM, Treharne GJ, Mitton DL, Haider S, Kitas GD, Prevalence and predictors of ocular manifestations of RA: is there a need for routine screening? Musculoskeletal Care 2007; 5:102-17.
33 Schirmer M, Calamia KT, Wenger M, Klauser A, Salvarani C, Moncayo R, 18F-fluorodeoxyglucose- positron emission tomography: a new explorative perspective. Exp Gerontol 2003; 38:463-70.
34 Hustinx R, Benard F, Alavi A, Whole-body FDG-PET imaging in the management of patients with cancer. Semin Nucl Med 2002; 37:35-46.
35 Smolen JS, Aletaha D, Bijlsma JW, Breedveld FC, Boumpas D, Burmester G et al., Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69:631-7.
36 Combe B, Landewe R, Lukas C, Bolosiu HD, Breedveld F, Dougados M et al., EULAR Recommendations for the Management of Early Arthritis: Report of a Task Force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2007; 66:34-45.
37 Michaud K, Wolfe F, Comorbidities in rheumatoid arthritis. Best Pract Res Clin Rheumatol 2007; 21:885-906.