Rheumatoide Arthritis (RA) – Vergleich der Wirksamkeit von Biologika nach TNFi-Versagen
Der empfohlene Behandlungsalgorithmus für Patienten mit rheumatoider Arthritis2 sieht einen raschen Therapiestart mit synthetischen Basistherapeutika (disease-modifying anti-rheumatic drugs; DMARD) vor, präferenziell mit Methotrexat. Bei ungenügendem Rückgang der Entzündungsaktivität wird die Kombination mit einem Biologikum angestrebt, wobei die zunächst verwendenten Substanzen in aller Regel TNF-alpha-Inhibitoren (TNFi) sind. Bei einigen Patienten stellt sich jedoch auch mit TNFi nicht der gewünschte therapeutische Erfolg ein3.
Um das optimale therapeutische Management für diese aggressivsten Verlaufsformen der RA zu evaluieren, wurde zunächst eine systematische Literatursuche in den elektronischen Datenbanken MEDLINE und Cochrane sowie auf www.clinicaltrials.gov durchgeführt. Erfolgsraten und Daten zur Sicherheit verschiedener Therapien nach Versagen von ≥ 1 TNFi wurden in einer Vergleichsstudie aller zur Verfügung stehender Biologika analysiert. Erste Ergebnisse waren am ACR-Kongress in Atlanta zu sehen.
Head-to-Head-Vergleiche fehlen
Biologika, die in der Indikation des TNFi-Versagens getestet wurden, sind das CTLA4Ig-Fusionsprotein Abatacept (Orencia®), der TNFi Golimumab (Simponi®), das Anti-B-Zell-Präparat Rituximab (MabThera®) sowie der Anti-IL-6-Rezeptor-Antikörper Tocilizumab (RoActemra®).
Für jede dieser Therapieoptionen konnte im randomisierten Vergleich die Überlegenheit gegenüber einem Placeboarm nachgewiesen werden4–7, jedoch stehen direkte Vergleiche von Effektivität und Sicherheit der genannten Substanzen im Sinne von „Head to Head“-Studien aus. Ein Grund hierfür ist sicherlich unter anderem die Tatsache, dass adäquat gepowerte direkte Vergleiche – unter der Annahme von relativ kleinen Effektivitätsunterschieden – sehr große Studienpopulationen erfordern und damit hohe Kosten verursachen würden.
Paarweise Vergleiche der Therapien mittels indirekter Metaanalyse
Eine paarweise indirekte Metaanalyse stellt eine Annäherung an fehlende direkte Vergleiche dar, indem sie es ermöglicht, die therapeutischen Arme aus verschiedenen randomisierten Studien einander gegenüberzustellen. Die Methode basiert auf der Annahme eines gemeinsamen Placeboarms8 – Voraussetzung für diese Annahme ist allerdings, dass die Patientenkollektive aller inkludierten Studien vergleichbar sind. Diese Hypothese von in Bezug auf alle relevanten Charakteristika (wie Krankheitsaktivität, funktionelle Einschränkung, Alter etc.) homogenen Studienpopulationen muss vorweg geprüft werden: Mit einer Cochrane’s-Q-Statistik wird dabei quantifiziert, in welchem Ausmaß die Variabilität der Studien deren Heterogenität zuzuschreiben ist, das Ergebnis wird als I2-Wert mit einem Range von 0 bis 100 % angegeben, wobei üblicherweise ein Wert von > 50 % als substanzielle Heterogenität gewertet wird.9 Ist eine solche ausgeschlossen, können zwei aktive Interventionsarme indirekt über einen postulierten gemeinsamen Placeboarm verglichen werden.10, 11
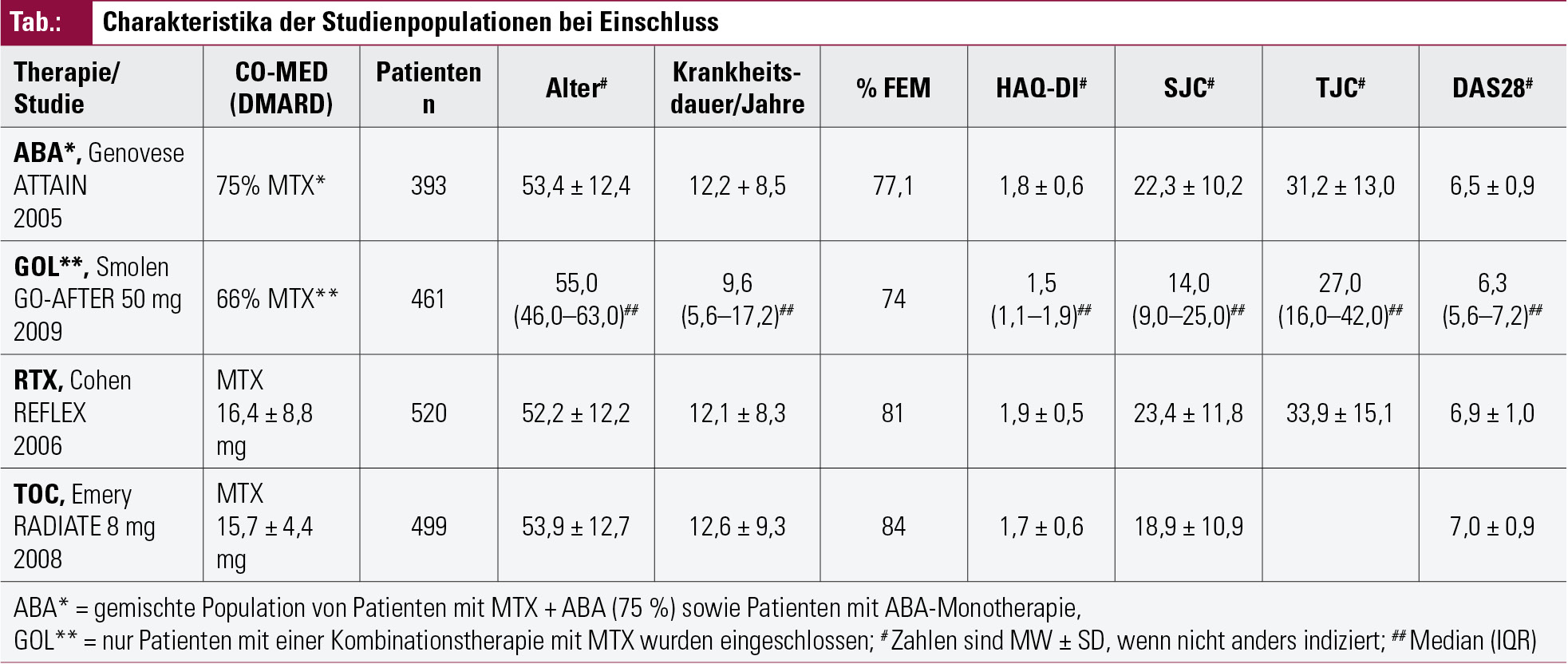
Im Fall der TNFi-refraktären RA-Patienten ergab sich dabei Folgendes: Die Einschlusskriterien aller vier Studien forderten „active disease“ trotz TNFi, allerdings wurden hierfür teilweise durchaus unterschiedliche Kriterien definiert, zum Beispiel war die geforderte Mindestanzahl geschwollener Gelenke ≥ 46, ≥ 65, ≥ 84, oder auch ≥ 107 und das Minimum an druckschmerzhaften Gelenken ≥ 46, ≥x85, 4 oder ≥1 27. Außerdem hatten 3 Studien4, 5, 7 Akutphaseparameter in die Einschlusskriterien aufgenommen, definiert als entweder ein C-reaktives Protein von > 1,5 mg/dl4 oder > 1,0 mg/dl5, 7 oder eine Blutsenkungsgeschwindigkeit von mindestens 28 mm/h4, 5. Interessanterweise waren trotzdem die eingeschlossenen Patienten nicht signifikant unterschiedlich. Die errechneten Werte für I2 lagen zwischen 0 % und maximal 6,2 % für die verschiedenen Parameter, einschließlich der Gelenks-Scores und Entzündungszeichen im Serum. Das Gleiche gilt für das durchschnittliche Alter und die Krankheitsdauer der Patienten, was den Einschluss aller im Literatursearch gefundenen Studien in die Metaanalyse ermöglichte. In der Tabelle sind die Baseline-Charakteristika der Studienpopulationen angeführt.
Ähnliche Effektivität der eingesetzten Biologika
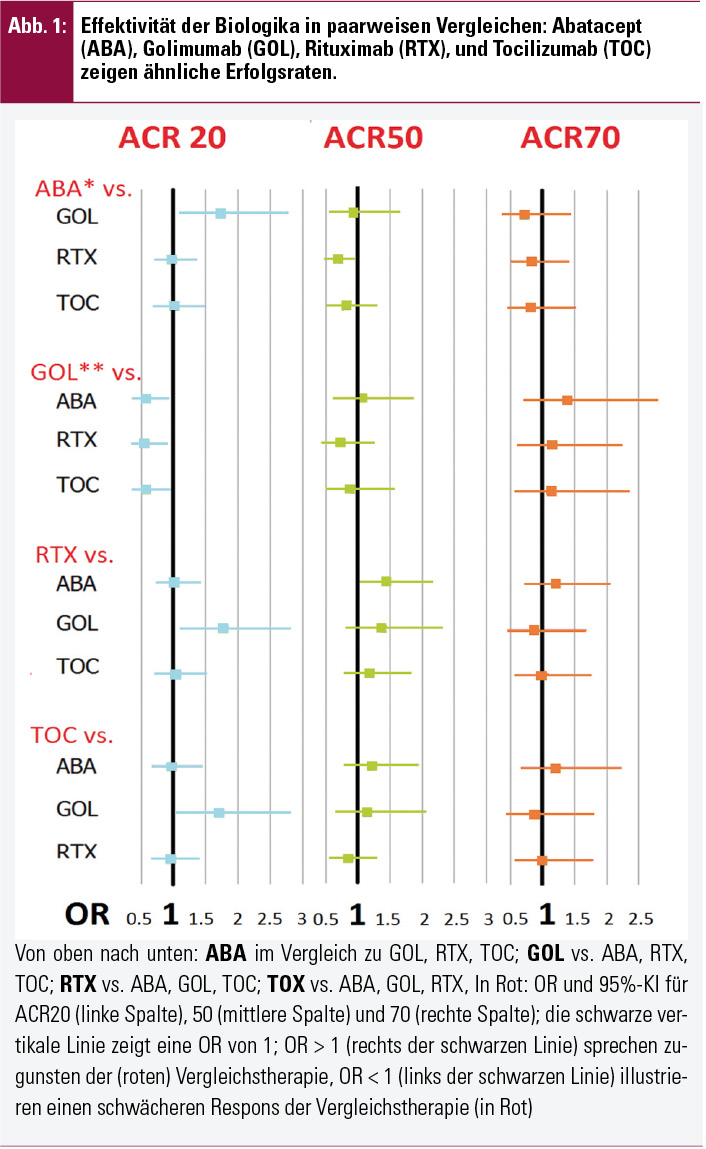
Aus den Originalstudien bekannt war das gute Ansprechen der einzelnen Substanzen im Vergleich mit ihren Placeboarmen. In der Metaanalyse erbrachten die Vergleiche der Biologika untereinander sehr ähnliche Erfolgsraten. Abbildung 1 zeigt, dass für die Endpunkte ACR50 und ACR70 keine signifikanten Unterschiede bestanden.
Der ACR20-Respons unter Golimumab erscheint etwas geringer als bei Abatacept (OR; 95%-KI: 0,58; 0,36–0,92), Rituximab (0,56; 0,36–0,89), oder Tocilizumab (0,59; 0,36–0,96; Abb. 1), allerdings bestand in der GO-AFTER-Studie mit 14 Wochen ein kürzeres Follow-up bis zum primären Endpunkt, und in Subanalysen zeigte sich, dass bei den Studien, die ein Follow-up von 24 Wochen hatten, die Zwischenergebnisse zu früheren Zeitpunkten im Vergleich zu Golimumab auch für ACR20 keine signifikant unterschiedlichen Ergebnisse brachten. Detaillierte Daten standen hier von der ATTAIN-Studie zur Verfügung: gegenüber der Abatacept-Therapie nach 85 Tagen bestanden keine signifikanten Unterschiede in den Erfolgsraten von Golimumab (OR 0,78, 95%-KI 0,54–1,13, p = 0,19). Das Gleiche gilt für die klinisch wichtigeren Endpunkte ACR50 und ACR70 auch schon zu früheren Zeitpunkten.
Die Biologika wurden in Kombination mit DMARD, in den meisten Fällen mit MTX, verabreicht, eine Ausnahme bildete hier die GO-AFTER-Studie, in der ca. 30 % der Patienten Golimumab als Monotherapie erhielten.6 Um die Vergleichbarkeit der Resultate zu gewährleisten, wurde daher die Subpopulation mit MTX verwendet.
Effektivität nach multiplem TNFi-Versagen
Die publizierten Daten von zwei der Studien erlaubten Subanalysen jener Patienten, die zuvor nur ein TNFi erhalten hatten, im Vergleich mit Patienten nach mehreren Biologika-Vortherapien. Die Evaluierung von Golimumab und Tocilizumab zeigte ein ähnlich gutes klinisches Ansprechen nach einem, zwei, oder sogar drei abgebrochenen TNFi-Therapien im Vorfeld (Abb. 2). Allerdings muss gesagt werden, dass insgesamt nur relative wenige Patienten zuvor 3 TNFi erhalten hatten und die geringen Patientenzahlen (und großen Konfidenzintervalle der Ergebnisse) hier auch die Notwendigkeit weiterer Studien aufzeigen.
Vergleichbare Sicherheitsdaten
Angaben zum Auftreten von Nebenwirkungen während des Follow-up-Zeitraums von 8 Wochen standen aus allen Studien zur Verfügung. Die gepoolten Risk Ratios (RR) zeigten kein erhöhtes Risiko für das Auftreten von Nebenwirkungen (1,0; 95%-KI 0,9–1,1) oder Infektionen (1,3; 0,7–2,5) in den direkten Vergleichen der Interventionen mit ihren jeweiligen Placeboarmen. Die indirekten paarweisen Vergleiche erbrachten signifikant weniger allgemeine Nebenwirkungen unter Golimumab, mit Risk Differences (RD) zwischen 0,13 im Vergleich zu Abatacept und 0,18 im Vergleich zu Rituximab und Tocilicumab. Akute (d. h., innerhalb von 24 Stunden auftretende) Infusionsreaktionen traten bei Rituximab häufiger auf als bei Abatacept (RD, 95%-KI: 0,18; 0,13–0,24) und Tocilizumab (0,14; 0,08–0,21), ein Effekt, der allerdings bei der zweiten Rituximab-Infusion nicht mehr festzustellen war.
Resümee
Bei zunächst unter TNFi therapierefraktär erscheinender RA können mit Abatacept, Golimumab, Rituximab und Tocilizumab signifikante Verbesserungen für die Patienten erzielt werden. Solange Head-to-Head-Studien ausstehen, bietet die Methode der indirekten Metaanalyse eine validierte Annäherung, um die Effektivität und Nebenwirkungsrate dieser Biologika einander gegenüberzustellen. Die Analysen zeigen vergleichbare Erfolgsraten der Präparate und auch zufrieden stellende Daten zur Sicherheit. Für die Therapieauswahl in der klinischen Praxis gibt das mehr Spielraum, um auch andere Präferenzen zu berücksichtigen, wie zum Beispiel etwaige Patientenwünsche hinsichtlich der Applikationsart.
Besonders wichtig zu betonen ist, dass die durchwegs guten Erfolge in der Eindämmung der Krankheitsaktivität auch noch nach vorherigem Versagen mehrerer TNFi gezeigt werden konnten.