Tuberkulose-Screening -Was ist sinnvoll?
Die heute verfügbare breite Palette von immunmodulativ wirksamen Substanzen bringt die in der Rheumatologie, Gastroenterologie und Dermatologie klinisch tätigen Ärztinnen und Ärzte häufig in die Situation, zu Beginn einer Therapie oder auch während der Überwachung einer Therapie eine latente Infektion mit Mycobacterium tuberculosis (MT) ausschließen zu müssen.
Epidemiologie
Global wird die Anzahl der neuen Fälle einer manifesten TB auf über 9 Millionen pro Jahr geschätzt. Die Prävalenz der latenten TB beträgt weltweit nach Schätzung der WHO ein Drittel der Weltbevölkerung1. In Österreich sieht die Situation vergleichsweise günstig aus: So wurden 2009 nur 700 Fälle von Neuerkrankungen in der Gesamtbevölkerung dokumentiert2. Daraus ergibt sich statistisch eine jährliche Inzidenz von 8,36/100.000 Einwohner. Eine genaue Betrachtung der Risikogruppen ergibt jedoch beträchtliche Unterschiede: Die höchste Inzidenz zeigte die Altersgruppe > 65 Jahre (12,81/100.000 Einwohner). Männer erkrankten nahezu doppelt so oft wie Frauen; zusätzlich war bei Aufschlüsselung nach Staatsangehörigkeit der Anteil von Erkrankten mit nichtösterreichischer Staatsangehörigkeit relativ höher, und die Inzidenz betrug 34,41/100.000 Einwohner. Die Inzidenz der aktiven TB bei MigrantInnen nähert sich jedoch mit der Zeit des Aufenthaltes der durchschnittlichen Inzidenz in Österreich. Allgemeine Risikofaktoren für die Infektion mit MT zeigt Tabelle 1. Das Risiko für Progression zur aktiven TB wird in Tabelle 2 dargestellt. Die Wahrscheinlichkeit einer latenten Infektion kann anhand anerkannter Risikofaktoren nur abgeschätzt werden.
Testverfahren
PPD-Test, intradermale Technik nach Charles Mantoux (Tuberkulin-Haut-Test)
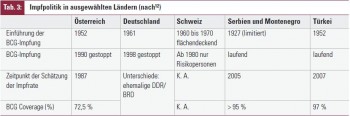
Der sog. Mendel-Mantoux-Test (MM-Test) beruht auf einer Immunreaktion auf einen stattgehabten Kontakt mit Antigenen von Mykobakterien: Nach streng intradermaler Injektion dieser Antigene tritt eine Immunreaktion auf, deren Intensität (Induration, Rötung der Dermis) nach frühestens 48 bis 72 Stunden durch ÄrztInnen beurteilt wird. Etwa ein Jahrhundert, nachdem dieses und ähnliche Testverfahren als einzige Möglichkeiten zur Verfügung standen, einen Kontakt/eine Infektion mit MT nachzuweisen, dürfen einige Limitationen dieses Verfahrens erwähnt werden: Einerseits ist die streng intradermale Injektion notwendig, andererseits zumindest zwei Arztbesuche. Zusätzlich kann durch Impfung mit BCG (Bacillus Calmette-Guérin), einem Verfahren, das in Österreich wie auch in anderen Ländern lange üblich war (Auswahl siehe Tabelle 3), ein falsch positives Ergebnis erzielt werden. Die BCG-Impfung wird seit den 40er Jahren des letzten Jahrhunderts weltweit angewandt; seit 1974 ist sie Teil des Expanded Programme on Immunization der Weltgesundheitsorganisation (WHO). Das Ausmaß dieses Effektes ist vom Alter zum Zeitpunkt der Impfung4, einem eventuellen „booster effect“ und der Immunkompetenz zum Zeitpunkt einer Testung abhängig. Auch Kontakt/Infektion mit MOTT (Mycobacteria Other Than Tb) kann einen positiven PPD-Test evozieren rev. in 3. Abseits von Applikations- und Ablesefehlern werden falsch negative Ergebnisse bei Lebensalter ≥ 50. LJ, immunsuppressiver Therapie, Lebendimpfung innerhalb der letzten 6 Wochen, systemischer Kortikosteroidgabe, kurz zurückliegender Virusinfektion inkl. Influenza sowie zellulären Immundefekten erwartet rev. in 6.
Interferon γ Release Assays (IGRA)
Im Jahr 2001 erfolgte die Einführung neuer Testverfahren zur Diagnostik der TB. So genannte IGRA sollen durch In-vitro-Kontakt von Lymphozyten der Testperson mit mykobakteriellen Antigenen die Interferon-γ-Sekretion spezifischer T-Zellen messen, die zuvor durch stattgehabte Infektion mit Mykobakterien sensibilisiert wurden. Zwei heute in Österreich verwendeten IGRA unterscheiden sich in der Methodik: Der QuantiFERON®-TBGold- in-Tube-Test (QFT-GIT; Cellestis Limited, Carnegie, Victoria, Australia; FDA approval 2007) verwendet 14 Peptide (unter anderem early secretory antigenic target-6 [ESAT-6] und culture filtrate protein 10 [CFP-10]), Teile der Sequenz von TB7.7,und zeigt Sensibilisierung auf M. tuberculosis, M. kansasii, M. szulgai und M. marinum. Zeitgleich mit der Abnahme des Teströhrchens werden eine Negativ- („nil“) und eine Positivkontrolle (Spezialröhrchen des Herstellers; Mitogen) abgenommen. Nach längstens 16 Stunden Transportzeit (bei Raumtemperatur) wird durch einen ELISA die Interferon-γ-Konzentration im separierten Plasma gemessen. Die Interpretation der Ergebnisse erfolgt nach definierten Standards3.
Das FDA-Approval für den T-SPOT.TB® (Oxford- Immunotec, GB) erfolgte 2008. Nach Inkubation von PBMC (isolierte periphere mononukleäre Zellen) mit Kontrollmedium bzw. ESAT-6 und CFP-10 wird ein sog. Enzyme-linked Immunospot Assay (ELISpot) durchgeführt, der die Anzahl von IFN γ sezernierenden Zellen (repräsentiert durch „Spots“ in den Testplatten) nach Stimulation mit Antigen vs. Kontrollmedium vergleicht.
Beide Tests vergleichen die „TB-response“ mit einer Negativkontrolle und einer Positivkontrolle (Mitogen). Diese In-vitro- Testmethoden messen eine biologische Antwort in Form von Interferon-γ-Ausschüttung. Auch bei Durchführung der Negativkontrolle kann es daher zu messbaren Ergebnissen kommen, und diese fließen bei beiden Methoden in die Interpretation ein. Die durch die Hersteller bzw. die FDA empfohlenen Cutoffs sind online abrufbar, und für jede Befundkonstellation inklusive „unbestimmter“ Ergebnisse wurden Grenzwerte publiziert.
Die Beurteilung der statistisch „korrekten“ Sensitivität (Richtig- Positiv-Rate) kann in erster Linie über gesicherte TB-Infektionen erfolgen. Hieraus folgt bereits das erste Limit: Es gibt keinen „Goldstandard“ für die Diagnostik der latenten TB. Für die Diagnostik der aktiven, durch Kultur gesicherten TB zeigen gepoolte Daten zur Abschätzung der Sensitivität des QF-GIT eine Sensitivität von 81 %3. Poolt man Daten aus Studien, welche die Sensitivität des QF-GIT mit dem PPD-Test für das Vorliegen einer aktiven, kulturell gesicherten TB verglichen, so ergab sich eine Sensitivität von 83 % (QF-GIT) bzw. 89 % (PPD-Test). Ähnliche Zahlen zeigen sich für den T-SPOT.TB-Test: Für die Diagnostik der aktiven, durch Kultur gesicherten TB zeigen gepoolte Daten eine Sensitivität von 91 %3. Im direkten Vergleich zum PPD- Test wiederum eine Sensitivität von 90 % (T-SPOT.TB) bzw. 89 % (PPDTest). Zur Abschätzung der Spezifität (Richtig-Negativ-Rate) zeigt sich: Poolt man Daten aus Studien von (Low-Risk-)Populationen, so ergibt sich eine Spezifität von 99 % (QF-GIT) bzw. 85 % (PPDTest); für den T-SPOT.TB eine Spezifität von 88 % vs. 86 % (PPDTest). Betrachtet man allerdings die vorliegenden Daten, welche sich auf Patienten mit chronisch entzündlichen Erkrankungen beziehen rev. in 5 , so zeigt sich eine Diskordanz der Testergebnisse bei ein und demselben Patienten (auffallend niedrige Rate für PPD-Test-Positivität im Vergleich zu IGRA-Positivität). In einer rezenten Metaanalyse11 wird weiters darauf aufmerksam gemacht, dass bei immunsupprimierten PatientInnen eine erhöhte Rate an „unbestimmten“ Testergebnissen für beide IGRA zu erwarten sind (in der Größenordnung von 4 bis zu etwa 6 %). Eine Wiederholung des IGRA kann hier angezeigt sein, da neben der medikamentösen Therapie häufig auch technische Fehler für ein „unbestimmtes“ Ergebnis verantwortlich zeichnen.
Bildgebung
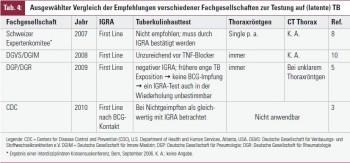
Die konventionelle Thoraxröntgenuntersuchung in einer Ebene (p. a.) wird Bezug nehmend auf eine ältere Studie von Meyer et al.7 als ausreichend zur Detektion (post-)spezifischer Veränderungen angesehen 6, 8. In dieser Studie lag die Detektion postspezifischer Veränderungen bei US-amerikanischen PatientInnen (BCG-Impfstatus nicht angegeben) mit positivem Tuberkulin- Hauttest durch das laterale Thoraxröntgen allein bei nur 0,4 % (n = 2/535). Als abnormal hinsichtlich der Fragestellung wurden bei dieser Serie 85/535 Röntgen klassifiziert (15 %). Eine weitere Studie9 zeigte keinen diagnostischen Vorteil durch das seitliche Thoraxröntgen bei gleicher Fragestellung und anderem Kollektiv (hohe Fallzahl von n = 875 Beschäftigte im Gesundheitswesen mit positivem Tuberkulin-Hauttest). Insgesamt wird für das Thoraxröntgen jedoch eine niedrige Sensitivität angenommen. Unter Bedachtnahme auf die vergleichsweise niedrige Röntgenstrahlenexposition durch ein zusätzliches laterales Bild scheint eine Untersuchung in 2 Ebenen jedoch vertretbar. Die diagnostische Bedeutung einer Computertomografie hinsichtlich Detektion postspezifischer Veränderungen bleibt offen, wenngleich sie bei unklaren Befunden bereits empfohlen wird5. Jedenfalls scheint die Bildgebung insgesamt zur Diagnostik der latenten TB nicht das Mittel der ersten Wahl; aus klinischem Standpunkt heraus (Risiko einer Neuinfektion unter Immunosuppression; Deckplatteneinbrüche der Brustwirbelkörper als Nebenbefund?) ist ein Erheben des Status quo jedenfalls empfehlenswert. Einen Vergleich der aktuellen Empfehlungen verschiedener Fachgesellschaften zur Diagnostik der (latenten) TB zeigt die Tabelle 4.
Zusammenfassung
In Anbetracht der Datenlage und bereits publizierten Empfehlungen scheint die primäre Diagnostik mittels IGRA und Thoraxröntgen bei PatientInnen mit chronisch entzündlichen Erkrankungen und Immunsuppression (insbesondere unter der Annahme der Möglichkeit eines verfälschten Tuberkulin-Haut- Tests) sinnvoll zu sein. In der Regel muss dabei bei Patientinnen mit immunsuppressiver Therapie mit einer etwas erhöhten Rate an „unbestimmten“ Testergebnissen bei IGRA gerechnet werden. Stellt sich lediglich die Frage nach Vorliegen einer latenten TB, so soll erwähnt werden, dass nach derzeitigem Wissensstand bei korrekter Durchführung der Tuberkulintest bei nicht immunsupprimierten, nicht BCG-geimpften ProbandInnen durchaus weiterhin mit den IGRA konkurrieren kann. Ein zu Beginn einer immunsuppressiven Therapie negatives Testergebnis (auch des IGRA) sollte an die Limits beider Testmethoden denken lassen und entsprechende ärztliche Kontrollen als Konsequenz nach sich ziehen.
1 World Health Organization. Global tuberculosis control: epidemiology, strategy, financing: WHO report 2009. Geneva, Switzerland: World Health Organization; 2009. Available at http://www.who.int/tb/publications/global_report/2009/ pdf/report_without_annexes.pdf Accessed June 16, 2010.
2 Schmid D, Kuo HW, Indra A, Jahresbericht 2009 der Nationalen Referenzzentrale für Tuberkulose.
3 Mazurek M et al., MMWR Recomm Rep. 2010 Jun 25; 59 (RR-5):1–25.
4 Joncas JH, Robitaille R, Gauthier T, Can Med Assoc J. 1975 Jul 26; 113(2):127–8.
5 Diel R et al., Pneumologie. 2009 Jun; 63(6):329–34. Epub 2009 Jun 10.
6 Diel R et al., Pneumologie 2007; 61:440–455
7 Meyer M et al., Chest. 2003 Nov; 124(5):1824–7
8 Beglinger C et al., Swiss Med Wkly. 2007 Nov 3; 137(43–44):620–2.
9 Eisenberg RL et al., Radiology. 2009 Sep; 252(3):882–7. Epub 2009 Jun 9
10 Hoffmann JC et al., Z Gastroenterol 2008; 46: 1094–1146 11 Diel R et al., Chest 2010;137; 952–968; Prepublished online December 18, 2009
12 Zwerling A et al., The BCG World Atlas. Online-Atlas zur weltweiten Impfpolitik; McGill University & McGill University Health Center Montreal, Quebec, Canada. online unter http://www.bcgatlas.org/