ESMO-Highlights zum Mammakarzinom – Große Fortschritte und erfreuliche Signale
Das ESMO-Meeting war einerseits durch große Fortschritte gekennzeichnet, was die Etablierung des Überlebensvorteils mit CDK4/6-Inhibitoren betrifft, andererseits gab es auch erfreuliche Signale bei kleineren, schwierigen Subgruppen des Mammakarzinoms.
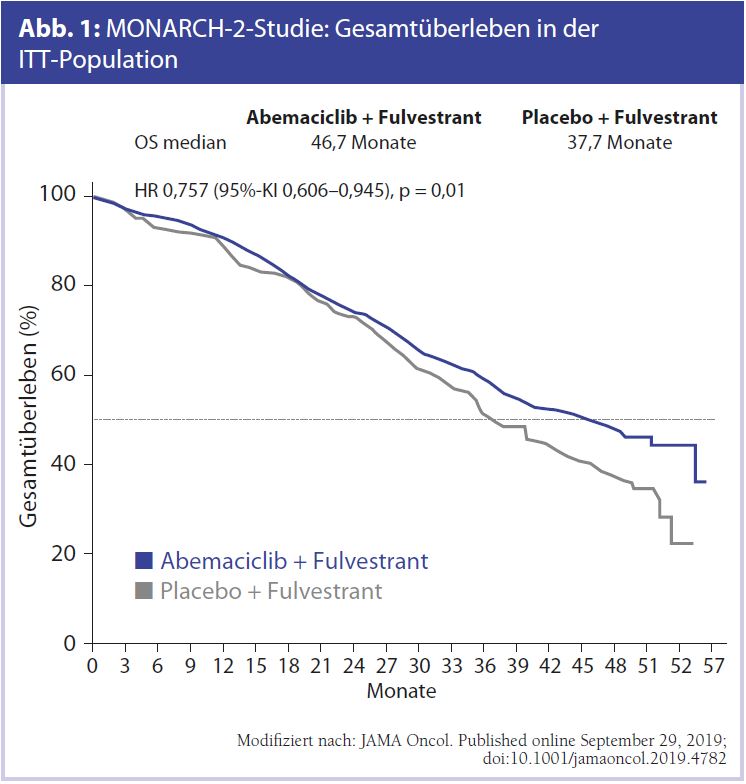
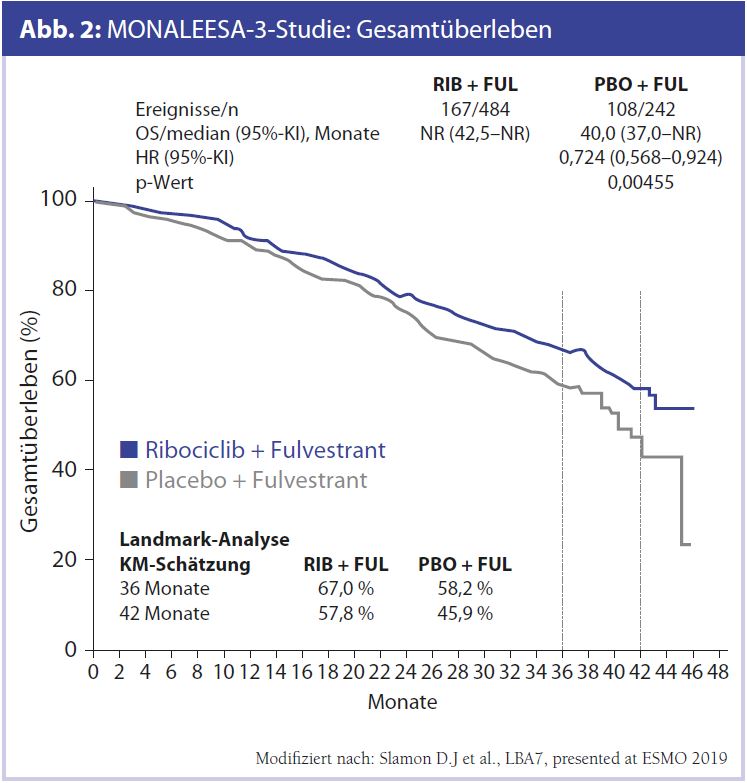
MONARCH-2 zu Abemaciclib, MONALEESA-3 zu Ribociclib beim HR+/HER2–-Mammakarzinom: Das vielleicht wichtigste ESMO-Highlight beim Mammakarzinom sind die Überlebensdaten mit CDK4/6-Inhibitoren. Es haben sowohl die MONARCH-2-Studie mit Abemaciclib (Abb. 1, Tab. 1) wie auch die MONALEESA-3-Studie mit Ribociclib (Abb. 2, Tab. 2) eindeutig signifikante und vor allem auch klinisch relevante Ergebnisse erzielen können – mit einer Verbesserung des Gesamtüberlebens im Bereich von 10 Monaten in der MONARCH-2-Studie.
REAL-World-Daten: Kombinationstherapie Palbociclib + Letrozol in der Erstlinie beim metastasierten HR+/HER2–-Mammakarzinom: Palbociclib wurde als erster CDK4/6-Hemmer im November 2016 in Europa zugelassen. Patientinnen mit HR-positivem/HER2-negativem Brustkrebs wurden im PALOMA-Studienprogramm in unterschiedlichen Settings behandelt. Was bislang fehlte, waren Real-World-Daten, die am diesjährigen ESMO präsentiert wurden. In der retrospektiven Analyse wurde das so genannte „real world“-progressionsfreie Überleben (rwPFS) unter Palbociclib + Letrozol versus Letrozol alleine bei metastasierten Brustkrebspatientinnen in den USA untersucht. Es wurden dafür Daten von Patientinnen ausgewertet, die von Ärzten in elektronischen Patientenakten hinterlegt wurden. Zwischen Februar 2015 und August 2018 erhielten 1.416 Brustkrebspatientinnen Palbociclib + Letrozol (n = 798) oder nur Letrozol (n = 618) als Erstlinientherapie. Als rwPFS wurde die Zeit vom Therapiebeginn bis zum Tod oder Krankheitsprogression basierend auf klinischem Assessment oder Evidenz durch Radiologie/Gewebsbiopsie definiert. Im Ergebnis zeigt sich nach einem medianen Follow-up von 16,8 Monaten ein signifikanter Unterschied zwischen den Gruppen: das rwPFS war unter Palbociclib + Letrozol um 7,4 Monate länger als mit alleiniger endokriner Therapie (24,5 Monate vs. 17,1 Monate) (p = 0,0003).
Ein wesentlicher Aspekt dieser Real-World-Evidenz über einen Zeitraum von 4 Jahren nach der Erstzulassung sind potenzielle Langzeittoxizitäten. Rezent wurde hierzu auch eine gepoolte Analyse der PALOMA-Studien publiziert. Im Einklang mit der klinischen Praxis kommen die Autoren zum Schluss, dass sich auf Basis der Langzeitdaten keine Evidenz für eine kumulative Toxizität oder für eine verzögerte Toxizität als Resultat der längeren Therapiedauer ergibt, was für den Einsatz von Palbociclib plus endokriner Therapie in laufenden adjuvanten Studien eine wichtige Feststellung ist.
monarcHER zum CDK4/6-Inhibitor Abemaciclib beim HER2-positiven Mammakarzinom: Während die bisherigen praxisverändernden Daten mit CDK4/6-Inhibitoren beim luminalen, HER2-negativen Mammakarzinom generiert wurden, ist monarcHER eine Phase-II-Studie, die Abemaciclib beim luminalen, HER2+-Mammakarzinom untersucht, und zwar in Kombination mit Trastuzumab + Fulvestrant (Arm A) bzw. Trastuzumab (Arm B) im Vergleich zu einer Standard-Immunchemotherapie (Trastuzumab + Chemotherapie) (Arm C). monarchHER ist sozusagen die Fortsetzung der Monarch-Studie beim HER2-positiven Mammakarzinom.
Die Rationale ist ein Wirksynergismus von Abemaciclib mit HER2-gerichteten Substanzen, deren Aktivität erhöht wird.
Primärer Studienendpunkt war das progressionsfreie Überleben, das mit der Dreifachkombination aus Abemaciclib, Trastuzumab und Fulvestrant (Arm A) gegenüber der Standardtherapie (Arm C) signifikant verbessert wurde. Die Ansprechraten waren höher (33 % vs. 14 %), die Ansprechdauer länger.
Als Fazit wurde festgehalten, dass in dieser ersten Phase-II-Studie eines CDK4/6-Inhibitors in Kombination mit endokriner und HER2-gerichteter Therapie ein signifikant positives Ergebnis erzielt wurde.
KEYNOTE-522 zu Pembrolizumab beim triple-negativen Mammakarzinom: Beim triple-negativen Mammakarzinom (TNBC), dem Sorgenkind unter den Mammakarzinom-Subgruppen, mehren sich positive Daten zur Immuntherapie, aktuell mit dem Immun-Checkpoint-Inhibitor Pembrolizumab, mit dem in der KEYNOTE-522-Studie die Rate pathologischer Komplettremissionen signifikant gesteigert wurde.
Die KEYNOTE-522-Studie ist eine Phase-III-Studie mit Pembrolizumab plus Chemotherapie vs. Chemotherapie als neoadjuvante Therapie des TNBC gefolgt von Pembrolizumab-Monotherapie vs. Placebo im adjuvanten Setting. Neoadjuvante Chemotherapie ist Standard für TNBC-Risikopatientinnen. Jene Patientinnen, die einen pathologische Komplettremission (pCR) erreichen, haben eine gute Langzeitprognose, sodass dieser Endpunkt auch für eine beschleunigte Zulassung („accelerated approval“) akzeptiert ist. Daten zum ereignisfreien Überleben sind allerdings erforderlich und müssen nachgereicht werden.
Es wurden 4 Zyklen Pembrolizumab (+ Chemotherapie) neoadjuvant verabreicht und 9 Zyklen Pembrolizumab-Monotherapie nach dem chirurgischen Eingriff. 1.147 Patientinnen wurden 2:1 in die Studie randomisiert, das aktuelle Follow up beträgt median 15,3 Monate.
Primäre Endpunkte der Studie waren die pCR-Rate und das ereignisfreie Überleben.
In der aktuellen Auswertung konnte die pCR-Rate mit Pembrolizumab von 51,2 % (Kontrollarm) auf 64,8 % verbessert werden, was mit einem Unterschied von 13,6 Prozentpunkten signifikant besser war (p = 0,00055). Die Ansprechraten waren bei PD-L1-Expression höher, die Wirkung war aber unabhängig vom PD-L1Status. Das ereignisfreie Überleben war zum Zeitpunkt der Auswertung mit einer Hazard Ratio 0,63 zugunsten von Pembrolizumab verbessert, das Signifikanzniveau aber noch nicht erreicht.
Die geschätzte 18-Monate-EFS-Rate beträgt 91,3 % mit Pembrolizumab plus Chemotherapie vs. 85,3 % im Kontrollarm.
Fazit: Keynote-522 ist die erste prospektiv randomisierte Phase-III-Studie mit Pembrolizumab beim frühen triple-negativen Mammakarzinom im neoadjuvanten/adjuvanten Setting. Die Studie erzielte gegenüber neoadjuvanter Chemotherapie eine signifikante Verbesserung der pathologischen Komplettremissionsrate, das ereignisfreie Überleben ist im Trend bereits besser (HR 0,63).
BROCADE3 zum PARP-Inhibitor Veliparib bei BRCA1/-2-positiven Tumoren: Nach Olaparib wurde mit Veliparib ein weiterer PARP-Inhibitor vorgestellt, der in der Phase-III-Studie BROCADE3 in Kombination mit Chemotherapie ebenfalls signifikante Ergebnisse erzielte: mit einer Verringerung des Risikos der Tumorprogression und einer gegenüber Chemotherapie verlängerten Ansprechdauer.
CDK4/6-Inhibitoren – Standarderstlinientherapie in der klinischen Praxis
Wir können von einer wirklichen Etablierung der Substanzen sprechen. Besonders erfreulich ist die Tatsache, dass es sich um einen Klasseneffekt handelt. Wir haben drei Substanzen zur Verfügung, Palbociclib, Ribociclib sowie Abemaciclib, und können damit eine relevante Overall-Survival-Verbesserung in der Erst- und Zweitlinientherapie in Kombination mit verschiedenen antihormonellen Substanzen erreichen. Wir haben immer diskutiert, ob es sinnvoll ist, diese neuen Therapien „first line“ einzusetzen, oder ob wir sie für spätere Therapielinien aufbewahren sollen. Ich denke, der mehrfache Nachweis eines klinisch relevanten Überlebensvorteils hat die Frage beantwortet: die beste Kombination zuerst, alle Subgruppen profitieren vom möglichst frühzeitigen Einsatz der Substanzen in Kombination mit antihormoneller Therapie. Für mich handelt es sich nunmehr um eine evidenzbasierte neue Standardtherapie beim luminalen postmenopausalen Mammakarzinom. MONALEESA-7 hat prämenopausale Patientinnen inkludiert, die aber durch die ovarielle Funktionssuppression in die Postmenopause übergeführt werden und damit genauso behandelt werden können wie jene Patientinnen, die auf natürliche Weise bereits in der Postmenopause sind.