Berichte vom ASCO und aus San Antonio – BMI und endokrine Therapie des Mammakarzinoms
Übergewicht als Risiko- und Prognosefaktor
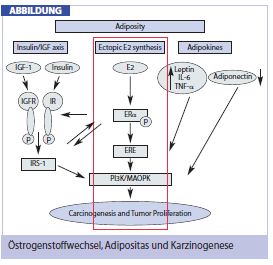
Adipositas ist als unabhängiger Risikofaktor für Brustkrebs etabliert. In den letzten Jahren konnte zunehmend gezeigt werden, dass ein erhöhter BMI nicht nur das Brustkrebsrisiko erhöht, sondern auch Einfluss auf die Prognose von Brustkrebspatientinnen nimmt. Adipositas beeinflusst die Entstehung und den Progress von Brustkrebs über verschiedene Signalkaskaden (Abb.). Unter anderem kommt es bei übergewichtigen Frauen auch zur vermehrten ektopen Östrogenproduktion, was vermuten lässt, dass der BMI auch Einfluss auf die Wirksamkeit der endokrinen Therapie nehmen könnte. Adipositas, definiert als pathologische Erhöhung der Körperfettmasse, ist heutzutage ein weltweites Gesundheitsproblem mit stetig steigender Prävalenz. Die WHO verwendet als Maß der Fettleibigkeit den Body Mass Index (BMI), der durch Gewicht/ Größe2 definiert ist und sich durch eine gute Übereinstimmung mit der Körperfettmasse auszeichnet. Ein BMI über 25 kg/m2 gilt bereits als Grad-1-Übergewicht, wobei sich der normale Bereich zwischen 18,5-24,9 kg/m2 befindet.
Parr et al. konnte in einer kürzlich im “Lancet Oncology” erschienenen Arbeit an knapp 424.500 Krebspatienten nachweisen, dass Übergewicht ganz klar die Krebsmortalität aller untersuchten Krebsarten außer Lunge und Kehlkopfkrebs erhöht. Für Brustkrebs konnten die Autoren ein relatives Risiko (RR) von 1,6 von Patientinnen mit einem BMI > 30 kg/m2 versus Normalgewichtigen nachweisen.
Eine im Jahr 2010 erschienene Metaanalyse von 43 qualitativ hochwertigen Studien ergab ein relatives Risiko in Bezug auf Brustkrebs-Mortalität von 1,3 bei Vergleich von übergewichtigen versus normalgewichtigen Patientinnen. Aber nicht nur die Mortalität, sondern auch das Rezidivrisiko – und hier vor allem das Risiko für Fernmetastasen – wird durch Adipositas beeinflusst.
Bilal Majed et al. vom Curie Institute, Paris, sind mit einem Kollektiv von 14.700 Brustkrebspatientinnen der Frage nachgegangen, ob Übergewicht ein unabhängiger prognostischer Faktor bei Brustkrebs ist und konnten zeigen, dass adipöse Patientinnen ein signifikant höheres Risiko für eine Rezidiv (RR 1,2) und vor allem für eine Fernmetastase (RR 1,3) aufweisen.
Übergewicht als prädiktiver Faktor
Aufgrund der eingangs erwähnten Tatsache, dass die Hauptproduktion von Östrogenen bei postmenopausalen Frauen über die Aromatase im Fettgewebe erfolgt und der mehrfach gezeigten Korrelation zwischen BMI und Serumöstrogenspiegel postmenopausaler Frauen, entstand die Hypothese, dass der BMI nicht nur prognostischen Wert, sondern bezogen auf die endokrine Therapie auch prädiktiven Wert aufweist.
Tamoxifen vs. Aromatasehemmer – differenzielle Überlegungen im Kontext der “Body Mass”: Tamoxifen ist wie der Aromatasehemmer eine so genannte “zielgerichtete Therapie” des Mammakarzinoms. Tamoxifen verhindert die Aktivierung der Östrogenrezeptoren durch Östrogene, hemmt so die Proliferation der Tumorzellen und fördert deren Apoptose. Tamoxifen wird zielgerichtet eingesetzt, nur jene Patientinnen erhalten diese Form der endokrinen Therapie, deren Tumor Hormonrezeptorpositiv ist. Das bedeutet, dass das Patientenkollektiv, welches eine Tamoxifenmedikation erhält, gemäß der Expression (dem Vorhandensein) des Targets, selektioniert wird.
Ganz im Gegenteil dazu wird der Aromatasehemmer nicht “zielgerichtet” eingesetzt. Ziel des Aromatasehemmers ist die Hemmung der Aromatase, welche vorwiegend im Fettgewebe der postmenopausalen Frau Androgen in Östrogene umwandelt. Die Folge ist, dass der Östrogenspiegel postmenopausaler Frauen unter Aromatasehemmer-Therapie auf ein Minimum abfällt und so der Östrogen-abhängigen Tumorzelle die Östrogene entzogen werden. Im Gegenteil zu Tamoxifen selektionieren wir unsere Patientinnen nicht gemäß dem Target des Aromatasehemmers, nämlich der Aromataseexpression, sondern wir selektionieren gemäß dem indirekten Ziel, nämlich dem Östrogenrezeptor. Es ist aber vollkommen unklar, ob Patientinnen mit hoher “Gesamtkörper-Aromataseaktivität” und folglich höheren Serum-Östrogenspiegel den gleichen Benefit von Aromatasehemmern erfahren wie Patientinnen mit niedriger “Gesamtkörper-Aromataseaktivität” und folglich niedrigen Serum-Östrogenspiegeln. Um den Aromatasehemmer zielgerichtet einzusetzen, müsste eigentlich die “Gesamtkörper-Aromataseaktivität” bestimmt werden und der Einsatz des Aromatasehemmers dementsprechend angepasst werden. Dies ist allerdings nicht praktikabel. Zum einen kann man der Patientin nicht zumuten, dass prätherapeutisch Biopsien aus dem Fettgewebe zur Bestimmung der Aromataseaktivität entnommen werden, zum anderen ist es ja vollkommen unklar, von welchem Fettgewebe man diese Biopsien nehmen sollte: dem viszeralen Fettgewebe, dem Brustfettgewebe, dem abdominellen Fettgewebe oder von allen diesen Kompartimenten. Es ist allerdings seit langem bekannt, dass mit zunehmendem BMI und damit zunehmender Fettmasse und Aromataseaktivität auch der Östrogenspiegel postmenopausaler Frauen steigt. Um die “Gesamtkörper- Aromataseaktivität” abzuschätzen, könnte man folglich den BMI als Surrogatparamter heranziehen.
Einfluss von Übergewicht: Studien in der Reanalyse
In einer Reanalyse der ABCSG-12-Studie, die am ASCO 2010 präsentiert wurde und nun im JCO publiziert wird, konnten wir nachweisen, dass übergewichtige, prämenopausale Patientinnen, die mit dem Aromatasehemmer (AI) Anastrozol (+ Goserelin) behandelt wurden, ein schlechteres krankheitsfreies Überleben (HR 1,49) und ein schlechteres Gesamtüberleben (HR 3,03) aufwiesen als übergewichtige Patientinnen, die mit Tamoxifen (+ Goserelin) behandelt wurden. Kein Unterschied konnte zwischen den beiden Therapieschemata in der Gruppe der normalgewichtigen Patienten nachgewiesen werden. Das bedeutet, dass gemäß unserer Daten übergewichtige prämenopausale Patientinnen mehr von der Kombination Tamoxifen + Goserelin als von der Kombination Anastrozol + Goserelin profitieren.
Reanalyse der ATAC-Studie: Ähnliche Daten wurden auch für die postmenopausale Situation von Sestak et al. publiziert. In einer Reanalyse der ATAC-Studie konnten die Autoren nachweisen, dass übergewichtige postmenopausale Patientinnen signifikant weniger von Anastrozol profitieren als normalgewichtige Patientinnen. Zudem konnte gezeigt werden, dass, bezogen auf Fernmetastasen, nur normalgewichtige Patientinnen vom Aromatasehemmer gegenüber Tamoxifen profitieren, während bei Übergewichtigen kein Unterschied zwischen beiden Therapieschemata festgestellt werden konnte.
Reanalysen der ABCSG-6- und ABCSG-6a-Studien: Zur weiteren Beurteilung des Einflusses von BMI auf die Effektivität der endokrinen Therapie postmenopausaler Frauen wurden Reanalysen der ABCSG-6- und ABCSG-6a-Studien durchgeführt und die Ergebnisse am SABCS 2010 präsentiert. In der ABCSG 6 wurden knapp über 2.000 postmenopausale Mammakarzinompatientinnen zu Tamoxifen versus Tamoxifen + Aminoglutethimid (1.-Generations-AI) randomisiert. In der Originalpublikation konnte kein Unterschied zwischen beiden Armen festgestellt werden. In unserer Reanalyse untersuchten wir, ob der BMI Einfluss auf die Effektivität dieser Therapien hat. Zwei Drittel aller postmenopausalen Mammakarzinompatientinnen waren übergewichtig, nur ein Drittel war normalgewichtig. Unsere Analyse der ABCSG-6-Studie zeigte, dass der BMI keinen Einfluss auf die Effektivität von Tamoxifen oder Tamoxifen + Aminoglutethimid nimmt. Ähnlich wie bei der Re-Analyse der ABCSG-12 konnten wir folglich zeigen, dass normalgewichtige und übergewichtige Brustkrebspatientinnen von Tamoxifen in gleichem Maße profitieren. In der ABCSG- 6a-Studie wurden rezidivfreie Patientinnen nach abgeschlossener endokriner Therapie durch 5 Jahre zu weiteren 3 Jahren Aromatasehemmer (Anastrozol) versus nihil randomisiert. In der Originalpublikation konnte gezeigt werden, dass Frauen mit zusätzlicher 3-jähriger Therapie mit Aromatasehemmer ein signifikant besseres krankheitsfreies Überleben aufwiesen. In unserer Reanalyse untersuchten wir, ob der BMI Einfluss auf dieses Ergebnis nimmt; zwei Drittel aller Patientinnen waren übergewichtig. In der Gruppe der Normalgewichtigen konnten wir zeigen, dass Patientinnen, die zusätzlich 3 Jahre endokrine Therapie mit Aromatasehemmer erhielten, ihr Risiko, ein Rezidiv zu erleiden oder an der Krankheit zu versterben, halbierten. Ganz im Gegenteil profitierten übergewichtige Frauen nicht von zusätzlichen 3 Jahren Aromatasehemmer nach 5 Jahren endokriner Therapie. In der Gruppe der übergewichtigen Frauen traten trotz zusätzlichen 3 Jahren endokriner Therapie mit Aromatasehemmer genauso viel Rezidive und Todesfälle auf wie ohne weitere Therapie.
Zusammenfassend kann gesagt werden, dass der BMI ein etablierter Risikofaktor des Mammakarzinoms ist, der auch die Prognose dieser Erkrankung beeinflusst. Ungefähr ein Drittel aller prämenopausalen Brustkrebspatientinnen und zwei Drittel aller postmenopausalen Brustkrebspatientinnen sind übergewichtig. Gemäß unseren eigenen Daten hat der BMI auch prädiktiven Wert bezogen auf die endokrine Therapie. Übergewichtige Brustkrebs-Patientinnen scheinen von einer endokrinen Therapie mit Aromatasehemmer weniger zu profitieren als normalgewichtige. Es scheint so, dass vor allem bei übergewichtigen Patientinnen Tamoxifen eine sehr effektive endokrine Therapie darstellt. Aufgrund unserer retrospektiven Daten lässt sich allerdings noch keine Änderung des Vorgehens für den klinischen Alltag ableiten. Allerdings ist zu überlegen, ob es nicht sinnvoll wäre, bei übergewichtigen Patientinnen, bei denen der Aromatasehemmer anscheinend nicht so wirksam ist, die Switch-Therapie (Tam gefolgt von AI) als endokrine Therapie einzusetzen, bei Normalgewichtigen hingegen “upfront” Aromatasehemmer. Dieses Vorgehen wäre konform mit den ASCO-Guidelines (2010).