Neue Wege im Brustkrebsscreening – Genexpressionsprofile im Dienste der Therapieindividualisierung
Jedes Jahr erkranken rund 1,3 Mio. Frauen in der EU an einem Mammakarzinom in unterschiedlichem Stadium. Ohne adjuvante medikamentöse Therapie würde ungefähr jede dritte Frau nach der Ersterkrankung ein Rezidiv erleiden und an ihrer Erkrankung versterben.
Welche Patientin nun ein höheres oder niedrigeres Rezidivrisiko hat, wurde bislang mittels klinisch-pathologischer Eigenschaften wie Alter, Tumorgröße, Grading oder Nodal- und Hormonrezeptorstatus bestimmt. Diese Einschätzungen waren jedoch oft ungenau und wir konnten das individuelle Risiko der einzelnen Patientin nicht genau vorhersagen. Einige prognostische und prädiktive Faktoren wie Hormonrezeptorstatus und HER2-Expression des Tumorgewebes werden routinemäßig bestimmt und haben bereits seit langem Einfluss auf die Behandlung. Eine weitere Möglichkeit ist die Verwendung von Nomogrammen wie dem so genannten Milan-Nomogramm (Colleoni et al., Eur J Cancer 2010), wobei Hormonrezeptoren und der Proliferationsmarker Ki-67 mit der geplanten Zahl der Zyklen einer neoadjuvanten Therapie kombiniert werden, um das Ansprechen auf diese vorhersagen zu können.
Multigen-Assays zur individuellen Risikoeinschätzung
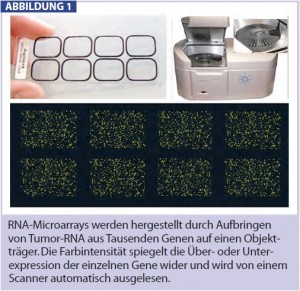
Durch den Einsatz neuer Techniken wie z. B. quantitative Real- Time-PCR oder RNA-Microarrays ist es in den letzten Jahren möglich geworden, molekulare Profile individueller Patientinnen zu erstellen und so die Über- oder Unterexpression Tausender tumorspezifischer Gene gleichzeitig in einem Experiment zu untersuchen (Abb. 1). Dabei wird RNA aus dem Tumor extrahiert und gemeinsam mit Referenz-RNA auf einen Objektträger aufgebracht. Die Farbintensität der fluoreszenzmarkierten RNA wird mit geeigneten Scannern ausgelesen und von einem Computerprogramm interpretiert. Bestimmte Gruppen von Genen können in so genannten Profilen von diesen Microarrays ausgelesen werden und erlauben so die Bestimmung z. B. der Prognose einer Mammakarzinompatientin.
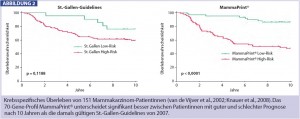
Bessere Prognosestratifizierung als klinische Parameter: Mehrere solcher Multigen-Assays wurden in den letzten Jahren entwickelt und sind kommerziell erhältlich, wie das 70-Gene- Profil MammaPrint® (Agendia) oder der 21-Gene-Recurrence- Score Oncotype® Dx (Genomic Health), welcher mittels RT-PCR die Aktivität von 16 tumorspezifischen und 5 Referenzgenen aus formalinfixiertem Gewebe bestimmt. Das 70-Gene-Profil wurde am Netherlands Cancer Institute in Amsterdam entwi – ckelt und in 3 unabhängigen retrospektiven Studien validiert. Es wird aus frischen oder gefrorenen Tumorproben bestimmt und erlaubt eine bessere Einteilung in Gruppen mit guter oder schlechter Prognose als klinische Guidelines, wie in Abb. 2 für 151 nodal negative Patientinnen dargestellt (Knauer et al., San Anonio 2009, Abstract 1084). Diese prognostische Einschätzung ist nicht nur unabhängig von und genauer als die bislang bestimmten Parameter, sondern auch in einem Drittel der Fälle diskordant zu der klassischen klinisch-pathologischen Risikoeinteilung. Dies hat dazu geführt, dass an vielen Institutionen diese Tests bereits im Rahmen von klinischen Studien oder auch außerhalb durchgeführt werden.
Warten auf Ergebnisse aus prospektiv-randomisierte Studien: Derzeit werden die beiden oben genannten Multigen- Assays in prospektiv-randomisierten Studien untersucht – das MammaPrint®-Profil in der europäischen MINDACT-Studie und der Oncotype®-Dx-Test in der TAILORx-Studie, die 6.000 bzw. 10.500 Patientinnen eingeschlossen haben, aber auf deren Ergebnisse wir noch mehrere Jahre warten müssen. Die St.- Gallen-Konsensuskonferenz, die alle 2 Jahre Diagnose- und Behandlungsstandards für das Mammakarzinom definiert, hat diesem Umstand 2009 Rechnung getragen und den Einsatz von validierten Multigen-Assays für die Entscheidungsfindung über adjuvante Chemotherapie empfohlen, wenn mit klinischpathologischen Parametern die Entscheidung nicht eindeutig gefällt werden kann.
Multigen-Assays und Ansprechen auf Chemotherapie
Um für die individuelle Patientin nützlich zu sein, müssen Multigen- Assays jedoch nicht nur die Prognose möglichst exakt definieren können, sondern sollten idealerweise auch in der Lage sein, das Ansprechen auf eine geplante Therapie im Sinne eines prädiktiven Markers vorherzusagen. In der Praxis ergeben sich dadurch mehrere Schwierigkeiten – einerseits können individuelle Unterschiede bei der Metabolisierung von Medikamenten eine Rolle spielen, wie z. B. genetische Varianten von Cytochromen, die bei der Tamoxifen-Metabolisierung involviert sind. Andererseits ist auch nicht klar, wie akkurat ein Prädiktor in der jeweiligen klinischen Situation sein soll, wenn z. B. keine Alternativtherapien zur Verfügung stehen oder Nebenwirkungen von Therapien im palliativen Setting zunehmend wichtiger werden.
In der neoadjuvanten Situation konnten bereits mehrere kleinere Studien zeigen, dass eine Vorhersage auf das Ansprechen für verschiedene Substanzen möglich ist, was sich durch eine hohe Rate an pathologischen Komplettremissionen (pCR) zeigt und im Allgemeinen gut mit dem Langzeitüberleben korreliert. Die für diesen Zweck entwickelten Profile sind jedoch zurzeit nicht kommerziell erhältlich, obwohl auch eine retrospektive Studie von Straver et al. an 167 Patientinnen den prädiktiven Wert des 70-Gene-Profils erstmals zeigen konnte: alle Patientinnen mit einer pCR (20 %) hatten ein Hochrisiko-Profil und nur diese Frauen profitierten von der Chemotherapie. Alle 17 Rezidive fanden sich in dieser Analyse in der Hochrisikogruppe. Bei keiner der Patientinnen mit Niedrigrisiko-Profil zeigte sich eine pCR und diese Frauen hatten in einer Zwischenanalyse nach 2 Jahren trotzdem ein rezidivfreies Überleben von 100 %.
In der adjuvanten Situation: Wenn man Genexpressionsprofile in der adjuvanten Situation verwenden möchte, sollten diese einerseits zeigen, dass bei einem Niedrigrisiko-Profil die Patientinnen nicht nur ein sehr gutes krebsspezifisches Überleben haben, sondern dass auch kein oder nur ein sehr geringer Benefit durch eine adjuvante Chemotherapie zu erwarten ist. Für diese Patientinnen könnte eine antihormonelle Behandlung die Therapie der Wahl darstellen. Demgegenüber sollte im Falle eines Hochrisiko-Profils ein signifikanter Vorteil durch die zusätzliche Chemotherapie zu erwarten sein. Dies wurde für Oncotype® Dx und auch für den MammaPrint®-Test bislang lediglich in großen retrospektiven Studien gezeigt und definitive Aussagen über die Wertigkeit dieser Multigen-Assays im klinischen Alltag können sicher erst nach Beendigung der prospektiv-randomisierten Studien getroffen werden. Trotzdem ist eine Prädiktion im eigentlichen Sinn, d. h. die Vorhersage des Ansprechens auf ein spezifisches Medikament, derzeit noch nicht möglich.
Erste klinische Erfahrungen in Österreich: Nichtsdestotrotz haben verschiedene Abteilungen begonnen, die zusätzliche prognostische und prädiktive Information für ihre Patientinnen zu nutzen – seit gut zwei Jahren konnten auch wir in Österreich die ersten klinischen Erfahrungen mit dem 70-Gene-Profil sammeln. Die logistische Umstellung stellt kein großes Prob – lem dar: die Entnahme von Tumorgewebe innerhalb einer Stunde nach Operation kann während der intraoperativen Schnittrandbeurteilung erfolgen und das Gewebe kann in RNA-konservierender Lösung bei Raumtemperatur bis zu 7 Tage vor Verarbeitung verbleiben.
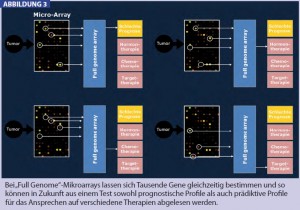
AUSBLICK: In naher Zukunft erwarten wir uns aber noch viel mehr von diesen neuen Technologien: nicht nur die Entwicklung von neuen Profilen aus Formalin-fixiertem Gewebe ist in Entwicklung; es können bereits jetzt auch aus einem so genannten „full genome array“ viele individuelle Profile ausgelesen werden, wie in Abb. 3 dargestellt. Wenn zum Beispiel das erste Profil eine Auskunft über die Prognose der Patientin gibt, könnte man aus demselben Array weitere prädiktive Profile für das Ansprechen auf Chemotherapie, antihormonelle oder Antikörper- Therapie ablesen. Auch neue Moleküle wie microRNA oder RNA aus nicht-kodierenden Sequenzen und Pseudogenen werden das Wissen um die molekularen Vorgänge in und um das Mammakarzinom in einigen Jahren deutlich erweitern. Doch auch wenn sich die Technik stetig weiter entwickelt, müssen wir uns bereits jetzt mit deren Möglichkeiten und Grenzen auseinandersetzen, um auch aus heutiger Sicht die besten Entscheidungen für unsere Patientinnen treffen zu können.
* nach einem Vortrag im Rahmen des Symposiums „Herausforderungen der modernen endokrinen Therapie“ der Österreichischen Gesellschaft für Senologie anlässlich der 31. Jahrestagung der Deutschen Gesellschaft für Senologie in Dresden (23.–25. Juni 2011)