Prognose und Prädiktion in der neoadjuvanten Therapie des Mammakarzinoms
Das Konzept der neoadjuvanten systemischen Therapie wurde beim Mammakarzinom bereits im Jahr 1973 zum ersten Mal angewendet. Damals war das primäre Ziel die Herstellung einer operablen Situation bei Patientinnen mit weit fortgeschrittenen Karzinomen. Heute wird für die neoadjuvante Chemotherapie ein breites Spektrum verschiedener Schemata eingesetzt: in aller Regel bestehen diese aus 6–8 Zyklen anthrazyklin- und taxanhältiger Kombinationen. Ein Standard wurde zum Beispiel durch die NSABP-B27-Studie mit über 2.400 Patientinnen durch die sequenzielle Gabe von Doxorubicin/Cyclophosphamid gefolgt von Docetaxel gesetzt (Bear H. D. et al., JCO 2006).
Ausgehend von der ursprünglichen Indikation beim inoperablen Mammakarzinom wurde bald dazu übergegangen, die neoadjuvante Behandlung zur Verbesserung der Brusterhaltungsrate einzusetzen, was heutzutage eine breit akzeptierte Standardindikation ist. Da in vielen Studien und auch Metaanalysen die neoadjuvante Therapie im Vergleich mit einer adjuvanten Therapie die gleichen Resultate in Bezug auf krankheitsfreies und Gesamtüberleben zeigte, kann dieselbe Therapie eigentlich allen Patientinnen präoperativ angeboten werden, wenn sie diese postoperativ sowieso brauchen würden. Darüber hinaus gibt es aber noch zwei wesentliche Gründe, warum die neoadjuvante Therapie eine so interessante und wichtige Behandlungsoption beim Mammakarzinom darstellt. Erstens kann in vielen Fällen die Langzeitprognose bereits zum Operationszeitpunkt relativ gut eingeschätzt werden und zweitens wünschen wir uns durch ein frühes Bestimmen des Ansprechens eine möglichst individuell angepasste medikamentöse Behandlung unserer Patientinnen, wovon wir derzeit aber noch etwas entfernt sind.
Neoadjuvante Therapie in den S3-Leitlinien: In den dieses Jahr neu überarbeiteten deutschen S3-Leitlinien wird die neoadjuvante Therapie als Standard beim inoperablen und beim inflammatorischen Mammakarzinom festgehalten. Der Effekt dieser Behandlungsoption ist am größten beim hormonrezeptornegativen Mammakarzinom. Als wichtige Punkte sind zu erwähnen, dass einerseits die chirurgische Resektion in den neuen Tumorgrenzen bei gutem Ansprechen auf die Behandlung ein sicheres Verfahren ist und dass eine Resektion des ursprünglichen, prätherapeutischen Tumorbettes nicht notwendig ist. Andererseits hat sich in den Studien der German Breast Group herausgestellt, dass vor allem beim HER2-positiven und beim triplenegativen Subtyp das Erreichen einer pathologischen Komplettremission (pCR) ein verlässlicher Surrogatparameter für eine gute Langzeitprognose ist, was eine zusätzliche Motivation für die Behandlung sein kann (von Minckwitz G. et al., Breast Cancer Res Treat 2011).
Histologische Diagnostik zur Planung der Behandlung und Vorhersage des Ansprechens: Eine Stanzbiopsie vor Therapiebeginn mit hochqualitativer histologischer Aufarbeitung gehört heute zum Standard eines zertifizierten Brustzentrums. Diese Biopsien geben Auskunft über den WHO-Tumortyp, das histologische Grading, den Hormonrezeptor- und HER2-Status sowie die Proliferation (Ki-67). Diese Informationen sind essenziell für die Planung der neoadjuvanten systemischen Therapie.
- Meistens wird ein lobulärer Typ des Mammakarzinoms generell mit schlechtem Ansprechen auf Chemotherapie assoziiert (Tubiana-Hulin M. et al., Ann Oncol 2006; Wenzel C. et al., Breast Cancer Res Treat 2007). In beiden dieser Arbeiten waren die pCR-Rate und die brusterhaltenden Operationen beim lobulären Karzinom signifikant geringer als beim duktalen Karzinom. In einer neuen niederländischen Arbeit bei 676 Patientinnen aus zwei prospektiven Studien bestätigte sich dies zwar in der univariaten Analyse für die pCR-Rate (pCR duktal 25 % vs. lobulär 11 %); nach der statistischen Korrektur für Hormonrezeptor- und HER2-Status in der multivariaten Analyse verschwand dieser Unterschied jedoch (Lips E. H. et al., Breast Cancer Res Treat 2012). Bei beiden Subtypen war im Falle eines rezeptorpositiven und HER2-negativen Tumors lediglich eine pCR-Rate von ca. 5 % zu beobachten, währenddessen beim rezeptornegativen oder HER2-positiven Karzinom die pCR-Rate in beiden Gruppen 25 % betrug. Die Autoren kamen zu der Ansicht, dass lobuläre Karzinome eine sehr heterogene Gruppe sind und dass der Unterschied im Ansprechen auf die neoadjuvante Behandlung unabhängig von der lobulären Histologie erklärbar ist durch die molekularen Eigenschaften des Tumors.
- Auch die Höhe der Expression des Östrogen- und Progesteronrezeptors kann zur Vorhersage des Ansprechens auf die neoadjuvante Therapie verwendet werden. Colleoni et al. konnten bei 553 Patientinnen zeigen, dass bei hochpositiven Rezeptoren die pCR-Rate signifikant geringer als bei ER/PR-negativen Tumoren war (0 % vs. 18 % pCR, Colleoni M. et al., Breast Cancer Res Treat 2009). Im ersten Fall sollte bei Wunsch einer neoadjuvanten Therapie eher eine neoadjuvante endokrine Therapie in Betracht gezogen werden, wie z. B. in Österreich zurzeit im endokrinen Arm der neoadjuvanten ABCSG-34-Studie, die in diesem Jahr sehr erfolgreich gestartet ist.
- Das HER2-positive Mammakarzinom ist jedoch derjenige Subtyp, der am meisten von einer präoperativen Therapie profitiert. Seit der ersten Studie mit dem Antikörper Trastuzumab mit 42 Patientinnen, die aufgrund der mehr als verdoppelten pCR-Rate von 67 % beim HER2-positiven Karzinom vorzeitig abgebrochen werden musste (Buzdar A. U. et al., JCO 2005), konnte auch die bereits zuvor erwähnte Metaanalyse der deutschen Studien von fast 6.400 Patientinnen zeigen, dass der Einsatz der Antikörpertherapie beim HER2-positiven Karzinom die Komplettremissionsrate mehr als verdreifachen konnte (OR 3,2, < 0,001). Demgegenüber war eine pCR beim Luminal-A- und Luminal-B-Karzinom (HER2+) nicht prädiktiv für eine sehr gute Langzeitprognose.
- Eine hohe Proliferation, die mit dem Marker Ki-67 gemessen wird, kann ebenfalls für die Prädiktion einer pCR zu Hilfe genommen werden, allerdings sind hohe pCR-Raten erst ab hohen Ki-67-Werten von > 30 % zu erwarten (Fasching P. A. et al., BMC Cancer 2011). Außerdem zeigt ein weiter bestehendes hohes Ki-67 im Operationspräparat nach Abschluss der Therapie eine signifikant schlechtere Prognose an. Eine weitere Hoffnung zur Verbesserung des Ansprechvorhersagens („response prediction“) liegt in der Kombination der oben erwähnten Routineparameter wie z. B. dem IHC4-Score bzw. dem PEPI-Score für die neoadjuvante endokrine Therapie (Ellis M. J. et al., JCO 2001; Cuzick J. et al., JCO 2011). Allerdings ist die Anzahl der Publikationen zu diesen Scores noch sehr gering und sie können deswegen nicht als alleinige Entscheidungsbasis in der Routine dienen.
AUSBLICK in die (nahe) Zukunft: Multigen-Signaturen wie das 70-Genprofil MammaPrint zum Beispiel konnten in kleineren prospektiven Studien auch wichtige neue Erkenntnisse liefern (Straver M. E. et al., Breast Cancer Res Treat 2009). Bei 167 Patientinnen mit Tumoren > 3 cm oder positiven Lymphknoten zeigten alle Fälle mit einer späteren pCR ein High-Risk-Profil. Diejenigen Tumoren mit Low-Risk-Profil waren erstens viel seltener als in den adjuvanten Studien und konnten zweitens nie eine pCR erreichen. Trotz fehlender pCR hatten diese Low-Risk-Patientinnen aber in der noch kurzen Nachbeobachtungszeit von zwei Jahren keine Rezidive und der prognostische Nutzen des Profils wurde auch im neoadjuvanten Setting bestätigt. Eine Prädiktion im eigentlichen Sinn, d. h. welche Patientin von welcher Substanz profitiert, ist aber mit den heutigen Profilen bislang leider nicht möglich.
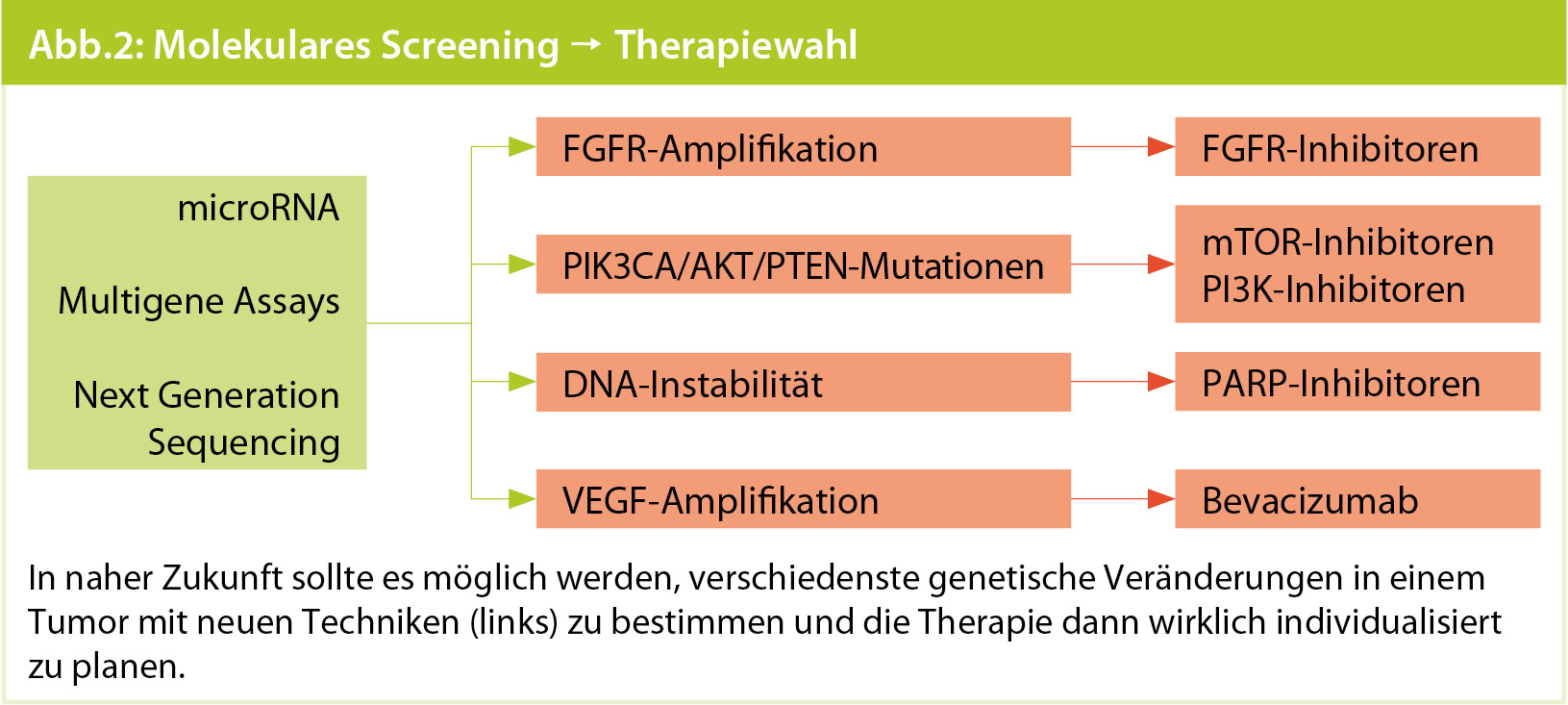
Eines der wichtigsten Ziele neoadjuvanter Studien in den nächsten Jahren wird sein, diejenigen Patientinnen möglichst frühzeitig zu erkennen, die entweder besonders gut oder besonders schlecht auf eine bestimmte Substanz ansprechen, um dann eine Therapieanpassung untersuchen zu können. Aktuell wir
das vor allem mit bildgebender Diagnostik versucht – vor allem die Sonografie und die MR-Mammografie werden in der Mitte der präoperativen Therapie verwendet. Das Ziel sollte aber sein, bereits nach dem ersten oder zweiten Zyklus die (Non-)Responder zu erkennen, sei es mit Bildgebung (z. B. PET-CT/MRT) oder neuen Techniken an seriellen Re-Biopsien oder im Serum (Genexpressionstests, „next generation sequencing“ oder microRNA). Das Erstellen von „Fingerabdrücken eines Tumors“ mit Evaluation von vielen genetischen Veränderungen aus einem einzigen Test könnte helfen, den Patientinnen eine wirklich individualisierte Therapie zukommen zu lassen, wie z. B. PI3K-Inhibitoren bei PI3K-Mutationen oder PARP-Inhibitoren bei BRCA-assoziierten Veränderungen. Allerdings werden die Subgruppen und Studienpopulationen in einem Zentrum oder auch einem Land dann immer kleiner und es kann nur durch internationale Kollaborationen verschiedener Gruppen zur ausreichenden Rekrutierung in diesen Studien kommen.