Teil II: Herz-Kreislauf-Risiko – Allgemeine und therapeutische Aspekte des kardiovaskulären Risikos der Frau
Kardiovaskuläre Risikofaktoren
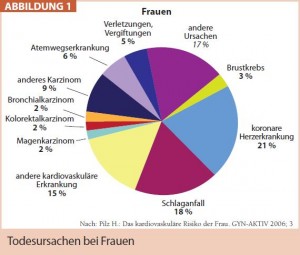
In Europa sterben 54 % der Frauen und 43 % der Männer an kardiovaskulären Ereignissen. Bei Frauen tragen die KHK-Mortalität 21 %, der Schlaganfall 18 % und andere kardiovaskuläre Erkrankungen 15 % zur Gesamtmortalität bei, bei Männern liegen die entsprechenden Prozentanteile bei 21 %, 11 % und 11 % (Abb. 1).
Bei Frauen in jedem Lebensalter ist die ischämische Herzerkrankung die häufigste Todesursache. Aufgrund der oben angeführten Fakten können also kardiovaskuläre Ereignisse nicht länger als überwiegend männliches Krankheitsbild bezeichnet werden. Prinzipiell werden nicht-modifizierbare Risikofaktoren von modifizierbaren unterschieden, zu letzteren zählt man die traditionellen Faktoren Hypertonie, Dyslipidämie, Rauchen, Übergewicht und Diabetes, zu diesen werden laufend weitere wie die Entzündungsparameter CRP, hs-CRP, Interleukin 6 und Fibrinogen, aber auch Autoimmunerkrankungen oder ein niedriger Hb-Gehalt erkannt und erforscht.
Nicht beeinflussbare Risikofaktoren der kardiovaskulären Morbidität und Mortalität sind Alter, Geschlecht und Familienanamnese, wobei besonders Alter und weibliches Geschlecht über eine hormonelle Achse interagieren, die das kardiovaskuläre Risiko der Frau im Vergleich zum Mann um ca. 10 Jahre postponiert. Eine positive Familienanamnese – entsprechend einer kardiovaskulären Erkrankung bei einem männlichen Verwandten ersten Grades vor dem 55., einer weiblichen Verwandten ersten Grades vor dem 65. Lebensjahr, trägt bei Männern mit einer altersadjustierten OR von 2,6 (95%-KI 1,7–4,1), bei Frauen von 2,3 (95%-KI 1,3–4,3) signifikant zum kardiovaskulären Risiko bei.
Kardiovaskuläres Risiko – Genderaspekte
Im Rahmen des Monitoringprogramms ORISCAV-LUX – Observation of Cardiovascular Risk Factors in Luxembourg – zur Erfassung des kardiovaskulären Risikoprofils bei gesunden 18- bis 69-jährigen Einwohnern Luxemburgs wurden relevante Daten von 1.432 Personen (697 Männer, 735 Frauen) laborchemisch und mittels Fragebogen erhoben. Die höchste Prävalenz als Risikofaktor (ohne Altersberücksichtigung) zeigten Lipidstoffwechselstörungen (69,9 %), gefolgt von Hypertonie (34,5 %), Diabetes mellitus (4,4 %), Rauchen (22,3 %) und Adipositas (20,9 %). Mit zunehmendem Lebensalter traten diese Risikofaktoren – außer Rauchen, dessen Frequenz deutlich abnahm – signifikant häufiger auf.
Genderunterschiede zeigte dieses Kollektiv (altersmäßig eingeschränkt auf 19–69 Jahre!) mit signifikant häufigerem Auftreten von Adipositas, Hypertonie, Lipidstoffwechselstörungen und metabolischem Syndrom bei Männern, für Diabetes waren die Unterschiede nicht signifikant. Allerdings zeigte eine nach Altersdekaden aufgeschlüsselte Bewertung des Risikofaktorenprofils wie zu erwarten ein Überwiegen von Lipidstoffwechselstörungen und Adipositas in der Gruppe der 60–69-jährigen Frauen.
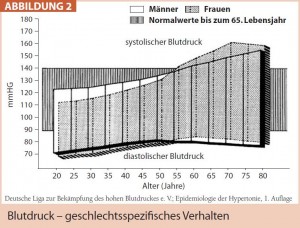
Die im Rahmen der WISE-Studie (Women’s Ischemia Syndrome Evaluation) erhobene Daten verdeutlichen ebenfalls den Einfluss des Alters und damit auch des Hormonstatus auf das Risikoprofil: etwa ab dem 50. Lebensjahr steigt bei Frauen häufig der systolische Blutdruck deutlich stärker als bei Männern an, sodass ab dem 55. Lebensjahr mehr Frauen als Männer von Hochdruck betroffen sind (Abb. 2). Ebenso steigen postmenopausal der Gesamt- und LDL-Cholesterinspiegel an, von Lipidstoffwechselstörungen sind nun ebenfalls häufiger Frauen als Männer betroffen. Laut WHO ist Übergewicht (BMI > 25) bei beiden Geschlechtern in gleicher Frequenz festzustellen, Adipositas (BMI > 30) öfter bei Frauen. Der altersabhängige Anstieg des BMI korreliert bei Frauen mit dem vermehrten Auftreten der abdominellen Adipositas, mitverursacht durch den Rückgang der Östrogenproduktion. Auch der Risikofaktor Diabetes zeigt genderspezifische Eigenheiten, so steigt bei diabetischer Stoffwechsellage das an sich niedrigere KHK-Risiko der prämenopausalen Frau auf das Risikoniveau des altersgleichen Mannes an. Darüber hinaus ist die kardiovaskuläre Mortalität der diabetischen vs. der nicht-diabetischen Frau um 3- bis 7-Fache erhöht, Männer erfahren im Rahmen eines Diabetes nur einen 2- bis 4-fachen Anstieg.
Durch verstärkten Östrogenabbau mit konsekutiv reduzierter NO-Synthese, daraus resultierender Zunahme von oxidativem Stress und der endothelialen Dysfunktion beeinflusst Nikotin – abusus das kardiovaskuläre Risiko der Frau stärker als das des Mannes.
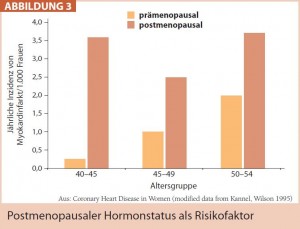
Ob nun der postmenopausale Hormonstatus per se als Risikofaktor bezeichnet werden kann, lässt sich diskutieren. Es steht jedoch fest, dass das kardiovaskuläre Risiko der Frau bei Östrogenabfall – welcher Genese auch immer – meist signifikant ansteigt (Abb. 3). Zurückzuführen ist dies einerseits auf den nun reduzierten positiven Östrogeneffekt auf Glukose- und Lipidstoffwechsel und die oft daraus resultierenden Faktoren Diabetes, Adipositas und Hypertonie, andererseits auf die bereits angesprochenen proatherosklerotischen Veränderungen wie die endotheliale Dysfunktion unter Östrogenmangel.
Zur Stratifizierung des kardiovaskulären Risikos sind bei der Frau ebenso wie beim Mann zumindest Anamnese, laborchemische Blut- und Harnuntersuchung, RR-Messung und EKG durchzuführen. Die Ergometrie zur Erfassung belas – tungsabhängiger myokardialer Ischämien zeigt bei der Frau im Vergleich zum Mann sowohl eine niedrigere Sensitivität als auch Spezifität. Dies ist auf die bei Frauen häufiger anzutreffenden 1-Gefäß-Erkrankungen und den Östrogeneffekt auf das Verhalten der ST-Strecke zurückzuführen.
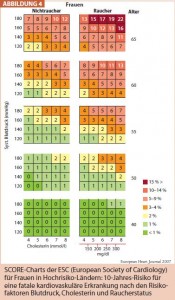
Die graduelle Erfassung des kardiovaskulären Mortalitätsrisikos erfolgt heute mittels der SCORE-Charts, wobei für Österreich der High Risk Chart anzuwenden ist (Abb. 4). Diese Mortalitäts- SCORE-Charts lösen die bisher verwendeten Framingham- Morbiditäts-Charts ab.
Derzeit noch wenig Beachtung findet die geschlechtsspezifisch unterschiedliche, bei Frauen oft atypische Symptomatik insbesondere akuter kardialer Ereignisse, wodurch bei Frauen bis zu 50 %, bei Männern bis zu 30 % der Infarkte unerkannt bleiben.
Therapie kardiovaskulärer Risikofaktoren
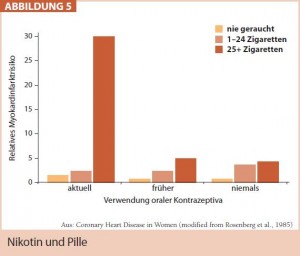
Prinzipiell steht geschlechtsunabhängig zur Reduktion des kardiovaskulären Risikos die Lifestyle-Modifikation an erster Stelle. Von besonderer Relevanz erweist sich die Nikotinkarenz bei gleichzeitiger Einnahme oraler Kontrazeptiva (Abb. 5). Da – rüber hinaus ist bei hypertensiven postmenopausalen Frauen aufgrund deren oftmals erhöhter Salzsensibilität eine Kochsalzreduktion angezeigt.
Hypertonie als kardiovaskulärer Risikofaktor manifestiert sich besonders bei Frauen etwa ab dem 55. Lebensjahr (Abb. 2), meist als isolierte systolische Hypertonie (systolischer RR > 140, diastolischer RR < 90 mmHg). Basierend auf bereits morphologisch veränderten Gefäßwänden mit Zersplitterung der elastischen, Zunahme der kollagenen Fasern und erhöhter „arterial stiffness“ im Bereich der zentralen Gefäße hat dieses Blutdruckverhalten eine besonders ungünstige Prognose.
Entsprechend dem Reappraisal of Guidelines on Hypertension Management 2009 ist auch für Frauen jede Substanz aus den zur antihypertensiven First-Line-Therapie geeigneten 5 Gruppen – Thiazid-Diuretika, Ca-Antagonisten, ACE-Hemmer, AT1-Blo cker und _-Blocker – geeignet, allerdings unter Berücksichtigung zusätzlicher Kontraindikationen wie Schwangerschaft und Laktation sowie pharmakokinetischer und -dynamischer geschlechtsspezifischer Besonderheiten. Insgesamt zeigen Frauen häufiger Nebenwirkungen wie ACE-Hemmer-Husten oder auch erhöhte Bradykardie-Gefährdung unter Betablockern und periphere Ödeme unter Ca-Antagonis ten. Aufgrund der wie bereits erwähnt oft erhöhten Kochsalzsensitivität postmenopausaler Frauen sprechen diese auf Diuretika gut an, die ebenso wie Ca- Antagonisten einen positiven Einfluss auf eine erhöhte „arterial stiffness“ bei ISH haben.
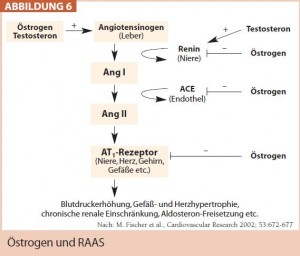
Eine Aktivierung des RAAS mit Anstieg der ACE-Konzentration und gesteigerter Expression der AT1-Rezeptoren unter Östrogenmangel wird als pathophysiologischer Mechanismus der postmenopausalen Hypertonie postuliert (Abb. 6), woraus sich ein sinnvoller Einsatz der RAAS-Blocker – ACE-Hemmer und A1-Blocker – ableiten lässt. AT1-Blocker sollen, wie sich in einer Studie mit Candesartan vs. Enalapril nachweisen ließ, ein teilweise besseres Ansprechen als ACE-Hemmer bei hypertensiven Frauen zeigen.
In einer rezenten Metaanalyse der Blood Pressure Lowering Treatment Trialists’ Collaboration ließen sich allerdings keine geschlechtsspezifischen Unterschiede hinsichtlich RR-Senkung und Outcome unter Verwendung unterschiedlicher Antihypertensiva nachweisen.
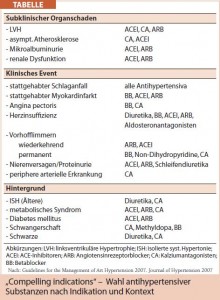
Prinzipiell sollten bei der Wahl antihypertensiver Substanzen immer kardiovaskuläre Risikofaktoren, subklinische Endorganschäden, klinisch manifeste Begleiterkrankungen und individuelle Situationen wie Alter, Ethnie, Schwangerschaft etc. berücksichtigt werden (Tab.). Auch der oft schon im ersten Therapieschritt – wenn der RR mehr als 20/10 mmHg über dem Zielwert liegt – indizierte Einsatz einer Kombinationstherapie sollte in Erwägung gezogen werden.
Lipidstoffwechselstörungen manifestieren sich postmenopausal häufig innerhalb weniger Monate als Anstieg von Gesamt- und LDL-Cholesterin, v. a. da es unter Östrogenmangel zur Downregulation hepatischer LDL-Rezeptoren mit entsprechend reduzierter LDL-„Clearance“ kommt. Östrogen als antioxidativ wirkendes Agens kann bei entsprechendem Konz entrationsabfall das LDL nicht vor Oxidation bewahren, wobei aber insbesondere dieses Oxi-LDL zur massiven Progression der Atherosklerose beiträgt. Unter Östrogenmangel sinkt auch die zelluläre Triglyzeridaufnahme mit entsprechendem Anstieg im Plasma. Die NCEP-ATP-III-Richtlinien sind bezüglich der Lipid-Zielwerte und der Indikation hinsichtlich Statintherapieeinsatz geschlechtsneutral, wobei der positive Effekt einer Statintherapie auf das kardiovaskuläre Risiko in Studien sowohl für Männer wie Frauen in Studien belegt ist. In der JUPITER- Studie ließ sich ein positiver primärpräventiver Effekt auch für Frauen nachweisen.
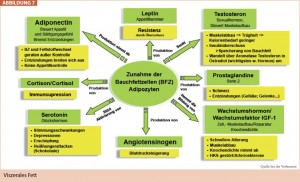
Glukosestoffwechselstörungen zeigen mit zunehmendem Lebensalter bei Frauen einen deutlicheren Prävalenz anstieg als bei Männern. Postmenopausal trägt das Östrogendefizit – Östrogenrezeptor-α-Aktivierung führt über eine GLUT-4- Gen expression zu gesteigerter muskulärer Glukoseaufnahme – be ziehungsweise der relative Testosteronanstieg zu einer peripheren Insulinresistenz bei. Darüber hinaus ist auch das postmenopausal zunehmend androide Fettverteilungsmuster mit viszeraler Adipositas am Anstieg des kardiovaskulären Risikos der Frau beteiligt, da Adipozyten im viszeralen Bereich im Vergleich zum subkutanen Fettgewebe eine geringere Insulinsensitivität sowie eine vermehrte Freisetzung freier Fettsäuren zeigen; außerdem sind sie für die Ausschüttung eines kardiometabolisch ungünstigen Adipokinprofils verantwortlich (Abb: 7). Zur Diabetestherapie der Frau gibt es keine genderspezifischen Richtlinien. Auffallend ist jedoch, dass Frauen, wie in mehreren Studien gezeigt, seltener als Männer ihre Blutzucker- Zielwerte erreichen. Blutdruck- und Lipidzielwerte werden ebenfalls wohl auch aufgrund einer geringeren Verschreibungsrate an RAAS-Hemmern und Statinen von Frauen seltener erreicht.
NACHSATZ: Der Einfluss einer HRT auf das kardiovaskuläre Risiko wurde in diese Übersicht wegen seiner Komplexität bewusst nicht mit einbezogen, dieser umfassende Themenbereich würde hier den Rahmen sprengen. Die zahlreichen noch offenen genderspezifischen Fragen bezüglich kardiovaskulärer Morbidität und Mortalität bedürfen weiterer Studien.