Chronische Niereninsuffizienz und HDL-Cholesterin
Die kardiovaskuläre Morbidität und Mortalität von Patienten mit chronischer Niereninsuffizienz ist deutlich erhöht, wobei als mögliche Ursachen neben einer Reihe von Kandidaten, vor allem chronisch entzündliche sowie prooxidative Vorgänge angeschuldigt werden. Die fehlgeleitete chronische Inflammation, wie sie regelhaft bei terminal niereninsuffizienten Patienten beobachtet wird, ist in ihrer Entstehung jedoch noch vollkommen unklar.
HDL-C-Dysregulation bei Urämie
Attraktiv erscheint die Hypothese, dass es im Rahmen der Urämie zu einem Verlust von antiinflammatorischen Molekülen oder deren Funktion kommt. Einer dieser Mediatoren könnte nach Arbeiten der letzten Jahre HDL-Cholesterin (HDL-C) sein. Bei Niereninsuffizienz kommt es zu einer typischen Dyslipidämie, welche vor allem durch eine Dysregulation der HDL-C-Synthese und Aktivität mit niedrigen HDL-C-Plasmakonzentrationen charakterisiert ist. Von HDL-C weiß man, dass es günstige atheroprotektive Eigenschaften besitzt, welche durch den so genannten reversen Cholesteroltransport (RCT), seine antioxidative sowie eben auch seine anti-inflammatorische Potenz erklärt werden können (Säemann M et al., Eur J Clin Invest 2010). So konnten Kalantar-Zadeh und Mitarbeiter zeigen, dass bei urämischen Patienten der Verlust der antiinflammatorischen Eigenschaften von HDL-C mit einer deutlich erhöhten Mortalität einhergeht (Kalantar-Zadeh K et al., Kidney Int 2007). Darüber hinaus zeigte sich, dass oxidierte Plasmaproteine in der Urämie mit dem HDL-C-Stoffwechsel interferieren und so die Zusammensetzung von HDL-C beeinflussen können (Marsche G et al., Circ Res 2009). Jedoch war bislang weder die Funktionalität von HDL-C noch sein molekularer Aufbau bei Urämie bekannt. Interessanterweise sind gerade zwei Arbeiten aus Österreich zu diesem Thema erscheinen. In beiden wurde mit modernster Technologie, nämlich der Massenspektromie, Neues zur Komposition von urämischem HDL-C entdeckt. Beide Arbeiten ergänzen sich in ihrer funktionellen Analyse, indem zum einen der RCT (Marsche G et al., J Am Soc Nephrol, 2011), zum anderen die antiinflammatorische Potenz von urämischem HDL-C analysiert wurden (Weichhart T, J Am Soc Nephrol, 2012).
Krankheitsspezifische Proteinsignatur
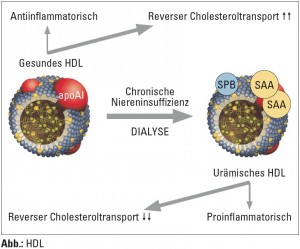
In einer Meilensteinarbeit konnten Vaisar und Mitarbeiter mit Hilfe einer so genannten Proteomanalyse mittels Massenspektrometrie beweisen, dass HDL-C bei Patienten mit stabiler koronarer Herzerkrankung (KHK) einen stark unterschiedlichen Satz an Proteinen im Vergleich zu gesunden Probanden aufwies, wobei etwa die Hälfte der HDL-C-assoziierten Proteine mit akuter Phasereaktion sowie auch unspezifischer Immunität verknüpft war (Vaisar T, J Clin Invest 2007). In ihrer explorativen Analyse konnten nun Marsche und Mitarbeiter bei Hämodialysepatienten (HD-Patienten) zeigen, dass urämisches HDL-C eine einzigartige Protein- und auch Lipidzusammensetzung hat. In urämischem HDL-C fanden sich deutlich vermehrt Serum-Amyloid-A (SAA) wie auch beispielsweise ApoC-III und Albumin. Interessanterweise war der RCT bei HD-Patienten signifikant reduziert und mit einer Reihe qualitativer Veränderungen im HDL-C assoziiert, wie einer deutlichen Depletion von Phospholipiden versus erhöhten Triglyzeriden und auch stark reduziertem ApoA-I/-II. Gerade der Phospholipidmangel dürfte für den defekten RCT verantwortlich sein. Zudem wurden stark erhöhte Mengen an LpA2 gefunden, welches seinerseits einen neuen vielversprechenden Risikofaktor für Atherosklerose darstellen und als Trägermolekül in urämischem HDL-C auch proatherosklerotische Effekte vermitteln könnte (Marsche G et al., J Am Soc Nephrol 2011).
Verringerte antiinflammatorische Funktion von HDL-C bei Urämie
In unserer Arbeit testeten wir im ersten Schritt die antiinflammatorische Funktion von HDL und fanden, dass physiologisches HDL-C eine äußerst starke anti-inflammatorische Wirkung entfaltet, wenn Makrophagen und dendritische Zellen mit verschiedensten Aktivierungsstimuli wie v. a. bakteriellen Reizen versetzt wurde. Urämisches HDL-C hatte in der Regel diese Wirkung nicht, bzw. wirkte sogar umso mehr proinflammatorisch (Weichhart T, J Am Soc Nephrol, 2012). Eine anschließende Proteomanalyse ergab, dass viele Proteine – insgesamt 67 – in urämischem HDL-C angereichert waren, wie SAA, ApoC-II, AMBP, Transferrin, PEDF und vor allem Surfactant-Protein B (SPB). 17 dieser Proteine waren„neue“, also urämiespezifische Proteine. Darüber hinaus konnten wir SP-B, SAA und PEDF entweder de novo oder deutlich erhöht auch im HDL-C von Patienten in den CKD-Stadien 3 und 4 detektieren, was diese Proteine als ideale Biomarkerkandidaten erscheinen lässt (Weichhart T, J Am Soc Nephrol 2012).
 In Einklang mit rezenten Daten, die darauf hinweisen, dass verschiedene chronische und in aller Regel entzündliche Erkrankungen wie die rheumatoide Arthritis oder Diabetes mellitus über eine eigene individuelle Proteinsignatur verfügen, kann mit diesen Befunden nun auch die chronische Niereninsuffizienz zu den chronisch entzündlichen Erkrankungen mit einem eigenen typischen HDL-C-Profil eingeordnet werden. Die weitestgehend individuelle HDL-C-Proteinsignatur beispielsweise von KHK-Patienten unterstützt die Idee eines „krankheitsspezifischen Proteoms“.
In Einklang mit rezenten Daten, die darauf hinweisen, dass verschiedene chronische und in aller Regel entzündliche Erkrankungen wie die rheumatoide Arthritis oder Diabetes mellitus über eine eigene individuelle Proteinsignatur verfügen, kann mit diesen Befunden nun auch die chronische Niereninsuffizienz zu den chronisch entzündlichen Erkrankungen mit einem eigenen typischen HDL-C-Profil eingeordnet werden. Die weitestgehend individuelle HDL-C-Proteinsignatur beispielsweise von KHK-Patienten unterstützt die Idee eines „krankheitsspezifischen Proteoms“.
Akutphaseparameter in urämischem HDL-C erhöht
In beiden Arbeiten war SAA in urämischem HDL-C deutlich erhöht. Die physiologische Bedeutung dieses Akutphaseparameters ist zwar nicht bekannt, aber man weiß mittlerweile, dass apoA1 gegen SAA ersetzt werden kann, da > 95 % von SAA nicht als freies, sondern HDLC- assoziiert existieren. Funktionell konnte in unserer Arbeit gezeigt werden, dass der Einbau von SAA, nicht aber eines der anderen verstärkt im HDL-C vorliegenden Proteine zu einer starken proinflammatorischen Reaktion führt und die Konzentrationen von SAA im urämischen HDL-C mit dem Verlust der zytokinhemmenden Fähigkeit von urämischem HDL-C korrelierten. Vielleicht tragen die gegenwärtigen Befunde zu einem besseren Verständnis der Rolle von HDL-C bei Urämie und des Gesamtkomplexes der chronischen Entzündung bei Niereninsuffizienz bei. Zudem konnte rezent auch gezeigt werden, dass SAA selektiv und im hohen Maße zwar nicht im HDL-C von Patienten mit stabiler KHK zu finden ist, jedoch bei Patienten mit akutem Koronarsyndrom deutlich vermehrt vorkommt (Alwaili K et al., Biochim Biophys Acta 2011).
Keine verstärkte Oxidation bei Urämie
Zur großen Überraschung wurde selbst mit Hilfe sensitivster Methoden keine verstärkte Oxidation oder Oxidationsbereitschaft von urämischem HDL-C nachgewiesen. Somit konnte ein in der Nephrologie zwar einleuchtendes, aber vielleicht zu simples Konzept nicht bestätigt werden. Offenbar sind andere, noch zu definierende molekulare Veränderungen für die funktionellen Änderungen von HDL-C im Rahmen der chronischen Niereninsuffizienz verantwortlich.
Diese bei urämischen Patienten gewonnenen Daten könnten dazu beitragen, die grundlegenden physiologischen Funktionen von HDL-C besser zu verstehen. Es ist davon auszugehen, dass HDL-C unter physiologischen Bedingungen ein potenter Negativregulator systemisch entzündlicher Prozesse ist. Das Verschwinden von HDL-C im Rahmen einer Sepsis unterstützt diese Sichtweise, umgekehrt könnte der Verlust seiner antiinflammatorischen Fähigkeiten zu chronisch inflammatorischen Zustandsbildern, wie sie eben bei der ausgeprägten Niereninsuffizienz existieren, beitragen.
Das einheitliche Auftauchen verschiedener Proteine im HDL-C wie SAA, ApoC-II, AMBP, Transferrin, PEDF und vor allem SPB, könnte schon in den Niereninsuffizienzstadien 3 und 4 von Bedeutung sein. Die starke Anreicherung von Surfactant-B in urämischem HDL-C beispielsweise könnte insofern interessant sein, als dieses Protein selektiv in der Lunge produziert wird und bei Zuständen der Überwässerung, etwa bei Patienten mit Kardiomyopathie in den NYHA-Stadien 3 und 4, systemisch auch deutlich erhöht ist. Wieso aber urämisches HDL-C hochselektiv anreichert, ist bislang vollkommen unklar. Möglicherweise sind diese Proteine sinnvolle Biomarker für eine ungünstige Prognose der Niereninsuffizienz. In den vergangenen Monaten wurden nahezu identische Datensätze auch mittels Proteomanalyse über dysfunktionelles HDL-C von Patienten mit rheumatoider Arthritis publiziert (Reddy ST et al., Arthritis Rheumatism 2012). Vielleicht lässt sich mit einfachen Analysemethoden wie z. B. ELISA-basierten Techniken anhand des Nachweises eines Sets geeigneter Biomarkerkandidaten direkt aus dem Serum ein gemeinsames „HDL-C-Charakteristikum“ realisieren.
Diese Studien machen klar, dass künftig die Bestimmung der HDL-C-Qualität und Funktionalität im Gesamtkontext von hohem Interesse sein wird.























































































