Update HIV
Im Falle einer produktiven Infektion werden HIV-Transkripte wieder aus dem Zellkern exportiert, gp120/gp41 wird in die Zellmembran der Wirtszelle eingeschleust, virale RNA und Glykoproteine lagern sich an, Virus formiert sich und wird durch Abschnürung der Membran von der Zelle freigesetzt (virus budding). Die virale Maturation erfolgt durch Spaltung von viralen Precursor-Polypeptiden durch die virale Protease. Die HIV-Protease zählt mit der RT und der Integrase zu den Schlüsselenzymen der viralen Replikation und diese stellen aktuell die wichtigsten Zielstrukturen einer antiretrovirale Therapie (ART) dar.
HIV – eine Zoonose!
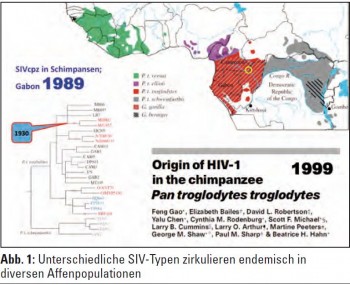
Die starken genetischen Gemeinsamkeiten der HI-Viren mit den sogenannten Simian Immunodeficiency Viruses (SIV) lieferten die Grundlage der Erkenntnis, dass sowohl HIV-1 als auch HIV-2 von Affen auf den Menschen übertragen wurden. Unterschiedliche SIV-Typen zirkulieren endemisch in diversen Affenpopulationen. HIV-1 dürfte von entsprechenden SIV-Varianten bei Schimpansen bzw. bei Gorillas abstammen und HIV-2 von SIV bei Mangaben (Abb. 1). Die Übertragung auf den Menschen erfolgte zu verschiedenen Zeiten im Rahmen mehrerer Gelegenheiten, wobei dies die Grundlage zur Entstehung der verschiedenen Gruppen (M, N, O) und Subtypen von HIV-1war. Als Infektionsweg werden der Verzehr von infizierten Affen bzw. Verletzungen bei deren Verarbeitung angenommen. Buschfleisch, also Fleisch wildlebender Tiere, ist in vielen Gegenden Afrikas eine der Hauptnahrungsquellen.
Die älteste bekannt HIV-positive Blutprobe datiert in das Jahr 1959 und stammt aus Kinshasa im ehemaligen Belgisch-Kongo. Biomathematische Modelle basierend auf Sequenzanalysen und der genetischen Distanz von frühen HIV-Varianten lassen dar- auf schließen, dass die ersten Übertragungen von SIV auf den Menschen im Zeitraum zwischen 1910 und 1940 erfolgten. Es ist anzunehmen, dass HIV im letzten Jahrhundert viele Jahre lang endemisch auf bestimmte Gebiete in Afrika beschränkt war. Erst mit der Modernisierung der Verkehrsinfrastruktur und dem vermehrten Flugverkehr breitete sich die HIV-Infektion in den 1970er- und 1980er-Jahren über Haiti und die USA auf alle Länder der Welt aus.
Vor beinahe 30 Jahren wurde Aids als eigenständige Erkrankung erkannt, 3 Jahre später wurde von französischen und amerikani- schen Forschern HIV als Ursache von Aids identifiziert. Nach einem jahrelangen Rechtsstreit zwischen den beiden Gruppen wurde den Franzosen Luc Montagnier und Françoise Barré- Sinoussi im Jahr 2008 gemeinsam der Nobelpreis für Medizin für die Entdeckung des HI-Virus zuerkannt.
HIV–Epidemiologie
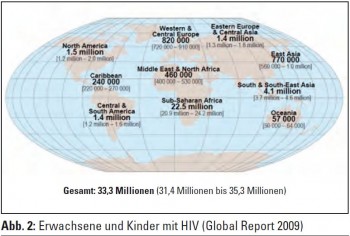
Situation international: Der Global Report 2009 von UNAids berichtet von weltweit 33,4 Millionen HIV-infizierten Menschen, zwei Drittel davon leben in Subsahara-Afrika (Abb. 2). In diesen Ländern beträgt die Prävalenz in der adulten Bevölkerung (15–49 Jahre) etwa 5%. 1,3 Millionen Menschen starben in diesen Ländern aufgrund von Aids. Im Jahr 2009 infizierten sich etwa 7.000 Menschen täglich mit HIV, die meisten davon in Ländern mit niedrigem ökonomischem Niveau. 1.000 von ihnen waren jünger als 15 Jahre, von den restlichen 6.000 Infizierten gehörten 41% zur Altersgruppe der 15- bis 24-Jährigen, etwa 51% waren Frauen. Die höchsten Wachstumsraten der Epidemie sind in Russland und der Ukraine zu verzeichnen. Während die Prävalenz in den Ländern der Subsahara stagniert oder leicht rückläufig ist, hat sich die Prävalenz der HIV-Infektion in den Ländern der ehemaligen Sowjetrepublik seit dem Jahr 2001 verdoppelt.
Situation in Österreich: In Österreich dürften etwa 8.000 Menschen mit HIV/Aids leben (inklusive der Dunkelziffer), wobei die Zahl der Neudiagnosen pro Jahr im letzten Jahrzehnt zwischen 250 und 350 lag, Tendenz steigend. Zugenommen haben die Neudiagnosen bei Menschen mit heterosexueller Orientierung. Dies korreliert fast deckungsgleich mit der Zunahme der Neudiagnosen bei Menschen mit Migrationshintergrund. Beunruhigend ist besonders die in den vergangenen Jahren steigende Zahl der Neudiagnosen in der homosexuellen Community. Die Koinzidenz mit einer Zunahme von Syphilisfällen und anderen sexuell übertragbaren Erkrankungen in diesem Kollektiv lässt auf einen sorgloseren Umgang mit Präventionsmaßnahmen schließen.
Transmission
Die drei wichtigsten Transmissionswege sind:
1) Ungeschützter Geschlechtsverkehr mit einem HIV-positiven Partner
2) Austausch von Spritzenutensilien bei Gebrauch intravenöser Drogen
3) Vertikale Transmission von einer HIV-positiven Mutter auf das Neugeborene
Das Risiko, im Rahmen einer Transfusion von Blut bzw. Blut- produkten infiziert zu werden, ist nicht zuletzt aufgrund der Testung von Spenderblut mittels PCR als äußerst gering einzustufen (etwa 1 Fall auf 8 Mio. Transfusionen). Der alltägliche Umgang mit HIV-positiven Menschen stellt in keiner Weise ein Risiko dar. Ein letztlich geringes Risiko besteht im medizinischen Bereich für eine Infektion durch Nadelstichverletzungen. Das Risiko beträgt bei die Haut penetrierenden Verletzungen mit Hohlraumnadeln, welche unmittelbar zuvor bei einem HIV-positiven Patienten mit nachweisbarer Virusreplikation im Gebrauch waren, etwa 0,3%. In diesen Fällen wird ein rascher Beginn einer postexpositionellen antiretroviralen Prophylaxe (PEP) sowie die Betreuung und Beratung durch ein HIV-Zentrum empfohlen.
Der weitaus wichtigste Übertragungsweg ist der ungeschützte Geschlechtsverkehr mit einem HIV-positiven Partner. Man sollte diese Aussage jedoch differenzierter formulieren: Konkret besteht das Risiko bei ungeschütztem Geschlechtsverkehr mit einem unbehandelten HIV-positiven Partner. Mehrere epidemiologische Studien bei HIV-diskordanten Paaren belegen eine drastische Reduktion der Transmissionsrate, wenn die Viruslast (HIV-PCR im Blut) des behandelten positiven Partners unter der Nachweisbarkeitsgrenze liegt. Die HIV- Therapie etabliert sich damit zunehmend als Präventionsinstrument.
Diagnose
Die Diagnose einer HIV-Infektion wird durch den Nachweis HIV-spezifischer Antikörper gestellt. Erforderlich ist der HIV- Nachweis in zwei unabhängig abgenommenen Blutproben durch zwei unterschiedliche Testverfahren, wobei eines ein Western Blot sein muss. Der Nachweis von Antikörpern stellt in der chronischen Phase der Infektion einen hochsensitiven und gleichzeitig spezifischen Test dar und eignet sich daher als Suchtest. Während der akuten HIV-Infektion können jedoch Antikörper noch nicht nachweisbar sein. Die neuesten ELISA verkürzen dieses diagnostische Fenster durch den Nachweis nicht nur von HIV-spezifischen Antikörpern, sondern auch des viralen Glykoproteins p24. In dieser Phase ist allerdings der direkte Virusnachweis mittels PCR die sensitivste Untersuchungsmethode. Typischerweise ergibt sich hier ein hochpositives Ergebnis mit mehr als 105 bis 106 Kopien/ml (hohe Infektiosität!). Der direkte Virusnachweis ist darüber hinaus zum Nachweis beziehungsweise Ausschluss einer vertikalen Infektion notwendig, da in den ersten 18 Lebensmonaten nicht unterschieden werden kann, ob HIV-Antikörper beim Neugeborenen mütterlicher oder kindlicher Herkunft sind. Wurde eine HIV-Infektion mittels direktem Virusnachweis diagnostiziert, muss dennoch in weiterer Folge diese Diagnose zeitgerecht durch einen Antikörpernachweis bestätigt werden.
Die Klinik
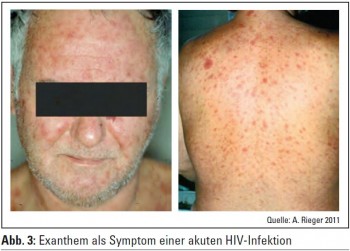
Akute HIV-Infektion: Das Erkennen der akuten HIV-Infektion ist nicht nur für den betroffenen Patienten, sondern auch infektionsepidemiologisch von großer Bedeutung. Studien belegen, dass bis zu 50% der HIV-Transmissionen durch Patienten mit einer Primärinfektion erfolgen. Dies liegt daran, dass die HI-Virämie in keinem Stadium der Erkrankung so hoch ist wie in der Phase der akuten HIV-Infektion und der Patient zu diesem Zeitpunkt daher besonders infektiös ist. Nur etwa die Hälfte der Patienten mit einer akuten HIV-Infektion sind symptomatisch, wobei die Symptomatik von einer leichten fieberhaften Episode bis zu einer schwer verlaufenden, auch von opportunistischen Infekten begleiteten Erkrankung reichen kann. Symptome einer akuten HIV-Infektion treten wenige Wochen (frühestens 2 Wochen) nach der Ansteckung auf. Das häufigste und verlässlichste Symptom ist Fieber. Dies kann mit einem Exanthem (Abb. 3), vergrößerten Lymphknoten, Pharyngitis, Myalgien, Kopfschmerzen und Diarrhoen verbunden sein. Die Symptomatik ist prinzipiell selbstlimitiert.
Chronische HIV-Infektion: Mit dem Abklingen der Symptome der akuten Infektion bzw. nach erfolgter Serokonversion (positiver HIV-Antikörpernachweis) tritt die Infektion in das chronische Stadium über. Klinisch ist der Patient zumeist asymptomatisch oder oligosymptomatisch (z. B. generalisierte Lymphadenopathie), nichtsdestoweniger ist diese Phase von einem stetem Verlust von CD4+-Lymphozyten mit progredienter Schwächung des Immunsystems und einer interindividuell unterschiedlich hohen Virusreplikation geprägt. Eine unbehandelte chronische HIV-Infektion mündet im Allgemeinen nach 7 bis 10 Jahren in das Stadium Aids. Das Zeitintervall bis zum Ausbruch von Aids ist sehr unterschiedlich (Rapid Progressor 2–3 Jahre; Long-term Non-Progressor > 10 Jahre). Eine Vielzahl von viralen und Wirtsfaktoren (genetischer Background, Komorbiditäten, Alter, Ernährungsstatus etc.) determiniert die individuelle Progressionsrate. Etwa 1% der HIV-infizierten Patienten mit kaukasischer Herkunft weisen auch ohne ART eine nicht nachweisbare HI-Virusreplikation auf (Elite Controller).
Die chronische HIV-Infektion, wenn klinisch auch oft asymptomatisch, ist letztlich ein hoch dynamischer Prozess, wobei bei einer Halbwertszeit des HI-Virus von wenigen Stunden der virale Pool im Plasma etwa alle 30 Minuten vollkommen ausgetauscht wird und > 99% der im Plasma gemessenen Viren (Viruslast) von kürzlich infizierten Zellen stammen. Es ist je- doch nicht primär der zytopathische Effekt von HIV, welcher letztlich zur progressiven Immundepletion führt, sondern es wurde gezeigt, dass die überwiegende Zahl der verloren gehenden T-Zellen nicht infiziert ist. Dies impliziert einen Bystander-Mechanismus der CD4+-Lymphozyten-Destruktion. Der hierfür verantwortliche Trigger dürften bereits Veränderungen im Rahmen der akuten HIV-Infektion sein. So ist bereits wenige Wochen nach der Infektion eine Depletion des Mukosa- assoziierten lymphoiden Gewebes (MALT) zu beobachten, die während der chronischen Phase der Infektion anhält. Dabei ist speziell jener T-Zell-Phänotyp betroffen, welcher eine entscheidende Rolle in der mikrobiellen Abwehr spielt (Th17-Zellen). Die Folge dürfte eine vermehrte Translokation proinflammatorischer mikrobieller Produkte aus dem Darmlumen sein. So sind im Vergleich zu HIV-negativen Probanden bei Patienten mit chronischer HIV-Infektion signifikant höhere Lipopoly saccharid(LPS)-Blutspiegel vorhanden. LPS-Spiegel sind höher bei Patienten mit rascher HIV-Progression, korrelieren positiv mit Parametern der Immunaktivierung und negativ z. B. mit einem von einem durch eine antiretrovirale Therapie (ART) induzierten CD4-Zellgewinn. Patienten mit einer über Jahre sehr gut kontrollierten HIV-Infektion (Elite Controller) und behandelte HIV-Patienten zeigen geringere LPS-Blutspiegel als unbehandelte HIV-Patienten, aber immer noch höhere Werte als HIV-negative Personen.
Neben LPS könnten auch andere mikrobielle Produkte (Flagellin, Peptidoglykane etc.) über die Bindung an Toll-like-Rezeptoren von Makrophagen und dendritischen Zellen dieselben zur Produktion einer Reihe von proinflammatorischen Zytokinen (Il-6, TNFα, IL-1) stimulieren.
Die Konsequenzen dieser chronischen Immunstimulation dürften ebenso mannigfaltig sein wie ihre Ursachen. Ein chronisch entzündliches Milieu führt zu aktivierungsinduzierter Apoptose von zumeist nicht infizierten Lymphozyten unterschiedlichster Spezifität. Dies wird heute als wichtigste Ursache der CD4-Depletion angenommen. Jede Immunaktivierung erhöht den Pool für die HIV-Infektion empfänglicher Zellen und fördert somit den Virus-induzierten Zelluntergang. Mit der Zeit werden naive und ruhende Gedächtniszellen zunehmend aufgebraucht und durch hochdifferenzierte oligoklonale Populationen ersetzt. Dadurch erschöpft sich das regenerative Potenzial des spezifischen Immunsystems zunehmend. Daher ist das späte Krankheitsstadium nicht nur durch eine zunehmende Inzidenz opportunistischer Erkrankungen geprägt, sondern auch durch den Verlust der Fähigkeit zur Eindämmung der viralen Replikation. Meist ist auch ein Anstieg der Viruslast als Ausdruck einer weitgehend ungebremsten HI-Virusreplikation zu beobachten.
Die chronische Sekretion von proinflammatorischen Zytokinen über den gesamten Verlauf der HIV-Infektion geht jedoch auch an anderen Zelltypen und Organsystemen nicht spurlos vorüber. Eine Dysregulation im Zytokinmuster dürfte eine wichtige kausale Rolle in der Pathophysiologie der Osteoporose, von kardiovaskulären Erkrankungen, neurokognitiven Funktionsdefiziten und des Alterns („inflamm-aging“) spielen.
Neben den direkten und indirekten Auswirkungen der HIV- Infektion auf das Immunsystem und dessen Folgen dürfte das HI-Virus auch für andere Organpathologien verantwortlich zeichnen wie der HIV-assoziierten Nephropathie oder der HIV- assoziierten Kardiomyopathie.
Aids
Das Stadium Aids ist in Österreich durch das Auftreten von Indikatorerkrankungen definiert und ist eine meldepflichtige Erkrankung. Die Centers of Disease Control (CDC) definiert das Stadium Aids darüber hinaus auch mit einer peripheren CD4-Zellzahl von < 200/mm3. In Zeiten vor der Implementierung antiretroviraler Kombinationstherapien in den klinischen Alltag (vor 1995/96) betrug die mittlere Überlebensdauer der Betroffenen zwischen ein und drei Jahren. Aids wird heute überwiegend bei Patienten mit unbehandelter oder erst seit Kurzem behandelter HIV-Infektion diagnostiziert. Trotz flächendeckender Möglichkeit zur HIV-Testung, mehr als 2 Jahrzehnten diverser Aufklärungskampagnen und hervorragenden Behandlungsmöglichkeiten werden in Österreich immer noch etwa 25% der HIV-Diagnosen zu einem Zeitpunkt sehr fortgeschrittener Immundepletion gestellt (CD4-Zellzahl < 200/mm3). Risikofaktoren für eine späte Diagnose umfassen Heterosexualität, Alter > 50 Jahre, Migrationshintergrund sowie kulturelle und sozioökonomische Faktoren.
Die aktuell häufigsten Aids-definierenden Diagnosen umfassen in Europa Soor-Ösophagitis, Pneumocystis-Pneumonie, Non- Hodgkin-Lymphome und Tuberkulose. Potenzielle Arzneimittelinteraktionen zwischen antiretroviralen Substanzen und Therapeutika gegen opportunistische Infektionen, kumulative Toxizität und Immunrekonstitutionssyndrome gestalten die Behandlung oft schwierig und risikoreich. Eine späte HIV- Diagnose ist in jedem Fall mit einer erhöhten Morbidität und Mortalität vergesellschaftet. Selbst bei erfolgreicher Behandlung bleibt dieses Risiko im Vergleich zu Personen mit frühzeitigem Behandlungsbeginn über Jahre auf höherem Niveau bestehen.
NEPHRO Spot
Vor 30 Jahren, im Dezember 1981, wurden die ersten Berichte über junge Homosexuelle mit Pneumocystis-Pneumonien, Kaposi-Sarkomen und Pilzinfektionen publiziert. 1983 wurde das Retrovirus HIV als Ursache von HIV/Aids identifiziert und 4 Jahre später wurde das erste Virostatikum (Retrovir) therapeutisch eingesetzt.
Aber erst mit den neuen antiretroviralen Therapien der letzten Jahre ist es gelungen, den Verlauf der HIV-Infektion soweit zu beeinflussen, dass statistischen Modellen zufolge unter idealen Rahmenbedingungen bei lebenslanger Therapie mit einer fast normalen Lebenserwartung zu rechnen ist. Dieser Erfolg kann allerdings nur erreicht werden, wenn Betroffene frühzeitig einer spezialisierten medizinischen Betreuung zugeführt werden bzw. eine solche in Anspruch nehmen.
In den Ländern mit hoher HIV-Prävalenz und/oder -Inzidenz hat jedoch immer noch nur ein kleiner Teil therapiepflichtiger Menschen auch Zugang zur Therapie und für jeden neu therapierten Patienten kommen im Gegenzug zwei Neuinfektionen hinzu. Da eine effektive Vakzine fehlt, ist eine Bewältigung des globalen Problems in den nächsten Jahrzehnten nur durch den breiten Einsatz von antiretroviralen Substanzen in Therapie und/oder Prophylaxe zu erwarten.