Studienpräsentation
Sirolimus induced phosphaturia is not caused by inhibition of renal apical sodium phosphate cotransporters; PLoS One 2012; 7(7):e39229. Epub 2012 Jul 30
Haller M1–3, Amatschek S1, Wilflingseder J1, Kainz A1, Bielesz B1, Pavik I2, Serra A2, Mohebbi N2, Biber J2, Wagner CA2, Oberbauer R1, 3
1Department of Nephrology, Medical University of Vienna, Austria
2Institute of Physiology and Zurich Center for Integrative Human Physiology (ZIHP), University of Zurich, Switzerland
3Department of Nephrology and Transplantation, KH Elisabethinen Linz, Austria
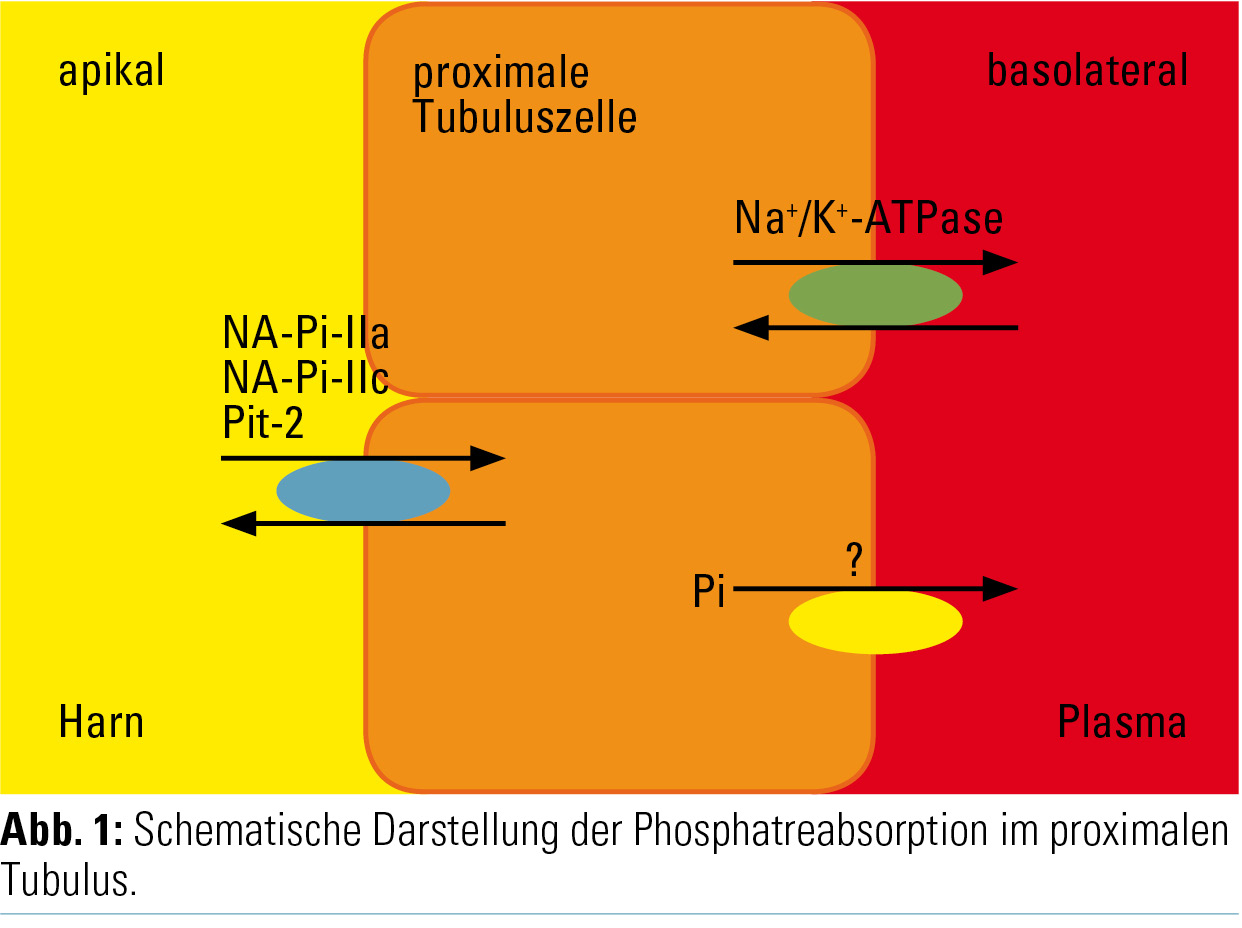
Phosphat ist ein essenzieller Bestandteil vieler lebenswichtiger Prozesse, wie beispielsweise des Zellmetabolismus und der Knochenmineralisierung. Das extrazelluläre Phosphat wird hauptsächlich renal reguliert. Phosphat wird frei filtriert und entlang des proximalen Tubulus je nach Bedarf reabsorbiert, hierfür sind bis heute drei natriumabhängige Phosphattransporter in der Bürstensaummembran bekannt: NaPi-IIa, NaPi-IIc und Pit-2 (Abb. 1). Diese Transporter wiederum werden von verschiedenen Hormonen, den Phosphatoninen, reguliert. Dazu zählen Parathormon (PTH), 1,25-(OH)2-Vitamin D3, Fibroblast Growth Factor 23 (FGF23) und Klotho.
In den ersten Wochen nach einer Nierentransplantation stellt die Hypophosphatämie ein häufiges klinisches Problem dar, kann aber nur partiell durch den präexistenten Hyperparathyreoidismus und eine verzögerte Reduktion des FGF23-Spiegels erklärt werden. Sowohl In-vivo-Studien als auch klinische Studien deuten darauf hin, dass immunsuppressive Medikamente die Phosphatregulation entscheidend beeinflussen. Insbesondere Sirolimus, ein potenter Inhibitor des „mammalian target of rapamycin“ (mTOR) ist mit einer aggravierten und verlängerten Phosphaturie nach Nierentransplantation assoziiert. Bis heute ist unklar, wie Sirolimus die renale Phosphatreabsorption beeinflusst. Ziel dieser Studie war, die der sirolimusinduzierten Phosphaturie zugrunde liegenden Mechanismen aufzuklären. Unsere Hypothese war, dass Sirolimus die natriumabhängigen Phosphattransporter im proximalen Tubulus hemmt. Entsprechend untersuchten wir diese Transporter unter Sirolimuseinfluss in vivo.
Studiendesign
Ratten wurde täglich Sirolimus in einer Konzentration von 1,5 mg/kg Körpergewicht subkutan über entweder zwei oder sieben Tage injiziert. Kontrolltiere erhielten eine äquivalente Menge der Lösungsmittel (Vehikel) subkutan. Während des Experimentes wurden die Ratten einzeln in Stoffwechselkäfigen gehalten, um Körpergewicht, Ein- und Ausfuhr täglich messen und Urinproben sammeln zu können. Am Ende des Experiments wurden die Ratten euthanasiert, Blut und Nieren entnommen.
Ergebnisse
Nierenfunktion: Die Sirolimusbehandlung über zwei und sieben Tage hatte keinen Effekt auf die Kreatininclearance oder das Serumkreatinin, verursachte aber eine Polyurie. Sowohl die renale Bikarbonatexkretion als auch die Proteinurie waren zwischen den Gruppen nicht unterschiedlich. Weder die relativen mRNA-Expressionslevel von NHE3 und Na+/K+-ATPase, Indikatoren für einen intakten proximalen Tubulus, noch die Proteinexpression von NHE3 wurden durch Sirolimus verändert.
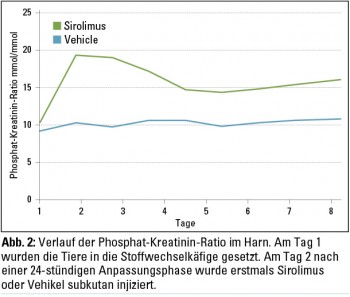
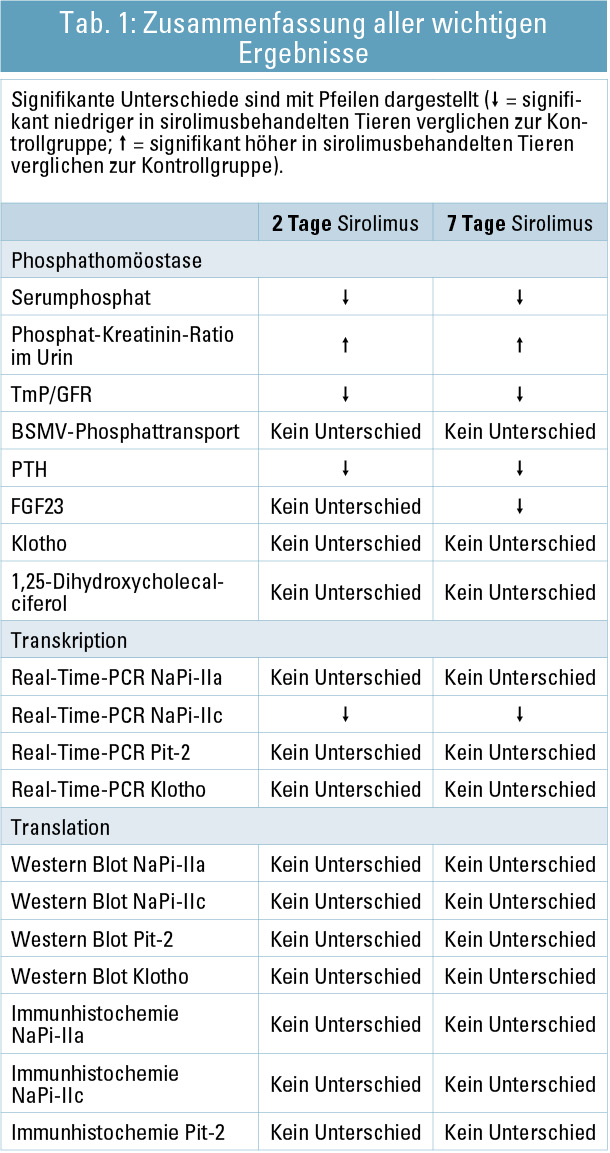
Phosphathomöostase: Mit Sirolimus behandelte Tiere hatten bereits 24 Stunden nach der ersten Injektion und in Folge über den gesamten Untersuchungszeitrum eine verglichen mit der Kontrollgruppe signifikant höhere Phosphat-Kreatinin-Ratio im Harn (p < 0,0001; Abb. 2). In Tabelle 1 sind die Ergebnisse der Phosphathomöostase (Serumphosphat, Phosphat-Kreatinin-Ratio im Urin, TmP/GFR, Phosphattransport gemessen in Bürstensaummembranvesikel (BSMV), PTH, FGF23, Klotho, 1,25-Dihydroxycholecalciferol) dargestellt.
Renale Phosphatregulation auf Transkriptionsebene: Die Ergebnisse der Real-Time-PCR erbrachten nur geringe Unterschiede (Tab. 1). Die Auswertung des Genexpressionsprofils ergab insgesamt 154 unterschiedlich exprimierte Gene zwischen sirolimus- und vehikelbehandelten Tieren, die einerseits die bisherigen Ergebnisse bestätigten und andererseits eine signifikant niedrigere Expression des bisher noch weitgehend unbeschriebenen möglichen Phosphattransporters SLC17A4 zeigte.
Renale Phosphatregulation auf Translationsebene: Die Behandlung mit Sirolimus hatte keinen Effekt auf die Proteinexpression für NaPi-IIa, NaPi-IIc, Pit-2 und Klotho. Auch immunhistochemisch konnte keine unterschiedliche Distribution oder Lokalisation der Phosphattransporter an der Bürstensaummembran festgestellt werden.
Diskussion
Mit dieser Studie konnten wir demonstrieren, dass Sirolimus eine Hypophosphatämie und eine Hyperphosphaturie verursacht. Jedoch wurde dieser renale Phosphatverlust nicht durch eine Dysfunktion der drei derzeit bekannten Phosphattransporter vermittelt. Vielmehr zeigten unsere Daten, dass die physiologischen Feedbackmechanismen der phosphatregulierenden Hormone intakt sind und dem renalen Phosphatverlust entgegenzuwirken versuchten. Mit Sirolimus behandelte Ratten entwickelten weder einen akuten Tubulusschaden noch ein Nierenversagen.
Diese Ergebnisse stehen im Widerspruch zu kürzlich publizierten In-vitro-Studien, die der Proteinkinase mTOR eine regulierende Rolle im renalen und intestinalen Phosphattransport zuschreiben. Auch für den kürzlich beschriebenen, von FGF23 unabhängigen phosphaturischen Effekt von Klotho ergaben sich in unserem Tiermodell keine Hinweise.
Das Genexpressionsprofil liefert Hinweise für einen bisher noch weitgehend unbeschriebenen, potenziellen natriumabhängigen Phosphattranporter aus der SLC17-Superfamilie. Weiterführende Untersuchungen dieses Transporters sind jedenfalls notwendig, um dessen biologische Signifikanz zu klären.
Trotz dieser umfassenden Studie bleiben die Mechanismen der sirolimusinduzierten Phosphaturie weiterhin unbekannt. Basierend auf diesen Daten kann eine Dysregulation der Phosphatreabsorption an der apikalen Bürstensaummembran des proximalen Tubulus ausgeschlossen werden. Alternativ ist eine Dysregulation des Phosphattransportes an der basolateralen Zellmembran oder das Vorhandensein von Phosphattransportern weiter distal im Tubulussystem denkbar (Abb. 1).