Aminosäure PET bei Gliomen
Einleitung
Gliome sind mit 5–6 Neuerkrankungen pro 100.000 EinwohnerInnen/Jahr nach den Menigeome die zweithäufigsten primären Hirntumoren. Die derzeitige Einteilung der Gliome erfolgt nach der WHO-Klassifikation von 2016 der Tumoren des zentralen Nervensystems. Erstmals spielen neben den bekannten histologischen Kriterien auch molekulare Parameter (z. B. IDH-Mutation, 1p/19q Co-Deletion, MGMT-Promotormethylierung) eine entscheidende Rolle.
Trotz guter Fortschritte in den heute zur Verfügung stehenden neurochirurgischen Verfahren mit Optimierung des Resektionsausmaßes, den strahlentherapeutischen Techniken mit Einsatz modulierter Bestrahlungstechniken sowie neuen chemotherapeutischen, molekular-zielgerichteten und immunologischen Behandlungsmöglichkeiten hat sich in den letzten Jahren die Prognose und Überlebenszeit nur mäßig verbessert. So beträgt die mediane Überlebenszeit von Glioblastom-(GBM-)PatientInnen mit einer Standardtherapie nach Stupp in Abhängigkeit der MGMT-Promotormethylierung nur 12,7 Monate (MGMT nichtmethyliert) bzw. 21,7 Monate (MGMT methyliert). Die 2-Jahres-Überlebensrate lag für alle GBM-PatientInnen bei 27,2 % und die 5-Jahres-Überlebensrate bei 9,8 %. Eine Kombination von Lomustin (CCNU) mit Temozolomid (TMZ) könnte die Überlebenszeit von GBM-PatientInnen mit MGMT-Promotormethylierung möglicherweise verlängern (mOS 31,4 Monate TMZ vs. 48,1 Monate TMZ+CCNU; 2-Jahres-Überlebensrate 71 %).
Derzeit wird versucht, mit neuen Therapiekonzepten, die auf einem besseren biologischen Ver-ständnis der molekularen Onkogenese und der Interaktion des Immunsystems mit Gliomen basieren, die Prognose weiter zu verbessern. Diese innovativen Behandlungsstrategien stellen gleichzeitig eine zunehmende Herausforderung an die Bildgebung von Hirntumoren dar.
MRT-Bildgebung von Gliomen
Für die morphologische Bildgebung hirneigener Tumoren ist die Magnetresonanztomografie (MRT) aufgrund des hohen Weichteilkontrastes und der Verfügbarkeit der Goldstandard. Dabei werden routinemäßig T1-gewichtete Sequenzen ohne (T1) und mit (T1wCE) Kontrastmittelverstärkung (KM), T2-, FLAIR-(„fluid-attenuated inversion recovery“-) und diffusionsgewichtete (DWI-) Sequenzen durchgeführt. Häufig ergänzen Perfusionsmessungen (PWI, z. B. „dynamic contrast-enhanced“-MRT [DCE-MRT], „dynamic susceptibility contrast“ MRT [DSC-MRT]) und suszeptibilitätsgewichtete Sequenzen (z. B. „susceptibility-weighted imaging“ [SWI]) die Standard-MRT-Diagnostik.
In vielen Situationen sind jedoch die Möglichkeiten der Standard-MRT durch eine eingeschränkte Beurteilung des vitalen Tumorgewebes (z. B. Unterscheidung von KM-aufnehmenden und KM-negativen Tumoranteilen), die Unterscheidung von Tumorgewebe von unspezifischen Gewebeveränderungen (z. B. T2-/FLAIR-hyperintense Veränderungen durch das perifokale Ödem oder operations-/strahlentherapieassoziiert Gliosen) und therapieassoziierte Veränderungen (z. B. Pseudoprogression nach einer Strahlen- oder Immuntherapie, Pseudoresponse im Verlauf einer antiangiogenen Therapie) eingeschränkt.
Grundlagen der PET-Bildgebung von Gliomen
Nuklearmedizinische Verfahren können physiologische und biochemische Prozesse in Echtzeit und in vivo sichtbar machen und damit wesentliche zusätzliche Informationen zum Stoffwechsel pathologischer Hirnveränderungen geben.
Glucose-Analoga
Der in der Onkologie am häufigsten verwendete Tracer bei der Positronen-Emissionstomografie-(PET-)Untersuchungen ist 2-18F-Fluordesoxygenase (FDG). Die FDG-PET hat bei der Diagnostik von Gliomen aber aufgrund seiner hohen Hintergrundaktivität im normalen Hirngewebe (z. B. Kortex, Stammganglien) sowie der geringen Sensitivität und Spezifität jedoch nur eine eingeschränkte Aussagekraft.
Aminosäure-PET
Die PET-Bildgebung mit radioaktiv-markierten Aminosäuren hat sich in den letzten Jahren in der Neuroonkologie in einer Vielzahl von Untersuchungen als sehr wertvoll erwiesen.
Die derzeit am besten etablierten Aminosäure-Tracer für die Hirntumordiagnostik sind die großen neutralen Aminosäuren Methyl-11C-L-Methionin (MET) und O-(2-18F-Fluoroethyl)-L-Tyrosin (FET) sowie die aromatische, nichtproteinogene Aminosäure 6-18F-Fluoro-3,4-dihydroxy-L-Phenylalanin (FDOPA = L-DOPA), welche eine biochemische Vorstufe in der Biosynthese von Adrenalin, Noradrenalin, Dopamin sowie Melaninen darstellt.
Aminosäuren werden physiologisch im ZNS über transmembrane Aminosäure-Transporter zunächst über die Endothelzellen der Blut-Hirn-Schranke (BHS) und dann in verschiedene Gehirnzellen (z. B. Neuronen, Astrozyten oder Oligodendrozyten) aufgenommen.
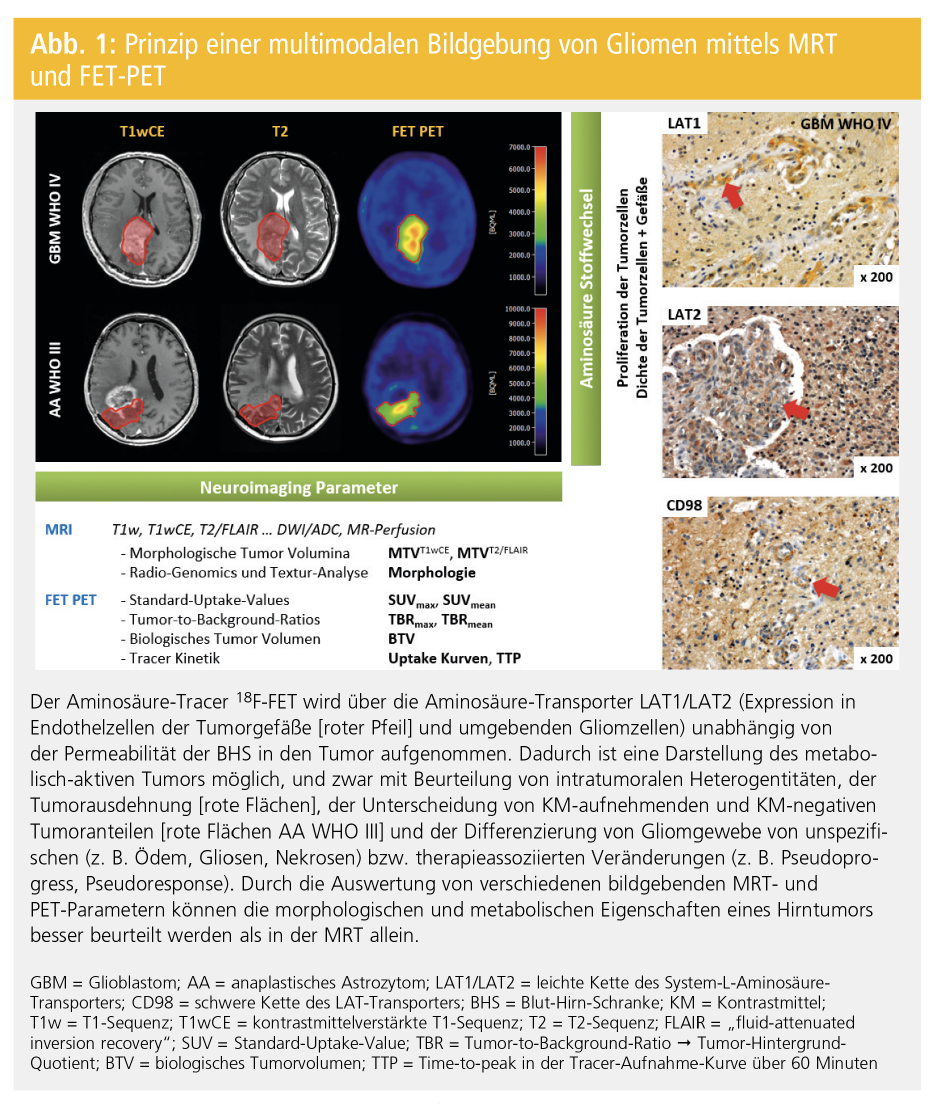
In Hirntumoren erfolgt der Uptake der neutralen Aminosäuren MET/FET hauptsächlich stereospezifisch über das natriumunabhängige System L von Aminosäure-Transportern (LAT1, LAT2; Abb. 1) und wesentlich geringer über die natriumabhängigen Systeme ASC sowie über die Systeme B0, + und B0.
Die LAT-Transporter sind Heterodimere und bestehen aus einer leichten Kette (definiert den Subtyp LAT1 bzw. LAT2) und einer schweren Kette (CD98/4F2hc). LAT1 ist ubiquitär vorhanden, jedoch in vielen Tumorzellen überexprimiert. LAT2 ist physiologisch überwiegend in Epithelzellen (z. B. Endothelzellen der Blut-Hirn-Schranke) nachweisbar und hat im Gehirn auch beim Transfer von Glutamin zwischen Astrozyten und Neuronen eine wichtige Funktion.
Die LAT-Transporter funktionieren als bidirektionale Transporter mit einem obligatorischen Austauschmechanismus, d. h. die treibende Kraft für die Aufnahme einer Aminosäure nach intrazellulär ist der Gegentransport einer anderen Aminosäure (z. B. Leucin) nach extrazellulär.
Innerhalb der Zelle wird FET – im Gegensatz zu MET und FDOPA – in keine Stoffwechselwege eingeschleust oder in Proteine eingebaut. Aufgrund einer Asymmetrie der intra- und extrazellulären Erkennung durch LAT1 kommt es hingegen zu einer Akkumulation von FET in Tumorzellen.
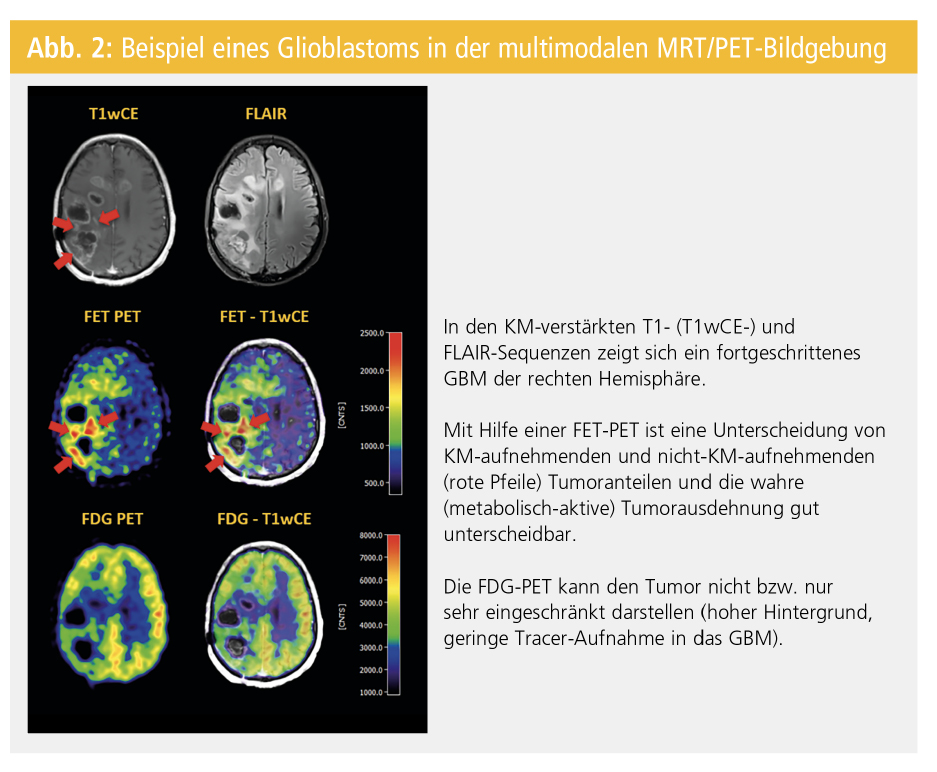
Da die Endothelzellen der Blut-Hirn-Schranke bereits physiologisch LAT-Transporter exprimieren, ist eine Aminosäure-Tracer-Aufnahme in das Gehirn bzw. in den Tumor unabhängig von der BHS-Permeabilität – und damit auch unabhängig von einer KM-Aufnahme in der MRT – möglich (Abb. 1 und Abb. 2).
Die Aminosäure PET hat – im Gegensatz zur FDG-PET und Standard-MRT – folgende entscheidende Vorteile:
- Die physiologische Aufnahme von Aminosäuren in das normalen Hirngewebe ist relativ gering, daher können Gliome mit einem hohen Kontrast im Vergleich zum gesunden Gewebe abgegrenzt werden.
- Die Darstellung des stoffwechselaktiven Hirntumors ist unabhängig von der Permeabilität der Blut-Hirn-Schranke sehr gut möglich.
- Der Aminosäure-Tracer-Uptake korreliert mit dem Proliferationsindex der Tumorzellen und der Tumorzell- bzw. Gefäßdichte.
Diese Tracer-Eigenschaften ermöglichen – zusätzlich zu einer strukturellen MRT-Untersuchung – folgenden Informationsgewinn (Abb. 1 und Abb. 2):
- bessere Beschreibung der Lokalisation, Ausdehnung und intratumoralen Heterogenität von hirneigenen Tumoren
- Unterscheidung von KM-aufnehmenden und nicht-KM-aufnehmenden Tumoranteilen
- Unterscheidung von unspezifischen (z. B. Ödem, Nekrose, Gliose) und therapieassoziierten Veränderungen (z. B. Pseudoprogression, Pseudoresponse) von metabolisch aktivem Tumorgewebe
Vergleichende Studien konnten zeigen, dass die Tumordarstellung mit FET, MET und FDOPA sehr ähnlich ist. Der am besten evaluierte Aminosäure-Tracer ist derzeit FET.
Der Vorteil von FET im Vergleich zum MET liegt in der längeren Halbwertszeit von Fluor-18 (18F = 110 Minuten; 11C = 20 Minuten, daher Zyklotron notwendig), wodurch die Tracer-Logistik erheblich vereinfacht und eine Lieferung an verschiedene Zentren möglich wird.
Des Weiteren zeigte FET in entzündlichen Läsionen (z. B. Hirnabszesse, MS-Plaques) eine signifikant geringere Anreicherung als MET, was auf eine höhere Spezifität bei der Differenzierung von Tumoren und inflammatorischen Prozessen hindeutet.
Der Vorteil von FET im Vergleich zum FDOPA ist eine geringere physiologische Tracer-Aufnahme im Bereich der Stammganglien, wodurch eine deutlich bessere Darstellung und Abgrenzung von Gliomen in diesem Bereich möglich ist.
Durch die Analyse und Quantifizierung der FET-Aufnahmekinetik können niedrigmaligne von hochmalignen Hirntumoren besser unterschieden werden. Solche Unterschiede wurden bei MET und FDOPA nicht beobachtet.
Klinische Anwendung der Aminosäure-PET
Primärdiagnostik eines Hirntumors
Mit einer MRT können die meisten Raumforderungen des Gehirns strukturell gut beschrieben und differenzialdiagnostisch eingeordnet werden. Dennoch ergeben sich immer wieder unklare Situationen, in denen eine Aminosäure-PET sehr hilfreich sein kann.
Durch die Bestimmung des Tumor-Hintergrund-Quotienten (TBRmean bzw. TBRmax, Tumor-to-Background-Ratio; Abb. 1) kann eine vermehrte FET-Anreicherung einer Hirnläsion ab einem TBRmean > 1,9 mit einem hohen positiven prädiktiven Wert von 97 % einen neoplastischen Prozess identifizieren und macht somit eine histologische Abklärung erforderlich.
Die Spezifität und Sensitivität für die Diagnose eines hochmalignen Glioms mittels FET-PET in einer großen nichtselektionierten PatientInnenpopulation lag bei 56 % bzw. 74 %. Die niedrige Spezifität erklärt sich durch einen ebenfalls positiven FET-Uptake in andere gliale (z. B. Ependymom, pilozytisches Astrozytom) und nichtgliale Tumoren (z. B. Medulloblastom, ZNS-Lymphom, Meningeome, Hirnmetastasen).
Biopsie-, Tumorresektions- und Strahlentherapie-Planung
Die Gewinnung einer repräsentativen Gewebeprobe ist für die histologische und molekulare Diagnose, Prognoseeinschätzung und weitere Therapieplanung von PatientInnen mit einem Gliom von zentraler Bedeutung.
Die MRT bietet bei inhomogenen Gliomen nur eingeschränkte Hinweise auf stärker proliferierende Tumoranteile, insbesondere bei fehlender KM-Aufnahme (z. B. Gliome WHO II und III). Fokale Aminosäure-Tracer-Anreicherungen („hot spots“) innerhalb von biologisch heterogenen Gliomen entsprechen in der Regel – und unabhängig von der KM-Aufnahme in der MRT – den bösartigsten Anteilen im Tumor (Abb. 2), wodurch eine Biopsie-Planung deutlich erleichtert wird.
Gliome sind grundsätzlich keine gut lokalisierten Tumore (Abb. 2). Typischerweise infiltrieren sie in ihrem Randbereich mit abnehmender Zelldichte weit in das gesunde Gehirn, ein (histologisch) exakter Tumorrand ist daher häufig nur schwer zu bestimmen.
In mehreren Studien wurde die in der MRT bzw. Aminosäure-PET visuell erkennbare Tumorausdehnung anhand bioptischer Kontrollen bzw. Operationsbefunde verglichen, bei der sich eine zuverlässigere Darstellung der Gliom-Ausdehnung in der Aminosäure PET als in der MRT zeigte. Dieser Umstand kann bei hochgradigen Gliomen bei bis zu 80 % der PatientInnen eine entscheidende Rolle in der Resektionsplanung spielen und zu einer verlängerten Überlebenszeit führen.
Eine verbesserte Identifikation der Tumorausdehnung in der Aminosäure-PET – insbesondere von KM-negativen Tumoranteilen – ist auch für die Strahlentherapie-Planung von Bedeutung. Hier zeigten sich Vorteile insbesondere in der Hochpräzisionsstrahlentherapie, in Dosiseskalationsstudien und bei der Re-Bestrahlung von Rezidiv-Gliomen.
Graduierung von Gliomen
Gliome zeigten mit aufsteigendem WHO-Grading häufiger eine FET-Uptake (pilozytisches Astrozytom WHO I ca. 80 %, niedriggradiges Gliom WHO II ca. 79 %, anaplastisches Gliom WHO III ca. 92 %, Glioblastom WHO IV 100 %).
Hinsichtlich der Intensität einer Aminosäure-Tracer-Aufnahme, gemessen mit dem Tumor-Hintergrund-Quotient TBRmean/TBRmax, berichteten hingegen mehrere Untersuchungen über einen deutlichen Überlappungsbereich der Tracer-Aufnahme bei verschiedenen Malignitätsgraden, sodass eine zuverlässige Tumorgraduierung für den individuellen Patienten/die individuelle Patientin nicht möglich ist.
Dies beruht u. a. auf einem häufig relativ hohen Aminosäure-Uptake in Oligodendrogliome, welcher trotz niedriger Malignität häufig dem eines hochmalignen Hirntumors entspricht. Umgekehrt schließt eine geringe oder fehlende Aminosäure-Aufnahme einen (meist niedriggradigen) neoplastischen Prozess nicht aus.
Die Genauigkeit der statischen Aminosäure PET zur Differenzierung von hochgradigen und niedriggradigen Gliomen liegt nur bei 70–80 %. Durch die Auswertung der dynamischen FET-Uptake-Kinetik über 60 Minuten wurde eine deutliche Verbesserung der Sensitivität von bis zu 90 % erreicht. Dabei entspricht ein früher Peak der Zeitaktivitätskurve nach 10–15 Minuten, gefolgt von einem Abfall des FET-Uptakes, einem hochgradigen Gliom, während niedriggradige Gliome eine kontinuierliche Zunahme der FET-Anreicherung aufweisen.
Prognose
Die prognostische Bedeutung des Tumor-Hintergrund-Quotienten (TBRmax/TBRmean) der Aminosäure-Anreicherung ist umstritten. Im Gegensatz dazu konnte mehrfach die Bedeutung des biologischen Tumorvolumens (BTV) bei der Erstdiagnose eines Glioms als unabhängiger prognostischer Faktor gezeigt werden. Eine wichtige Rolle spielt die Aminosäure-PET bei der Beurteilung der Prognose von PatientInnen mit einem niedriggradigen Gliom. So konnte gezeigt werden, dass eine fehlende oder geringe MET-Aufnahme mit einer längeren Überlebenszeit einhergeht. Zudem scheint das Muster einer FET-Aufnahme (Unterscheidung diffuser vs. gut erkennbarer Tumorrand) mit einer besseren Prognose für gut abgrenzbare, niedriggradige Gliome einherzugehen.
Tumorprogress und Pseudoprogress
Die Unterscheidung eines Tumorrezidivs bzw. Tumorprogresses von posttherapeutischen Veränderungen ist mit der Standard-MRT häufig schwierig.
So kann beispielsweise eine neue oder fortschreitende pathologische Kontrastmittel-Anreicherung mit einem Tumorwachstum, aber auch mit nekrotischem Gewebe nach einer Strahlentherapie oder einer überschießenden lokalen inflammatorischen Reaktion nach einer Strahlen-/Chemotherapie oder Immuntherapie („Pseudoprogress“) einhergehen.
Umgekehrt ist – insbesondere bei niedriggradigen oder heterogenen höhergradigen Gliomen – ein Tumorprogress häufig nicht mit einer KM-Aufnahme assoziiert (Abb. 2). Das Tumorwachstum ist dann hauptsächlich in zunehmenden T2-/FLAIR-Veränderungen erkennbar. Diese sind in der MRT im Verlauf einer Gliomerkrankung jedoch nur schwer von einem Ödem und posttherapeutischen Veränderungen (z. B. Glioseareale, Leukenzephalopathie) zu unterscheiden.
Die FET- und FDOPA-PET haben eine sehr hohe Sensitivität und Spezifität (jeweils ca. 80–90 %) bei der Unterscheidung eines Tumorprogresses bzw. Rezidivs von einer Pseudoprogression oder posttherapeutischen Veränderungen, insbesondere wenn statische und dynamische FET-PET Auswertungen angewendet werden.
Die MET-PET hat eine hohe Sensitivität, jedoch nur eine niedrige Spezifität bei der Differenzierung von Tumorgewebe und nichtneoplastischen, entzündlichen Veränderungen. Der Grund liegt wahrscheinlich in einer gesteigerten Tracer-Aufnahme in Makrophagen.
Therapiemonitoring und Pseudoresponse
In der MRT werden durch die Verlaufsbeobachtung von morphologischen Größenveränderungen (z. B. KM-Aufnahme in der T1-Sequenz, T2-/FLAIR-Signalhyperintensitäten) und durch die Analyse der Perfusion eines Hirntumors Rückschlüsse auf das Therapieansprechen gezogen. Die Aussagekraft dieses Vorgehens ist jedoch dadurch eingeschränkt, dass mit einer MRT die wirkliche Ausdehnung des vitalen Tumorgewebes häufig nicht zuverlässig erfasst und die Unterscheidung zu nichttumorösen, strukturellen Veränderungen sehr schwer beurteilt werden kann.
Der Nutzen der Aminosäure-PET nach einer Operation (Bestimmung des Resttumors, evtl. auch Strahlentherapieplanung) sowie im Verlauf einer Strahlen- und/oder Chemotherapie (Monitoring von therapeutischen Effekten) ist in zahlreichen Studien nachgewiesen worden. So gilt grundsätzlich die Abnahme eines Aminosäure-Tracer-Uptakes (TBRmax/TBRmean) um mindestens 20–25 % als ein relativ sicheres Zeichen für ein Therapieansprechen. Dieser Parameter war bei GBM-PatientInnen auch mit einem signifikant längeren progressionsfreien Überleben und einer signifikant längeren Gesamtüberlebenszeit assoziiert.
Im Verlauf einer zielgerichteten, antiangiogenen Therapie (z. B. Bevacizumab [Avastin®], monoklonaler Antikörper mit Blockade von VEGF-A) kommt es rasch und häufig (ca. 70–80 %) zu einer deutlichen Reduktion der pathologisch erhöhten BHS-Permeabilität der Tumorgefäße. In der MRT führt dieser Therapieeffekt zu einer signifikanten Abnahme der KM-Aufnahme und Reduktion des perifokalen Ödems, welcher allerdings nicht automatisch mit einem Ansprechen der Tumorzellen auf die Therapie verbunden sein muss („Pseudoresponse“).
Mit einer FET- bzw. FDOPA-PET kann bereits 4 Wochen nach Beginn einer antiangiogenen Therapie mit Bevacizumab ein fehlendes Ansprechen (keine ausreichende Reduktion von TBRmean/TBRmax bzw. des biologischen Tumorvolumens BTV) erkannt werden. Dies ist somit um 4–12 Wochen früher als mit einer MRT-Untersuchung und bei Anwendung der RANO-Kriterien möglich.
Zudem konnten mehrere Studien zeigen, dass nach 8 Wochen Bevacizumab-Behandlung in 25–40 % in der MRT ein Therapieansprechen vorlag, welches jedoch in der FET- und FDOPA-PET als Pseudoresponse erkannt werden konnte. Ein wirkliches Therapieansprechen eines hochgradigen Glioms in der MRT und FET-/FDOPA-PET ging hingegen mit einem signifikanten Überlebensvorteil einher.
Pitfalls
Die Tracer-Aufnahme ist nicht nur spezifisch für neoplastische Erkrankungen. Ein vermehrter Aminosäure-Tracer-Uptake wurde in Einzelfällen auch bei Hirnabszessen, demyelinisierenden Prozessen (z. B. MS-Plaque, ADEM, ZNS-Vaskulitis), Radionekrosen, (subakuten) Hirninfarkten und Parenchymblutungen sowie epileptischen Anfällen (insbesondere Status epilepticus) beobachtet. Die Intensität des Tracer-Uptakes (TBRmean/TBRmax) ist – mit Ausnahme iktaler/periktaler kortikaler Veränderungen – meist deutlich geringer als bei höhergradigen Hirntumoren.
Die Unterscheidung nicht-neoplastischer Hirnläsionen von niedrigmalignen Hirntumoren kann beim individuellen Patienten/bei der individuellen Patientin auch in der statischen und dynamischen FET-PET schwierig sein.
Dennoch ist die Aminosäure-PET erheblich sensitiver und spezifischer als die FDG PET und wird von der RANO-Gruppe (Response Assessment in Neuro-Oncology) bei der Diagnostik von Hirntumoren als bevorzugtes PET-Verfahren empfohlen.
Schlussfolgerungen
Der große Vorteil der Aminosäure-PET (FET, MET und FDOPA) ist die Darstellung des metabolisch-aktiven Tumorgewebes unabhängig von der Permeabilität der Blut-Hirn-Schranke. In Kombination mit einer hochauflösenden morphologischen MRT-Bildgebung ist ein deutlicher Zugewinn an Informationen über einen Hirntumor möglich. Dazu zählen eine bessere Beurteilung der wirklichen Tumorausdehnung und der intratumoralen Heterogenität, eine Unterscheidung von KM-aufnehmenden bzw. nicht-KM-aufnehmenden Tumoranteilen sowie eine Abgrenzung von Tumorgewebe und unspezifischen Veränderungen (z. B. Ödem, Nekrose, Glioseareale). Diese Informationen können bei der Therapieplanung (u. a. Biopsie, Operation und Strahlentherapie) und beim Therapiemonitoring (u. a. Unterscheidung von Tumorprogress und Pseudoprogress/Radionekrose, Pseudoresponse) große Vorteile bieten.