Neurofilamente als Biomarker für Axonschaden und Neurodegeneration bei multipler Sklerose
Ein Biomarker ist definiert als ein Charakteristikum, das einen objektiven Indikator für physiologische oder pathophysiologische Prozesse oder das Ansprechen auf therapeutische Interventionen widerspiegelt1. Für Krankheiten, die das Zentralnervensystem (ZNS) betreffen, stellen Analysen des Liquors eine einzigartige Möglichkeit dar, Biomarker in einem Medium zu messen, das in direktem Kontakt zum erkrankten Organ steht. Während konventionelle Magnetresonanztomographiemethoden (MRT-Methoden) vor allem das Endstadium von Gewebedestruktion visualisieren, können Biomarker auf molekularer Ebene fortlaufende, spezifische pathophysiologische Prozesse widerspiegeln1.
Zunehmende Behinderung durch MS ist zu einem großen Teil durch den irreversiblen Verlust von Axonen bedingt. Aus diesem Grund könnten Marker, die diesen Prozess anzeigen, potenzielle Bedeutung als Prädiktoren für die Krankheitsprogression haben. Dies ist umso mehr von Bedeutung, als axonale Destruktion offensichtlich bereits in sehr frühen Phasen der Erkrankung auftreten kann2, 3. Mögliche Kandidatenmarker sind daher die zytoskelettalen Neurofilamentproteine.
Aufbau und Struktur
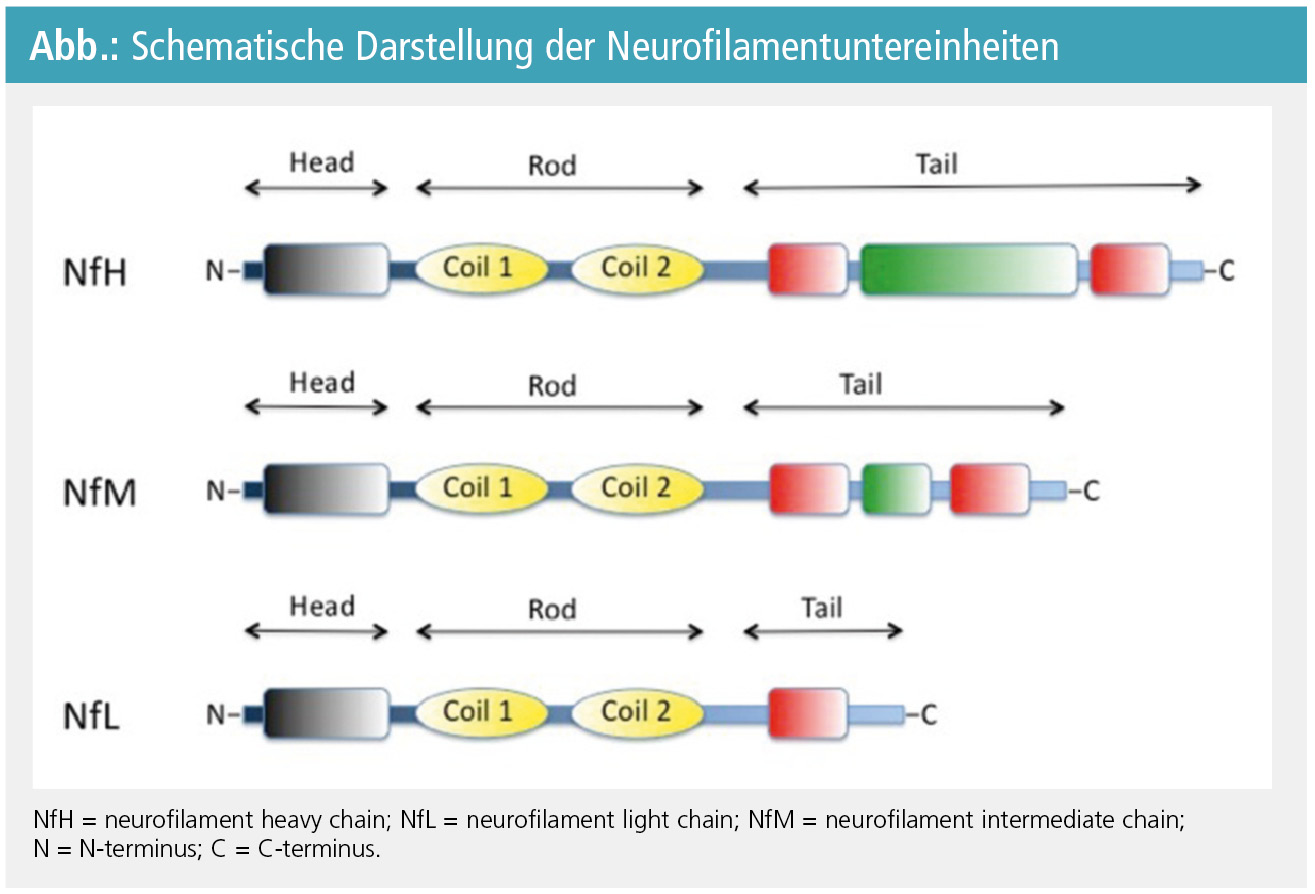
Neurofilamente stellen die Hauptkomponente des axonalen Zytoskeletts dar. Es gibt drei unterschiedlich große Untereinheiten: neurofilament light chain (NfL; 68 kDa), neurofilament intermediate chain (NfM; 150 kDa) und neurofilament heavy chain (NfH; 190 bis 210 kDa; Abb.). Jede Neurofilamentuntereinheit besteht aus einer doppelsträngigen alpha-helicalen hochkonservierten Region, die von einem N-terminalen Kopf- und einem C-terminalen Schwanzende begrenzt wird (Abb.). Neurofilamente sind stark phosphorilierte Proteine, wobei das Ausmaß der Phosphorilierung den axonalen Durchmesser bestimmt4.
Werden Axone infolge neurodestruktiver Vorgänge beschädigt, kommt es zur Freisetzung zytoskelettaler Proteine in den Extrazellularraum und in weiterer Folge in den Liquor cerebrospinalis und ins Blut1. Über Messung der Konzentration von Neurofilamenten im CSF und Blut kann indirekt das Ausmaß der axonalen Destruktion im Zentralnervensystem (ZNS) bei MS, aber auch bei anderen neurodegenerativen Erkrankungen abgeschätzt werden5.
Klinische Studien
Einige Studien konnten bei MS-PatientInnen, die zum Zeitpunkt der Probenentnahme eine akute Verschlechterung des Krankheitszustandes hatten, höhere Konzentrationen von NfL nachweisen als bei denjenigen, die gerade klinisch stabil waren. Weiters waren höhere NfL-Werte mit dem Ausmaß kontrastmittelaufnehmender Läsionen, dem Vorhandensein von oligoklonalen Banden und der Zellzahl im CSF korreliert. Darüber hinaus ergaben sich Hinweise, dass die Höhe der NfL-Werte im CSF mit dem Konversionsrisiko einer MS-Erstmanifestation (klinisch isoliertes Syndrom) zu klinisch definitiver MS vergesellschaftet ist1.
Höhere NfH-Werte konnten bei PatientInnen mit schubhaft-remittierender und sekundär progredienter MS im Vergleich zu Kontrollen gefunden werden. Konsistent konnte in mehreren Studien gezeigt werden, dass höhere NfH-Werte mit Krankheitsprogression, gemessen anhand der Expanded Disability Status Scale (EDSS), korrelieren1. Allerdings gibt es bis jetzt noch keine Untersuchungen, ob erhöhte Neurofilamentwerte mit der Entwicklung von Gehirnatrophie assoziiert sind.
Im Gegensatz zu NfL und NfH wurde die Wertigkeit von NfM bis jetzt nur sehr wenig beforscht.
Therapie-Monitoring
Zwei kürzlich publizierte Studien weisen darauf hin, dass über die Bestimmung von Neurofilamenten im CSF oder Blut auch der Behandlungserfolg immunmodulierender Therapien oder die Nebenwirkungen aggressiver therapeutischer Interventionen monitorisiert werden könnten.
Gunnarsson et al. untersuchten bei 92 schubhaft-remittierenden MS-PatientInnen, ob die immunmodulierende Therapie mit dem monoklonalen Antikörper Natalizumab Einfluss auf Gewebedestruktion, gemessen anhand von CSF-NfL-Werten, hat6. Es wurden CSF-Proben vor Natalizumab-Therapie sowie nach 6 und 12 Monaten Therapiedauer asserviert. NfL-Werte wurden mit einem hochsensitiven Nachweisverfahren (enzyme-linked immunosorbent assay; ELISA) bestimmt. Die Therapie mit Natalizumab führte zu einer dreifachen Reduktion von CSF-NfL-Werten von im Mittel 1,300 (SD 2,200) auf 400 (SD 270) ng/l (p < 0,001). Die Werte unter Natalizumab-Therapie waren mit denjenigen von gesunden Kontrollpersonen (Mittelwert 350 ng/l; SD 170; n = 28) vergleichbar.
Die AutorInnen schlossen aus den Studienergebnissen, dass eine hochwirksame anti-inflammatorische Therapie das Ausmaß axonaler Destruktion verringern und somit permanenter physischer Behinderung vorbeugen kann6.
In einer prospektiven Studie untersuchten Petzold et al., ob chemotherapeutische Interventionen zu akuter Neurotoxizität führen können7. In dieser Studie wurden 14 PatientInnen mit sekundär progredienter MS (SPMS) und 17 PatientInnen mit hämatologischen Erkrankungen analysiert, die chemotherapeutisch behandelt wurden, um sich in weiterer Folge einer Knochenmarkstransplantation zu unterziehen. Als Kontrollgruppe wurden 14 SPMS-PatientInnen und 14 gesunde ProbandInnen eingeschlossen. Unmittelbar nach Verabreichung der Chemotherapie zeigten sich erhöhte Serum-NfH-Werte bei 79 % der SPMS-PatientInnen (p < 0,0001) und bei 41 % der PatientInnen mit hämatologischen Erkrankungen (p < 0,01). Somit konnte gezeigt werde, dass akute Neurotoxizität als unerwünschte Nebenwirkung von aggressiver Chemotherapie auftreten kann7.
Klinische Anwendbarkeit
Verbesserte Testsysteme mit hoher Sensitivität und Spezifität sind die Voraussetzung für die klinische Anwendbarkeit von Neurofilamenttestsystemen8, 9.
Bevor die Bestimmung von Neurofilamenten klinische Anwendbarkeit findet, müssen ein paar technische Aspekte in Betracht gezogen werden. Ein häufig beobachtetes Problem ist das Auftreten des so genannten „hook effect“, der durch die Aggregation von Neurofilamentproteinen verursacht wird und eine Verfälschung des Messergebnisses zur Folge haben kann10. Die Bildung von Proteinaggregaten kann durch Präinkubation der zu testenden Probe mit einem mit Harnstoff-Kalzium angereicherten Buffer10 oder durch weitere Verdünnung der Probe unterbunden werden1.
Ein weiterer wichtiger Punkt betrifft präanalytische Faktoren einschließlich Aufbewahrungstemperatur der Probe bis zum Zeitpunkt der Messung. Proteinstabilität ist eine essenzielle Voraussetzung für adäquate Messergebnisse. Diese ist allerdings nicht gewährleistet, wenn die Proben bis zum Zeitpunkt der Messung z. B. bei 4 °C gelagert und nicht wie empfohlen bei –80 °C eingefroren werden11.
Viele Studien konzentrieren sich auf die Etablierung eines Biomarkers im CSF, da damit die unmittelbare Nähe zum ZNS-Gewebe gegeben ist. Nachteilig ist jedoch, dass durch die relative Invasivität der Lumbalpunktion selten Follow-up-Untersuchungen durchgeführt werden können. Aus diesem Grund wäre die Etablierung eines Serumtests zur Detektierung von Neurofilamenten vor allem für Follow-up-Untersuchungen von großer Bedeutung1.
Antikörper gegen Neurofilamente
Im experimentellen Setting konnte gezeigt werden, dass Autoantikörper (Ak), die gegen axonale und neuronale Strukturen gerichtet sind, Axonschädigung induzieren können12. Solche autoreaktiven Antikörper könnten durch Antigenverwandschaft („molekulares Mimikry“) oder durch eine immunologische Reaktion auf Gewebebruchstücke, die nach einer immunologischen Schädigung des ZNS in die Peripherie gelangt sind, entstehen13.
In einer Studie an 21 schubhaft-remittierenden, 20 sekundär-progredienten und 10 primär-progredienten MS-PatientInnen konnte gezeigt werden, dass CSF-Neurofilament-Ak mit dem Ausmaß an Hirnatrophie korrelierten14. Höhere Anti-Neurofilament-Ak wurden bei progredienter MS gefunden15, 16. Allerdings konnte diese Assoziation in einer rezenten Publikation nicht bestätigt werden17. Widersprüchliche E
rgebnisse gibt es zur Korrelation von Anti-Neurofilament-Ak mit klinischen Daten1.
Ausblick
Neurofilamente sind potenzielle Biomarker für axonale Schädigung und Neurodegeneration bei MS. Bevor die Testung von Neurofilamenten für den klinischen Alltag empfohlen werden kann, müssen noch weitere Schritte der Biomarkeretablierung unternommen werden. Mögliche Variationen von unterschiedlichen Testsystemen in Bezug auf Sensitivität und Spezifität sollten an unterschiedlichen Zentren untersucht werden. Es ist vorteilhaft, solch eine Testung über ein internationales Konsortium, wie z. B. das BioMS-eu-Netzwerk, durchzuführen. Um Proteinstabilität im gewonnenen Probenmaterial zu gewährleisten, sollten standardisierte Aufbewahrungsvorgaben etabliert werden. Im nächsten Schritt wird es dann notwendig sein, die klinische Wertigkeit von Neurofilamentbestimmungen in randomisierten klinischen Studien zu bestätigen. Bis dahin sind Neurofilamente jedenfalls als wichtiger Fokus der Biomarkerforschung bei MS anzusehen.