Funktionelle Magnetresonanztomographie (fMRT)
Seit den ersten Arbeiten zu den Grundlagen der fMRT 1990 (Ogawa et al.) zeigt sich ein jährlich nahezu exponenziell zunehmender Einsatz dieser Methode in verschiedensten Forschungsgebieten und Applikationen in der klinischen Neurologie, Neurochirurgie, Neuropsychologie, Rehabilitationsforschung oder Psychiatrie, wobei gegenwärtig auch zunehmend unerwartete Gebiete beschritten werden, wie etwa beim Versuch der Verwendung der fMRT als Lügendetektor, in der Sexualforschung oder Werbepsychologie.
Da sich viele der obengenannten Aussagen primär auf Forschungsaspekte beziehen, sollen im folgenden Beitrag klinische Errungenschaften dieser Methode beleuchtet werden. Dabei werden etablierte klinische Anwendungen ebenso erörtert wie Einsatzgebiete an den Schnittstellen zwischen Forschung und klinischer Anwendung, da hier zukünftige Fortschritte realistischerweise zu erwarten sind und oftmals neue Applikationen erst durch diesen Zugang erschlossen werden. Dies bezieht sich u.a. auf den Einsatz der fMRT zur Evaluation der Effekte klinischer Interventionen oder von Medikamenten, aber auch zur frühzeitigen Detektion funktioneller Netzwerkstörungen bei neurologischen Erkrankungen mit potenziell prognostischer Implikation, wie etwa bei Morbus Alzheimer. Eine Diskussion der Limitationen der fMRT im klinischen Kontext rundet diese Betrachtungsweise ab, welche mit einem Ausblick auf Trends und zukünftige Entwicklungen endet.
Gegenwärtige klinische Einsatzgebiete der fMRT
Prächirurgische Funktionslokalisation
In den letzten Jahren hat sich die fMRT an spezialisierten Zentren zu einem wesentlichen Standbein der nichtinvasiven prächirurgischen Diagnostik entwickelt. Vor neurochirurgischen Eingriffen sollte die Lage essenzieller kortikaler Areale (z.B. für Motorik, Sprache, Gedächtnis) sowie deren Faserverbindungen in Relation zur Hirnpathologie möglichst genau bekannt sein. Diese Informationen haben u.a. Konsequenzen für die
- Festlegung des individuell besten therapeutischen Vorgehens (Operabilität?)
- Festlegung invasiver Zusatzdiagnostik (präoperativer Wada-Test? intraoperative kortikale Stimulation? Wachoperation für Sprachfunktionslokalisation?)
- Planung des Operationszugangs und -ziels
- Dauer einer Operation
- Aufklärung der PatientInnen und Angehörigen
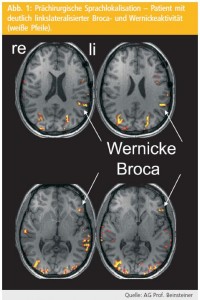
Aufgrund der hohen räumlichen Funktionsauflösung auch komplexer Hirnaktivitäts – muster, der Nichtinvasivität und der beliebigen Wiederholbarkeit steht mit der fMRT eine für klinische Hirnfunktionslokalisationen äußerst leistungsfähige Methode zur Verfügung. Die prächirurgische Indikation betrifft in erster Linie PatientInnen mit zerebralen Raumforderungen oder therapieresistenten Epilepsien. Die klinisch am häufigsten durchgeführten Funktionslokalisationen betreffen Motorik (primäres Hand- bzw. Fußareal?), Sprache (Broca- und/oder Wernicke-Areal?; Abb. 1) und Gedächtnis (Aktivitätsverteilung im medialen Temporallappen?).
Bei entsprechender klinischer Expertise kann mittels fMRT sowohl eine valide Lokalisation als auch Lateralisation dieser Hirnfunktionen – selbst bei massiven Pathologien und eingeschränkter Kooperationsfähigkeit – durchgeführt werden. Mit alternativen nichtinvasiven Techniken (z.B. Elektrophysiologie) lässt sich die hohe fMRT-Lokalisationsqualität derzeit nicht erreichen. Auch aus rein morphologischen Analysen können derartige Funktionsinformationen nicht abgeleitet werden, da makroanatomische Marker nur für wenige essenzielle Hirnfunktionen existieren (z.B. Gyrus praecentralis = Motorik, Heschl-Gyrus = Hören; Sulcus-calcarinus-Bereich = Sehen). Mit Ausnahme der invertierten Omegastruktur als Marker für die primäre sensomotorische Handfunktion ist eine morphologisch begründete Teilfunktionszuordnung innerhalb der makroanatomischen Marker auch nicht möglich (z.B. exakte individuelle Somatotopie?).
Speziell für klinische Fragestellungen existieren weitere erschwerende Faktoren. So können ausgedehnte Pathologien die ursprüngliche Makroanatomie zur Unkenntlichkeit verändern. Auch neuroplastische Umorganisationen (bei längerfristigen pathologischen Prozessen) sowie die hohe neuroanatomische und funktionelle Variabilität des Menschen sind zu berücksichtigen. International gesehen zeigt sich zunehmend die Tendenz, dass hochwertige fMRT-Befunde invasive Diagnostik wie den Wada-Test oder ausgedehnte intraoperative Stimulation verzichtbar machen. Bei entsprechend umfangreicher prächirurgischer Diagnostik wird sogar bei sprachkritischen Raumforderungen an manchen Zentren bereits auf Wachoperationen verzichtet1.
Neue Funktionsdiagnostik
Aufgrund der oben skizzierten Eigenschaften hat die klinische fMRT auch ein hohes Potenzial, neue funktionsdiagnostische Möglichkeiten am individuellen Patienten zu eröffnen. Das betrifft die Analyse neuroplastischer Umorganisationen, die Definition krankheitsspezifischer funktioneller Marker (z.B. Netzwerkveränderungen) oder die longitudinale Beobachtung von Rehabilitationsprozessen und therapeutischen Effekten.
Nachfolgend sind Beispiele hierzu angeführt.
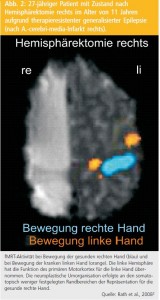
Neuroplastische Umorganisation nach Hemisphärektomie: 27-jähriger Patient mit Zustand nach Hemisphärektomie rechts im Alter von 11 Jahren aufgrund therapieresistenter generalisierter Epilepsie (nach A.-cerebri-media-Infarkt rechts). Die Abbildung 2 zeigt fMRT-Aktivität bei Bewegung der gesunden rechten Hand und bei Bewegung der kranken linken Hand. Die linke Hemisphäre hat die Funktion des primären Motorkortex für die linke Hand übernommen2. Die neuroplastische Umorganisation erfolgte an den somatotopisch weniger festgelegten Randbereichen der Repräsentation für die gesunde rechte Hand.
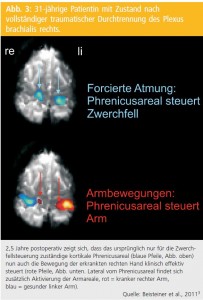
Zentrale Umorganisation als Folge peripherer Umorganisation: 31-jährige Patientin mit Zustand nach vollständiger traumatischer Durchtrennung des Plexus brachialis rechts. Um eine Armbeugefunktion zu er möglichen wurde mittels neuartiger Technik der periphere N.-musculocutaneus-Stumpf mit der Seite des ipsilateralen N. phrenicus konnektiert. 2,5 Jahre postoperativ zeigt sich (Abb. 3), dass das ursprünglich nur für die Zwerchfellsteuerung zuständige kortikale Phrenicusareal nun auch die Bewegung der erkrankten rechten Hand klinisch effektiv steuert. Diese Daten weisen darauf hin, dass motorische Hirnareale auch so umorganisiert werden können, dass sie eine neue Aufgabe zusätzlich zur bestehenden übernehmen und dann beide Aufgaben unabhängig voneinander steuern können. fMRT erlaubt hier den Nachweis des Mechanismus und der Effektivität eines neuen peripheren Therapieverfahrens3.
Die fMRT in der klinisch orientierten neurologischen Forschung
Im Gegensatz zur Grundlagenforschung an Gruppen von ProbandInnen, wie sie etwa federführend seitens der Neuropsychologie intensiv, erfolgreich und durchaus erkenntnisbringend betrieben wird, stellt der Einsatz der fMRT in der klinisch orientierten neurologischen Forschung an PatientInnen darüber hinausgehende spezielle Anforderungen. Zu diesen zählen auf Verhaltensebene kognitive, sensorische oder motorische Beeinträchtigungen, welche die Freiheitsgrade im Hinblick auf einsetzbare Untersuchungsdesigns (fMRT-Paradigmen) limitieren, weiters konfundierende Effekte zentral wirksamer Medikamente (z.B. Antidepressiva), aber auch vaskuläre Faktoren (diffuse mikroangiopathische Marklagerveränderungen, Gefäßstenosen) auf zugrundeliegende Änderungen im fMRT-Signal, und zu guter Letzt hirnmorphologische Veränderungen, die Standardzugänge in der Analyse erschweren, um nur einige zu nennen.
Diese Faktoren erklären sehr wahrscheinlich (neben der oftmals fehlenden Standardisierung der eingesetzten Untersuchungsprotokolle) im Verein mit der Heterogenität der Pathologien auch die zum Teil fehlende Reproduzierbarkeit von Einzelstudien. Dass derartige Probleme bei entsprechender Expertise und Sorgfalt auch auf Einzelfallebene unter hochkomplexen Bedingungen beherrschbar werden, belegen die im vorigen Abschnitt erörterten Fälle eindrucksvoll.
In der Bemühung, auch subtilere Effekte mit möglicher Störpotenz auf die Stabilität relevanter fMRT-Befunde herauszufiltern, kann nunmehr auf Fortschritte in der Analytik größerer Stichproben vor dem Hintergrund verbesserter Rechnerleistungen zurückgegriffen werden. Damit werden nun auch gepoolte Analysen an über 100 Personen möglich. (Das entspricht etwa 100-mal 180 funktioneller Volumina = 360.000 Bildschichten, entsprechend insgesamt 3,6 Milliarden Volumenelementen auf erster gemeinsamer Analysestufe.)
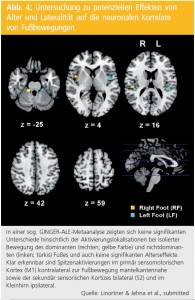
Untersucht wurden Normalpersonen über eine Alterspanne von 18-85 Jahren, um potenzielle Effekte von Alter und Lateralität auf die neuronalen Korrelate von Fußbewegungen zu erfassen. In einer sog. GINGER-ALE-Metaanalyse (Abb. 4), zeigten sich keine signifikanten Unterschiede hinsichtlich der Aktivierungslokalisationen bei isolierter Bewegung des dominanten und nichtdominanten Fußes und auch keine signifikanten Alterseffekte. Klar erkennbar sind Spitzenaktivierungen im primär sensomotorischen Kortex (M1) kontralateral zur Fußbewegung mantelkantennahe sowie der sekundär sensorischen Kortices bilateral (S2) und im Kleinhirn ipsilateral.
Dynamik der Aktivierungsänderungen
Die Dynamik der funktionellen zerebralen Aktivierungsänderungen, “spontan” im Verlauf eines Heilungsprozesses nach erworbener Hirnschädigung oder “induziert” nach bestimmten Interventionen, kann aufgrund der hohen Sensitivität der fMRT aber auch genützt werden, um Einblicke in zentrale Mechanismen der funktionellen Wiederherstellung zu generieren, oder um Konzepte zu den Effekten von Interventionen (Training, Medikamente) auch in kleineren Gruppen von Individuen zu prüfen (sog. “Proof-of-concept”-Studien). Dieser Punkt soll anhand zweier Beispiele unterschiedlicher neurologischer Erkrankungen illustriert werden: Zum einen beim Schlaganfall – als Modellerkrankung für fokale Gewebsschädigung an strategischer Lokalisation – und zum anderen bei multipler Sklerose (MS), als Modellerkrankung für chronische Akkumulation multilokulärer Gewebsalterationen unterschiedlichen Destruktionsgrades in verschiedenen Kompartimenten.
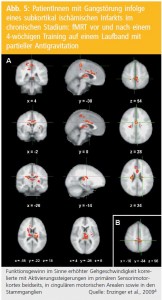
Beispiel Schlaganfall: So sind etwa die zentralen Mechanismen, die der erfolgreichen motorischen Rehabilitation nach einem Schlaganfall zugrunde liegen, bislang nur unzureichend bekannt. Vertiefende Einblicke in die pathophysiologischen Grundlagen funktioneller Wiederherstellung nach Schädigung des Gehirns können rein auf Basis klinischer Untersuchungen und Skalen nicht erwartet werden. Dies limitiert wiederum die Entwicklung neurobiologisch fundierter, neuartiger Ansätze zur Neurorehabilitation. Im Versuch, die limitierte Datenlage zu den neuralen Korrelaten funktioneller Fortschritte nach aufgabenorientiertem Training der unteren Extremitäten zu verbessern, wurden PatientInnen mit Gangstörung infolge eines subkortikal ischämischen Infarkts im chronischen Stadium nach definiertem Protokoll einem vierwöchigen Training auf einem Laufband mit partieller Antigravitation sowie fMRT vorher und nachher unterzogen4.
Funktionsgewinn im Sinne erhöhter Gehgeschwindigkeit korrelierte hierbei mit Aktivierungssteigerungen im primären Sensorimotorkortex beidseits, in cingulären motorischen Arealen sowie in den Stammganglien (Abb. 5).
Dieser Befund belegt – neben der starken Beteiligung subkortikaler Strukturen an der zentralen Kontrolle des Gehens – trainingsinduzierte kortikale Aktivierungsänderungen. Diese Befunde visualisieren Effekte der Neurorehabilitation und ermutigen zu intensiver Suche nach Möglichkeiten, derartige Pro zesse gezielt zu fördern.
Beispiel MS: Unter Berücksichtigung der oben geäußerten konzeptuellen Unterschiede zeigen sich demgegenüber bei MS in Abhängigkeit vom Erkrankungsstadium weiter reichende Netzwerkaktivierungen, etwa in Reaktion auf kognitive Anforderungen5. In einem “Go-/No-go”-Paradigma ließen sich zunehmende Abweichungen vom Aktivierungsmuster der Kontrollen mit Progression der Erkrankung beobachten (s.a. neurologisch 3/11, Schwerpunktthema MS).
PatientInnen benötigten im Allgemeinen bereits bei leichteren kognitiven Aufgaben mehr neuronale Ressourcen als Kontrollen. MS-PatientInnen mit schubförmigem Verlauf wiesen zudem weitere Mehraktivierungen auf (im Precuneus, parietal und im rechten Gyrus fusiformus) und konnten auch den Hippocampus bei zunehmender Komplexität der Aufgabe rekrutieren. Patientinnen mit sekundär-progredienter MS wiederum wiesen die funktionell profundesten Störungen auf und aktivierten auch Areale außerhalb des bei Gesunden charakterisierten Netzwerks. In dieser Gruppe wurde auch der Verlust der Fähigkeit beobachtet, mit zunehmender Aufgabenschwierigkeit zusätzliche Hirnareale zur Bewältigung der Aufgabe heranzuziehen, was als möglicher Ausdruck reduzierter neuronaler Reserve interpretiert werden kann. Dies belegt adaptive Änderungen neuronaler Aktivierung mit Progression der MS, mit zumindest anfänglich kompensatorischer Natur.
Inwieweit diese Erkenntnisse zukünftig klinisch auch am einzelnen Patienten genutzt werden können, ist derzeit nicht absehbar. Das übergeordnete Forschungsziel liegt jedoch darin, zuerst die Mechanismen der funktionellen Wiederherstellung nach Schädigungen des ZNS näher zu ergründen. In einem weiteren Schritt sollten dann neurobiologisch fundierte Trainingstechniken sowie neue Therapieansätze zur Förderung neuronaler Plastizität und Reparatur definiert werden. In Zukunft könnte es schließlich möglich sein, die fMRT überdies zur Beurteilung der individuellen Erfolgschancen einer Behandlung, aber auch für Aussagen zu deren optimaler Intensität und Dauer heranzuziehen.
Grenzen der Methode
Neben den oben dargestellten Vorzügen der fMRT muss darauf hing
ewiesen werden, dass die klinische Anwendung der Methode nach wie vor sehr aufwändig und komplex ist und daher spezielle Expertise erfordert. Um klinisch valide Befunde erstellen zu können, sind zahlreiche Faktoren zu berücksichtigen. Einerseits hängt das funktionelle Ergebnis von patientengerechter Aufgabenauswahl und guter Patientenkooperation ab. Andererseits muss die technische Datenqualität adäquat sein und die Vielzahl möglicher Artefakte berücksichtigt werden. Im Bereich der Datenauswertung existiert eine Fülle von Methoden, deren Vor- und Nachteile von der klinischen Arbeitsgruppe gut gekannt werden sollten, damit sie optimiert eingesetzt werden können.
Wichtig ist auch zu berücksichtigen, dass das klassische fMRT-Signal (BOLD-Signal) einerseits nur den venösen Schenkel aktiver Hirnregionen erfasst und andererseits nicht direkt neuronale Aktivität, sondern vielmehr eine Änderung der lokalen Sauerstoffkonzentration darstellt. Das Signal ist daher von der neurovaskulären Kopplung und dem Zustand des Gefäßsystems abhängig. Auch die Signalinterpretation ist nicht immer einfach, da “lokale Hirnaktivität” unterschiedliche neuronale Aktivität repräsentieren kann (erregende Aktivität, hemmende Aktivität, unterschwellige lokale Aktivität, Top-down-Modulation, Bottom-up-Modulation).
Im Gegensatz zu neurowissenschaftlichen Studien, bei denen Gruppen von Versuchspersonen unter Laborbedingungen untersucht werden, wird die prächirurgische fMRT immer an einzelnen PatientInnen mit dem Ziel einer individuellen “neurofunktionellen MR-Diagnose” durchgeführt. Daher müssen klinisch erprobte Paradigmen zum Einsatz kommen und die Daten standardisiert gemessen, verarbeitet und ausgewertet werden, was mit erheblichem Aufwand verbunden ist.
Insbesondere auf die Standardisierung der fMRT wird in Zukunft noch vermehrt Aufmerksamkeit gelegt werden müssen. In diese Richtung gehen auch Bemühungen der Österreichischen Gesellschaft für fMRT (ÖGfMRT), die in multizentrischen Studien demonstrieren konnte, dass zentrumsspezifische Effekte beherrschbar sind. Daran knüpft sich die Hoffnung, klinisch relevante Fragestellungen (wie etwa die Optimierung der Behandlung von Hirntumoren oder der Neurorehabilitation bei einem Schlaganfall) multizentrisch via Daten-Pooling und Rekrutierung hinreichend großer Kollektive (auch bei selteneren Erkrankungen oder eng definierten Gruppen) hinkünftig rascherer Beantwortung zuführen zu können.
Ausblick – Trends und Zukunftsperspektiven
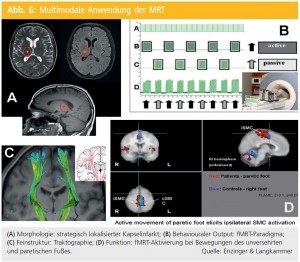
Gegenwärtig zeigt sich ein Trend zu multimodaler Anwendung der MRT, unter Einbeziehung der Information aus struktureller MRT, Diffusions- und Perfusions-MRT, BOLD-fMRT, MR-Spektroskopie und MR-Angiographie. Bereits jetzt praxisrelevant ist die Kombination von fMRT und DTI-Traktographie bei Hirntumoren, wodurch in einer Untersuchung funktionell relevante Aktivierungen, verbundene Faserzüge und deren Verdrängung durch die Expansion dargestellt werden können. Aus der Kombination dieser Methoden lassen sich wesentliche objektive Zusatzinformationen ableiten, wie Quantifizierung von Gewebsschädigung, regionale Atrophie spezifischer Funktionssysteme, Rarefizierung oder Degeneration von Traktsystemen (Abb. 6).
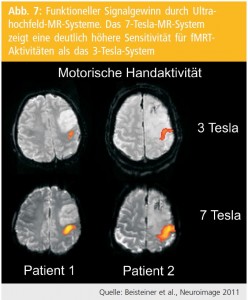
Hinsichtlich technischer Faktoren zeigt sich ein Trend, vermehrt Hochfeld-MR-Systeme einzusetzen (inkl. Ultrahochfeldsysteme > 3 Tesla). Hiervon ist ein besseres Signal-zu-Rausch-Verhältnis zu erwarten, allerdings ist auch die Artefaktproblematik verstärkt. Eine erste klinische Vergleichsstudie zu möglichen Benefiten durch Ultrahochfeldsysteme hat Patientendaten von 3-Tesla- und 7-Tesla-Systemen verglichen und eine höhere Sensitivität für Hirnaktivitätsdarstellung durch das 7-T-System erbracht (Abb. 7).
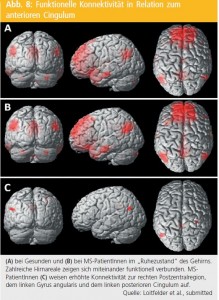
Wesentliche technische Fortschritte sind auch durch den zunehmenden Einsatz von Mehrkanalspulen sowie die Verbesserung der Gerätehardware (bessere Magnetfeldhomogenität, schnellere Gradientenschaltzeiten) erkennbar. Bezüglich untersuchbarer Hirnfunktionen ist ein internationaler Entwicklungsschwerpunkt die Darstellung von Netzwerkverknüpfungen (Konnektivitätsanalysen), wobei es möglich ist, auch die Veränderung von spontanen Hirnaktivitäten – welche ohne Aufgabenbelastung für die PatientInnen in Ruhe auftreten (Ruhenetzwerke) – künftig potenziell diagnostisch nutzbar zu machen (Abb. 8).
Unter Verwendung dieser Techniken ist ein wesentliches Entwicklungsziel gegenwärtiger klinischer fMRT-Forschung, neue funktionelle Biomarker zu generieren, welche die Differenzialdiagnostik neurologischer Erkrankungen und die Durchführung von Therapie- bzw. Pharmakostudien erleichtern. Aktuelle Ergebnisse einer österreichischen multizentrischen Patientenstudie erlauben beispielsweise, die für multizentrische fMRT-Therapiestudien optimalen Stichprobengrößen erstmals relativ exakt abzuschätzen. Neben “singletrial fMRI” mit paradigmenfreien Messungen ohne zeitliche und örtliche Vorannahmen und EMG-Korrelation zur exakten Erfassung der funktionellen Organisation von Motorik sind als weitere zukünftige Trends Neuro-Feedback über Echtzeit-fMRT und “PharmakofMRT” erkennbar.
Die federführende Mitwirkung und teils Themenführerschaft von NeurologInnen in einem genuin interdisziplinären Forschungsnetzwerk sollte dabei garantieren, dass im Zentrum dieser Forschungsbemühungen stets das Individuum mit (drohendem oder bestehenden) Funktionsverlust durch Erkrankung des Nervensystems sowie die Suche nach Möglichkeiten zur verbesserten Behandlung klinisch relevanter Probleme stehen und damit ein klinischer Fokus erhalten bleibt.
1 Vortrag Prof. Rössler, Neurochirurgie, Universitätsklinikum Erlangen, 11. Österr. fMRT-Symposium, 10. 12. 2011 Wien).
2 Rath J, Schmidhammer R, Steinkellner T, Klinger N, Geissler A, Beisteiner R, Evaluation of functional cortex for the diseased hand in a patient after hemispherectomy. Arch Neurol 2008; 65(12):1664-5.
3 Beisteiner R, Höllinger I, Rath J, Wurnig M, Hilbert M, Klinger N, Geissler A, Fischmeister F, Wöber C, Klösch G, Millesi H, Grisold W, Auff E, Schmidhammer R, New type of cortical neuroplasticity after nerve repair in brachial plexus lesions. Arch Neurol 2011; 68(11):1467-70.
4 Enzinger C, Dawes H, Johansen-Berg H, Wade D, Bogdanovic M, Collett J, Guy C, Kischka U, Ropele S, Fazekas F, Matthews PM, Brain activity changes associated with treadmill training after stroke. Stroke 2009 Jul; 40(7):2460-7 .
5 Loitfelder M, Fazekas F, Petrovic K, Fuchs S, Ropele S, Wallner-Blazek M, Jehna M, Aspeck E, Khalil M, Schmidt R, Neuper C, Enzinger C, Reorganization in cognitive networks with progression of multiple sclerosis: insights from fMRI. Neurology 2011; 76(6):526-33.
Weitere Literatur bei den Verfassern
Für Informationen zu österreichischen fMRT-Zentren sowie zur Methode siehe www.oegfmrt.org