Parasomnien: Arousal- und REM-Schlaf-assoziierte Störungen
Die 2. Ausgabe der Internationalen Klassifikation für Schlafstörungen unterscheidet 3 Gruppen von Parasomnien: die Gruppe der Arousal-Störungen, früher auch als Non-REM-Parasomnien bezeichnet, die Gruppe der REM-Schlaf-assoziierten Parasomnien und die Gruppe der anderen Parasomnien1, die schlafbezogenen dissoziativen Störungen, Enuresis nocturna, Katathrenie, das Exploding-Head-Syndrom, schlafbezogene Halluzinationen sowie schlafbezogene Essstörungen umfasst. In der folgenden Übersicht soll auf die Gruppe der Arousal-Störungen sowie die Gruppe der REM-Schlaf-assoziierten Parasomnien eingegangen werden. Die beiden prominentesten Vertreter dieser beiden Gruppen sind der Somnambulismus und die REM-Schlaf Verhaltensstörung (REM sleep behavior disorder, RBD), welche als potenzielles nichtmotorisches Frühzeichen einer neurodegenerativen Erkrankung gilt, wie Langzeit-Follow-up-Studien mittlerweile zeigen konnten2–4.
Somnambulismus und andere Arousal-Störungen
Die Arousal-Störungen umfassen „Confusional Arousals“, Somnambulismus und Pavor nocturnus1. Häufig sind PatientInnen von mehr als nur einer Arousal-Störung betroffen.
Epidemiologie: Arousal-Störungen treten häufig – mit bis zu 17 % – bei Kindern und Jugendlichen auf5. Bei Erwachsenen nimmt ihre Prävalenz auf 4,2 % ab6. In vielen Fällen berichten Betroffene über eine positive Familienanamnese. Eine Geschlechtspräferenz ist nicht beschrieben5, 6.
Klinik: Somnambulismus umfasst komplexe Verhaltensweisen, die üblicherweise post-arousal aus Schlafstadium N3 auftreten. Aufstehen, das Bett oder das Schlafzimmer verlassen und sogar noch komplexere Verhaltensweisen kommen dabei vor. Wird ein/eine PatientIn während des Schlafwandelns erweckt, reagiert dieser/diese häufig nicht adäquat, was über mehrere Minuten andauern kann. Die Augen während des Schlafwandelns sind meist weit geöffnet. Erinnerung an Traumsequenzen kann vorhanden sein. Bei „Confusional Arousals“ handelt es sich um eine verzögerte Aufwachreaktion, bei der beim Erwachen aus dem Schlaf volle Orientierheit und Wachheit über längere Zeit nicht gegeben ist. In diesem Zwischenzustand kann es zu unkontrollierbarem Verhalten kommen, ohne dass das Bett dabei im Gegensatz zum Somnambulismus verlassen wird. Die Sexsomnia stellt eine in den letzten Jahren zunehmend beachtete Unterform dar7. Pavor-nocturnus-Attacken sind durch ein abruptes Erwachen aus N3-Schlaf gekennzeichnet und gehen häufig mit Aufschreien und vegetativen Symptomen wie Tachykardie und Tachypnoe einher. Über die Episode besteht bei den Betroffenen eine Amnesie. Im Gegensatz zu Albträumen besteht in vielen Fällen keine oder nur eine eingeschränkte Traumerinnerung.
Ätiologie: Arousal-Störungen liegt eine Schlaf-Wach-Dissoziation zugrunde. Im Einklang mit dieser Hypothese zeigte eine SPECT-Untersuchung während einer Schlafwandelepisode eine Aktivierung thalamo-cingulärer Bahnen, während die Deaktivierung anderer thalamo-kortikaler Projektionen persistierte8. Auch wissen wir von kortikalen EEG-Ableitungen im Rahmen von intensivem Video-EEG-Monitoring, dass selbst bei gesunden Schläfern simultan Elemente von Wachzustand und Schlaf in unterschiedlichen Hirnarealen zur Darstellung kommen9.
Häufig liegt eine positive Familienanamnese vor. Der Nachweis eines genetischen Einflusses erfolgte in einer finnischen Zwillingskohortenstudie, die eine Konkordanzrate von 0,55 für monozygote und 0,35 für dizygote Zwillinge erbrachte10. Weiters wurde 2003 eine Assoziation mit dem HLA-Locus DQB1*0501 nachgewiesen11. Erst kürzlich wurde eine Assoziation auf Chromosom 20q12-q13.12 entdeckt12, deren Bestätigung bis dato noch ausständig ist.
Diagnostik: Die Diagnose einer Arousal-Störung kann nach den aktuell gültigen Diagnosekriterien rein aufgrund der Eigen- und Fremdanamnese gestellt werden. Die Durchführung einer Polysomnographie ist bei einer erst im Erwachsenenalter beginnenden Arousal-Störung aufgrund des differenzialdiagnostischen Spektrums indiziert. Weitere Gründe für eine polysomnographiebasierte Diagnostik sind Hinweise auf andere Schlafkomorbiditäten, wie z. B. ein obstruktives Schlafapnoesyndrom, da bekannt ist, dass Arousal-Störungen diese aggravieren13, außerdem erhöhte Tagesschläfrigkeit sowie potenziell zu Verletzungen führende Manifestationen.
Die Epilepsie ist eine der wichtigsten Differenzialdiagnosen. Aus diesem Grunde sollte bei entsprechendem Verdacht eine erweiterte EEG-Montage nach dem 10-20-System angewendet werden. Auch ist die Ableitung mehrerer Polysomnographienächte zu empfehlen, da parasomnische Ereignisse nicht täglich auftreten. Um die Wahrscheinlichkeit zu erhöhen, ein parasomnisches Ereignis aufzuzeichnen, können Schlafdeprivation und forciertes Aufwachen in das polysomnographische Set-up implementiert werden14.
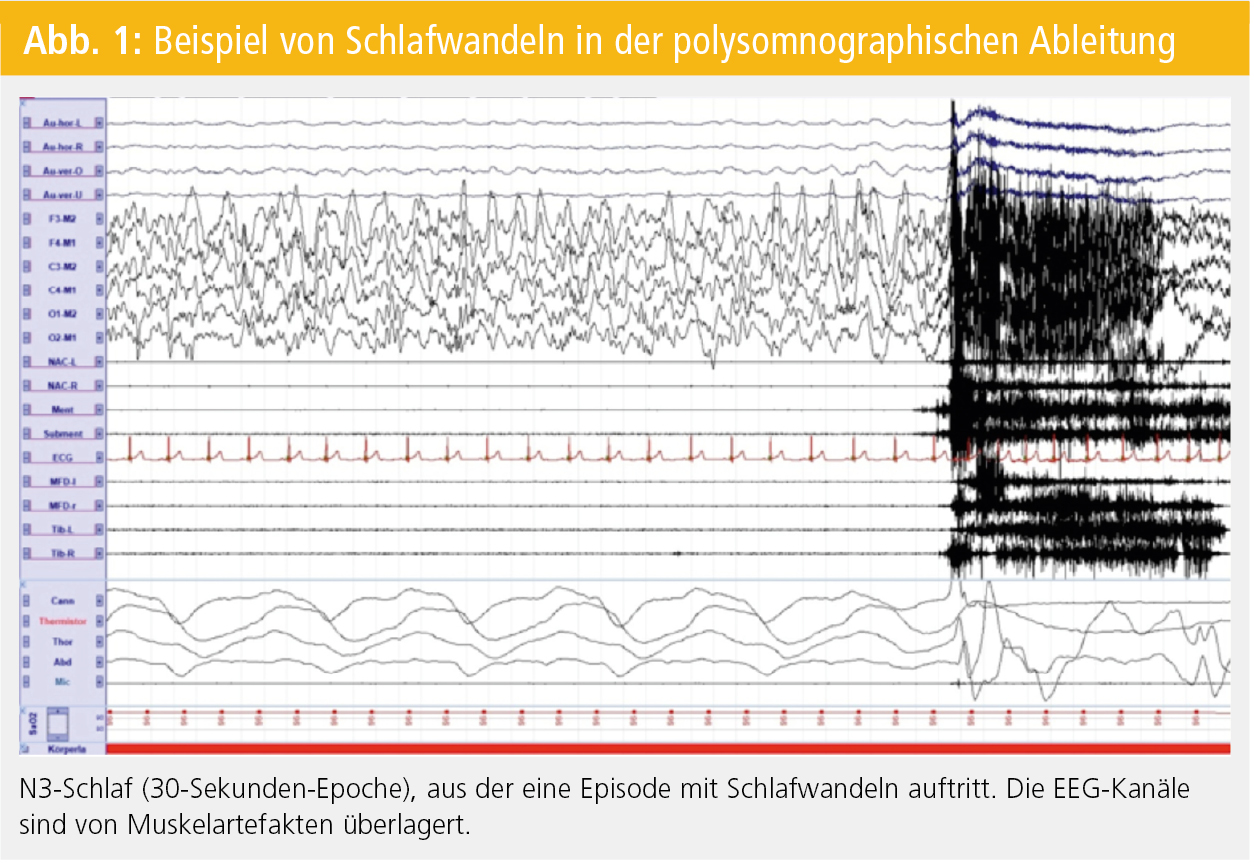
Weiters ist zum Ausschluss einer sekundären Parasomnie eine zerebrale Bildgebung anzuraten. Ebenso sollte die Diagnostik ein Wach-EEG beinhalten. Üblicherweise treten Parasomnien im ersten Nachtdrittel meist nach einem Arousal aus Schlafstadium N3 auf. Abbildung 1 stellt ein polysomnographisches Beispiel einer Schlafwandelepisode aus N3 dar. Nicht selten findet sich im Post-Arousal-EEG ein partielles oder komplettes Anhalten von Schlaf mit diffuser oder rhythmischer Delta-Aktivität. In Nächten, in denen keine parasomnischen Episoden registriert werden, sind multiple Arousals aus N3 hinweisend auf eine Parasomnie. Andererseits schließt auch eine unauffällige Polysomnographie eine Arousal-Störung nicht aus.
Differenzialdiagnosen: Das differenzialdiagnostische Spektrum umfasst andere Parasomnien, insbesondere die REM-Schlaf-Verhaltensstörung oder dissoziative Störungen. Nächtliche Epilepsien, insbesondere frontomesiale bzw. in selteneren Fällen temporomesiale Epilepsien, sind die kritischsten Differenzialdiagnosen. Epilepsietypische Potenziale im EEG sowie sehr häufige und streng stereotype Ereignisse sind als hochgradig verdächtig auf eine Epilepsie zu deuten, ebenso ein apoplektiformes Ende der einzelnen Episoden sowie eine Semiologie mit Kopfversion bzw. dystoner Haltung15.
Management: Von zu betonender großer Bedeutung sind Bettsicherungsmaßnahmen und eine gute Schlafhygiene. Weiters sollten Triggerfaktoren wie Alkohol und Schlafmangel vermieden werden. Auch sollte die Begleitmedikation auf potenziell aggravierende oder induzierende Substanzen bzw. Medikamente überprüft werden. So finden sich insbesondere unter einer Hypnotikagabe mit Zolpidem nicht selten Parasomnien. Wichtig diesbezüglich ist das Eruieren eines zeitlichen Zusammenhangs. Weiters ist mittlerweile gut belegt, dass eine Behandlung der Komorbidität mit einer schlafbezogenen Atmungsstörung zu einer Besserung bzw. Remission einer Arousal-Störung führen kann13. Eine medikamentöse Therapie ist in vielen Fällen nicht erforderlich. Adäquat gepowerte placebo- oder aktiv kontrollierte Studien zur Therapie der Arousal-Störungen fehlen. Für Somnambulismus besteht die beste Evidenz für Benzodiazepine16, 17, 18. Einzelfallberichte existieren für Trizyklika, Paroxetin, Trazodon, Carbamazepin und Phenytoin.
Bezüglich nichtmedikamentöser Therapieoptionen besteht Evidenz für Hypnose zur Therapie von Non-REM-Parasomnien. Diese Evidenz basiert auf offenen kleinen monozentrischen Studien19, 20. Zur Therapie von Pavor nocturnus bei Kindern ist eine kleine monozentrische 6-monatige kontrollierte Studie zu 5-Hydroxytryptophan mit einer Dosierung von 2 mg/kg Körpergewicht publiziert. Nach einer 20-tägigen Behandlungsperiode blieben 84 % der Kinder in der Verumgruppe parasomniefrei, während in der Vergleichsgruppe nur 29 % parasomniefrei waren21.
REM-Schlaf Verhaltensstörung (RBD) und andere REM-Schlaf-assoziierte Parasomnien
In diese Gruppe fallen die wiederkehrende isolierte Schlafparalyse, Albträume und die RBD. Die Schlafparalyse ist gekennzeichnet als zeitlich begrenztes Phänomen mit der Unfähigkeit, sich nach dem Ewachen aus dem Schlaf zu bewegen. Häufig findet sie sich bei NarkolepsiepatientInnen, allerdings tritt auch bei ca. 30 % der normalen Bevölkerung zumindest einmal im Leben eine Schlafparalyse auf1. Therapeutisch kann je nach Leidensdruck eine Medikation mit Antidepressiva, insbesondere Clomipramin unternommen werden. Albträume sind ein sehr häufiges Phänomen mit einer Lebenzeitprävalenz von nahezu 100 %. Bei der RBD handelt es sich um eine komplexe Parasomnie mit Ausagieren von Trauminhalten, deren Spezifikum das Fehlen der physiologischerweise vorhandenen Muskelatonie während des REM-Stadiums darstellt22. Aufgrund des großen Erkenntniszuwachses dieser Erkrankung in den letzten Jahren und der Bedeutung der RBD als prämotorischer Marker einer neurodegenerativen Erkrankung soll im Folgenden näher auf die RBD eingegangen werden.
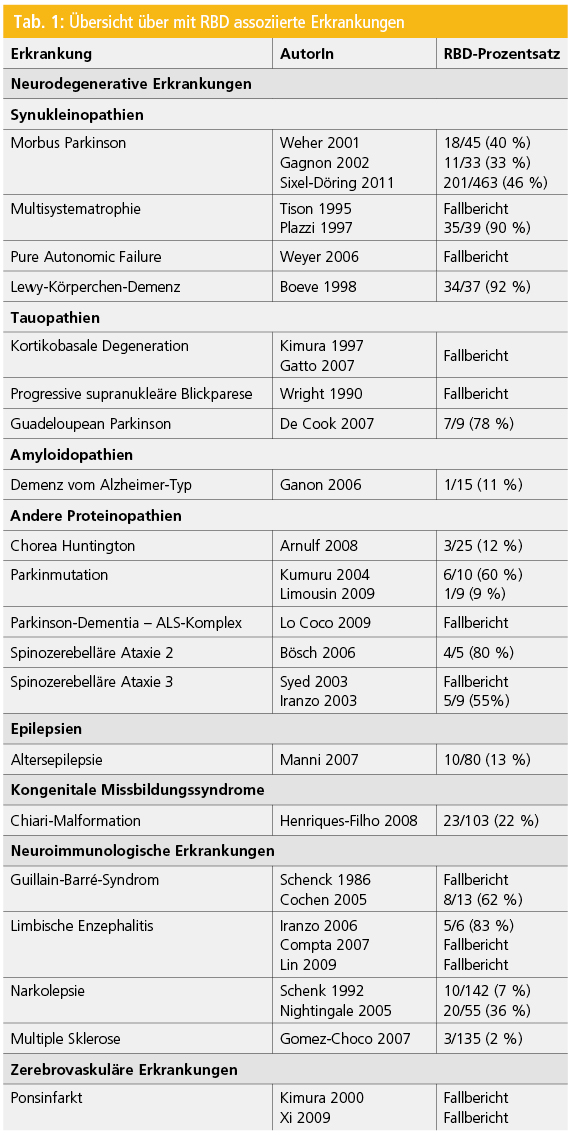
Epidemiologie: Die RBD ist eine seltenere Erkrankung mit einer Prävalenz von ca. 0,5 % in der allgemeinen Bevölkerung23, 24. Im Vergleich dazu findet sie sich sehr häufig mit Angaben in der Literatur von bis zu 46 % bei PatientInnen mit Morbus Parkinson25 und bis zu 92 % bei atypischen Parkinson-Syndromen26, 27. Tabelle 1 liefert einen Überblick über Erkrankungen, die mit RBD assoziiert sind. Von der idiopathischen Form sind mehr Männer als Frauen betroffen22, während bei der symptomatischen RBD kein Gender-Unterschied besteht25.
Klinik: Die RBD ist durch ein Ausagieren von Trauminhalten von häufig gewaltsamem oder aggressivem Inhalt gekennzeichnet. RBD-PatientInnen berichten, sich häufig zur Wehr setzen zu müssen und sind selten der primäre Aggressor. Meist sind die PatientInnen rasch weckbar und erinnern sich häufig an die Trauminhalte, zumindest wenn sie unmittelbar nach einer RBD-Episode geweckt werden. Im Gegensatz zu Non-REM-Parasomnien tritt RBD meist in der 2. Nachthälfte auf. Schwere Verletzungen des Patienten/der Patientin oder des Bettpartners/der Bettpartnerin sind beschrieben.
Idiopathische RBD als Frühsymptom einer neuro-degenerativen Erkrankung
RBD-PatientInnen können als RisikokandidatInnen für neurodegenerative Erkrankungen angesehen werden, nachdem bis zu 80 % im Verlauf eine Parkinson-Erkrankung bzw. eine andere neurodegenerative Erkrankung entwickeln. Mittlerweile ist gut belegt, dass verschiedene klinische und neurodegenerative Biomarker wie diskrete motorische Defizite, Hyposmie, neuropsychologische Funktionsstörungen, gestörtes Farbsehen und autonome Funktionsstörungen selbst bei der noch als idiopathisch zu klassifizierenden RBD vorliegen28–32. Auch findet sich bei bis zu einem Drittel aller PatientInnen mit idiopathischer RBD eine Hyperechogenität der Substantia nigra, welches einen häufigen Befund bei Morbus Parkinson darstellt33.
Ätiologie: Erkenntnisse aus der Tierforschung liefern Hinweise auf eine Lokalisation der RBD im mesenzephalopontinen Hirnstamm. Eine Degeneration einer Subpopulation von REM-on-glutaminergen Neuronen im Bereich des Nucleus sublaterodorsalis führt zu einer Aufhebung der physiologisch vorhanden Atonie während des REM-Schlafes. Ebenso führt auch eine Läsion der glyzinergen/GABA-ergen prämotorischen Neurone des ventralen gigantozellulären retikulären Nucleus in der Medulla oblongata zu REM-Schlaf ohne Atonie34, 36. Passend dazu zeigten sich beim Menschen in rezenten diffusionsgewichteten bildgebenden Studien bei RBD Veränderungen im Bereich des mesenzephalopontinen Hirnstamms36, 37.
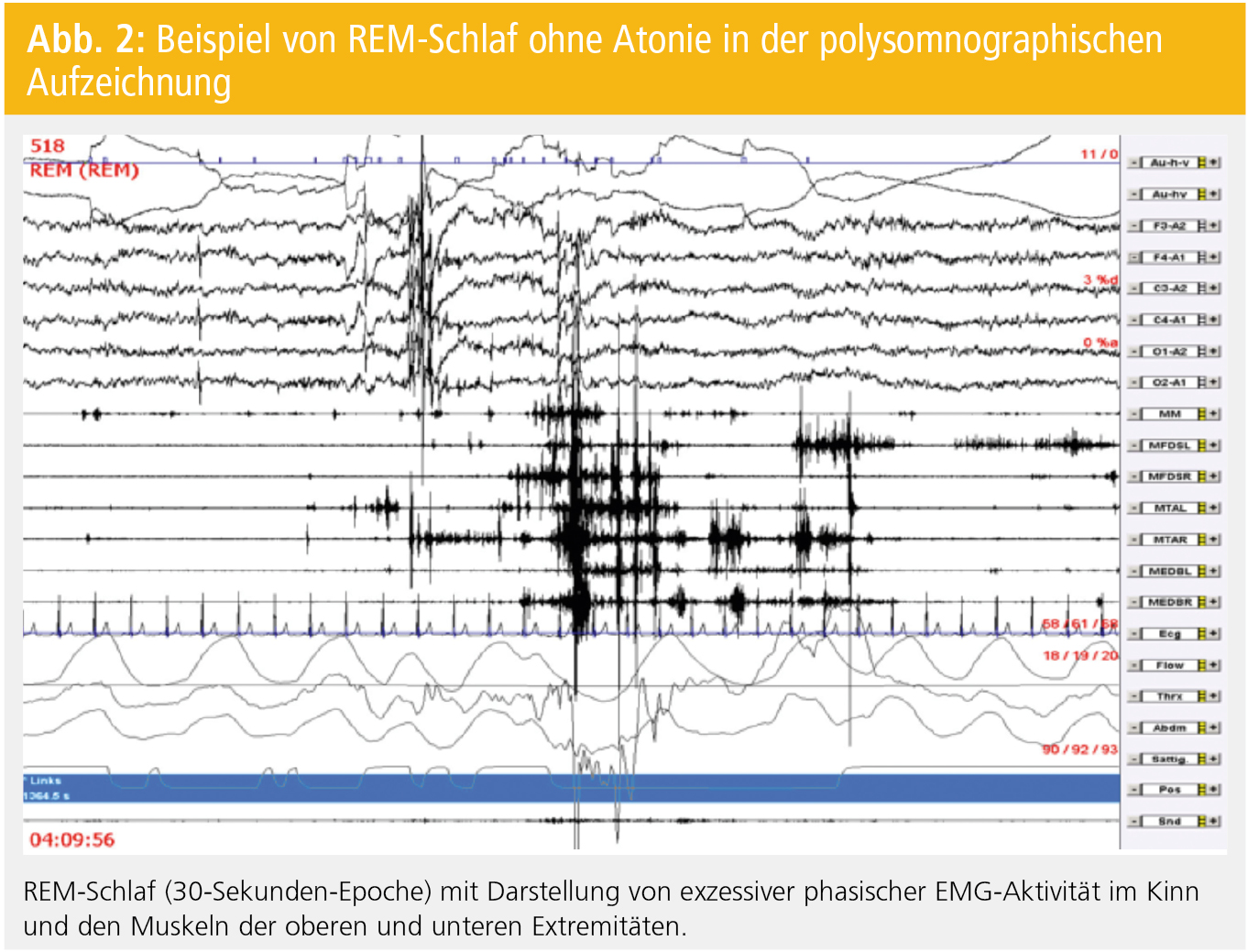
Diagnostik: Entscheidend ist eine detaillierte Anamneseerhebung hinsichtlich des Vorliegens einer RBD, da ansonsten insbesondere milde oder sporadische Fälle leicht übersehen werden können38. Seit Revision der Kriterien der internationalen Klassifikation von Schlafstörungen im Jahr 2005 ist zur definitiven Diagnosestellung einer RBD die Durchführung einer Videopolysomnographie unabdingbar. Die Diagnosekriterien sind in Tabelle 2 wiedergegeben. Abbildung 2 stellt eine 30-Sekunden-Epoche mit REM-Schlaf ohne Atonie dar.
Quantitative EMG-Cut-off-Werte wurden erst kürzlich publiziert und sind noch nicht Bestandteil der aktuell gültigen Diagnosekriterien für RBD39, 40. In beiden Arbeiten ergaben sich EMG-Cut-off-Werte für die Kinnmuskulatur zwischen 15 und 18 %. Da sich allerdings häufig gerade im Bereich der Kinnmuskulatur Artefakte finden und die RBD-typischen Bewegungsentäußerungen meist die Extremitäten mitinvolvieren, ist eine Erweiterung um andere Muskeln zu empfehlen. Es zeigte sich, dass der in der Routinepolysomnographie standardmäßig verwendete M. tibialis schlechter als Muskeln der oberen Extremitäten zwischen RBD und Nicht-RBD differenzierte, sodass, wenn immer möglich, der M. mentalis um einen Muskel der oberen Extremitäten ergänzt werden sollte. Für eine Erweiterung des Mentalis-EMG um die Mm. flexor. dig. sup. an den oberen Extremitäten zeigte sich ein Cut-off-Wert von 32 % (nähere Details siehe neurologisch 2/2012). Zum Ausschluss einer symptomatischen RBD ist immer eine zerebrale strukturelle Abklärung indiziert. Weiters sollte die Diagnostik um ein Wach-EEG komplettiert werden.
Differenzialdiagnosen: Das differenzialdiagnostische Spektrum der RBD reicht von Non-REM-Parasomnien, RBD-Mimics aufgrund von Arousals im Rahmen von schlafbezogenen Atmungsstörungen, nächtlichen epileptischen Anfällen bis zu dissoziativen Störungen1.
Management: Essenziell im Management der RBD ist die Aufklärung über Bettsicherungsmaßnahmen zur Vermeidung von Selbst- oder Fremdverletzungen. Insbesondere sollten Betroffene und ihre Angehörigen darüber aufgeklärt werden, dass die RBD potenziell zu Selbst- oder Fremdverletzungen führen kann. Nach Möglichkeit sollte das Bett so nah am Boden wie möglich sein, ebenso sollte das Bettgestell gepolstert sein und es sollten spitze Gegenstände aus der Bettumgebung entfernt werden. Auch sollten getrennte Betten empfohlen werden.
Weiters sollte die Begleitmedikation von PatientInnen mit RBD auf Medikamente überprüft werden, die als Auslöser bzw. aggravierender Faktor für eine RBD beschrieben wurden. Es handelt sich dabei um trizyklische Antidepressiva, SSRI, MAO-Inhibitoren, SNRI sowie Bisoprolol und Selegilin41. Im Fall eines zeitlichen Zusammenhangs sollte das potenziell auslösende bzw. aggravierende Medikament – wenn immer möglich – abgesetzt werden, bevor eine RBD-spezifische Medikation begonnen wird.
Die Evidenzlage hinsichtlich einer medikamentösen Therapie der RBD ist dürftig und basiert – bis auf eine sehr kleine monozentrische kontrollierte Studie mit 3 mg Melatonin – ausschließlich auf Fallserien bzw. kleinen offenen Studien. Die beste Evidenz besteht für niedrige Dosierungen von Clonazepam22, 42–46 und Melatonin47–50. In der Literatur zeigte sich, dass bis zu 90 % der RBD-PatientInnen unmittelbar auf Dosierungen von 0,5–1 mg ansprechen43 und das Toleranzentwicklungspotenzial vergleichsweise gering ist. Auf die Verschlechterung einer schlafbezogenen Atmungsstörung unter Therapie mit Clonazepam sollte geachtet werden51. Die Evidenz für alle anderen in der Literatur beschriebenen Medikamente basiert auf Fallberichten bzw. kleinen Fallserien und wird teilweise sogar kontroversiell diskutiert (Sodiumoxybat, Levodopa, Pramipexol, Cholinesteraseinhibitoren).