Schlaganfall – auch im Kindesalter ein Thema

Ein Schlaganfall im Kindesalter ist nicht nur für die Betroffenen und ihre Familie ein einschneidendes Ereignis, sondern auch eine Belastung aus sozioökonomischen Gründen. Mit einer Inzidenz von etwa 2–5/100.000 Kinder/Jahr ist er etwa gleich häufig wie der kindliche Hirntumor und zeigt auch eine Mortalität von 5–10 %.1 Knaben sind aus ungeklärten Gründen häufiger betroffen (2 : 1).2 Der kindliche Schlaganfall kann in jedem Alter vorkommen, die Häufung im Vorschulalter wird auf die parainfektiösen/infektiösen Risikofaktoren zurückgeführt. Im Adoleszentenalter sind v. a. auch Systemerkrankungen und onkologische Leiden wichtig. Auch beim kindlichen Schlaganfall gilt „time is brain“, somit handelt es sich um eine pädiatrische Notfallsituation. Nur so können die Kinder innerhalb der notwendigen Zeitgrenzen in ein Zentrum verlegt werden, um die optimalen Therapieoptionen zu evaluieren.
Diagnose
Große Schwierigkeiten bereitet die rasche und korrekte Diagnose. Laut einer Analyse des Swiss Neuropaediatric Stroke Registry (SNPSR, prospektives Erfassen aller in der Schweiz lebenden Kinder mit einem akuten, arteriell ischämischen Schlaganfall seit dem Jahr 2000) wird ein Schlaganfall nur bei einem Drittel der betroffenen Kinder innerhalb des Lysefensters von 6 h diagnostiziert.3, 4 Ähnliche Daten wurden von verschiedenen weltweiten Zentren publiziert.5, 6 Die Verzögerung der Diagnose ist in jeweils etwa der Hälfte der Fälle durch Nichterkennen des Schweregrades und der Dringlichkeit der Symptomatik durch Eltern sowie durch primär konsultierte Ärzte und Ärztinnen bedingt. Braun et al. zeigten, dass bei 42 % der Kinder mit Schlaganfall diese Diagnose nicht primär vermutet und bei weiteren 11 % dessen Ursache falsch eingeschätzt wurde.7 Bei 70 % war die Richtigstellung der Diagnose auch mit einer Änderung der Therapie verbunden. Shellhaas et al. wiesen aber auch auf die Problematik hin, dass 30 % der Kinder, welche mit Verdacht auf Schlaganfall zugewiesen werden, ein so genanntes „stroke mimic“ aufwiesen, bei 60 % aus einem anderen therapiebedürftigen, schwerwiegenden Problem bestehend.8
Symptome und ihre klinische Differenzialdiagnose bei Erstmanifestation
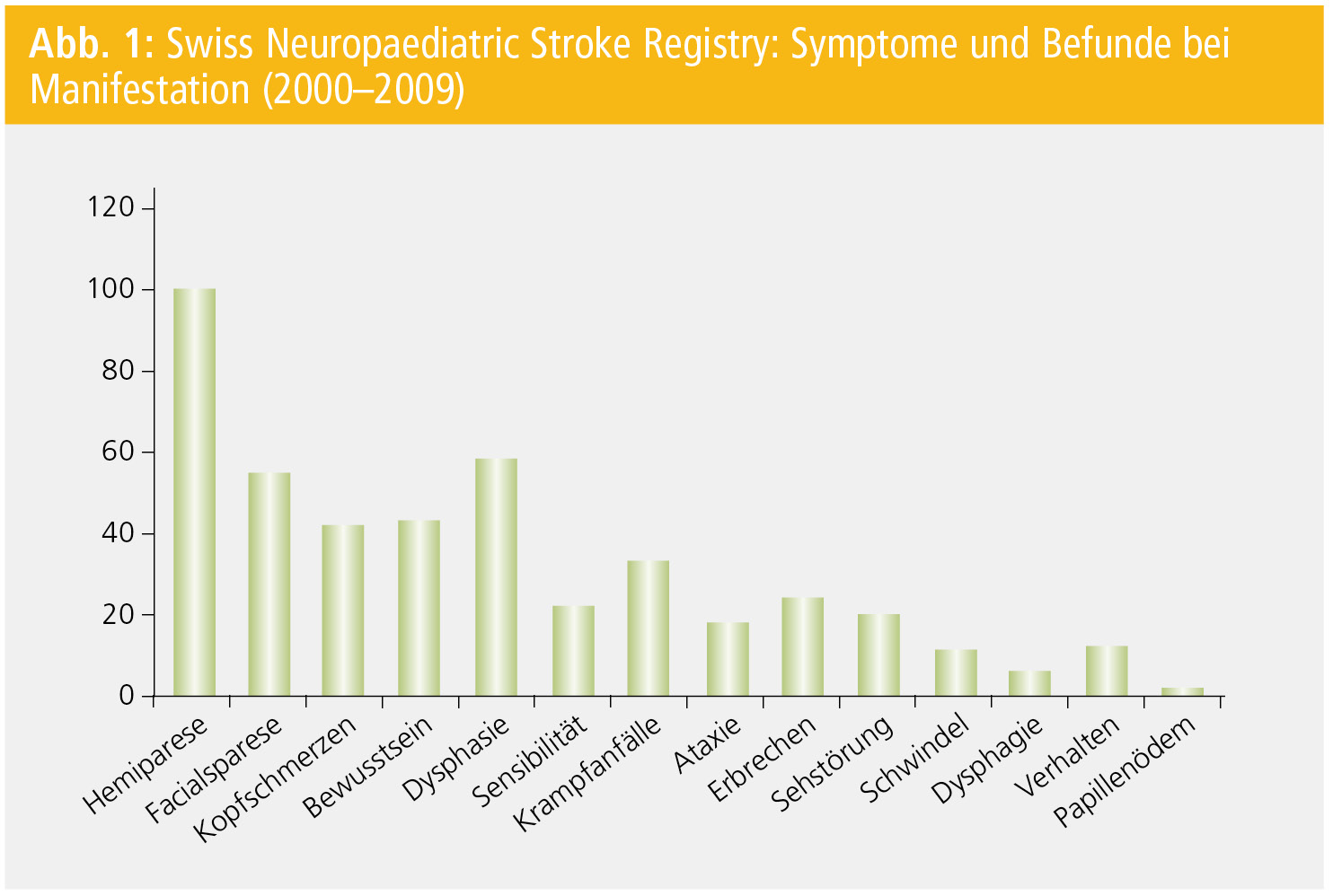
Die Symptome sind sehr vielfältig und entsprechen einer fokalen Ausfallsymptomatik, welche meist dem Ort der Ischämie entspricht (Abb. 1). 70–80 % der Kinder zeigen eine Hemiparese mit oder ohne Fazialisbeteiligung und/oder eine Dysphasie. Letztere tritt im Kindesalter häufig auch bei einem rechtsseitigen Insult auf, wohl als Zeichen der noch weniger entwickelten Lateralisierung der Sprache.9 Andererseits kann auch eine isolierte Thalamusischämie in der Akutphase eine schwere Hemisymptomatik mit Aphasie zur Folge haben.
Viele Kinder zeigen auch zusätzliche, nichtfokale Symptome wie Kopfschmerzen, Erbrechen oder Bewusstseinseintrübungen. Kopfschmerzen werden bei 30 % der Kinder vor, während oder nach Auftreten des Schlaganfalls beobachtet.3, 10, 11 Die Differenzialdiagnose zu einer hemiplegischen Migräne ist bei einer Erstepisode schwierig. Hilfreich sind dabei Familien- und persönliche Anamnese betreffend der Migräne. Im Unterschied zum akuten, schlagartigen Auftreten der sensomotorischen Halbseitenlähmung mit Dysphasie beim Schlaganfall entwickelt sich eine hemiplegische Migräne meist über mehrere Minuten bis zu einer halben Stunde mit einem Wandern der Symptome von der Hand zur Schulter mit unmittelbar vorausgehender oder folgender Dysphasie (Jackson-„march“). Klassischerweise erschrecken Kinder bei einer hemiplegischen Migräne über die Lähmung und die Unmöglichkeit zu sprechen, wohingegen Kinder nach einem Schlaganfall (nicht nur bei Hemineglect) gegenüber ihrer Symptomatik auffällig gleichgültig sind.
Kopfschmerzen können in ihrer Art aber auch auf mögliche auslösende Faktoren des Schlaganfalles hinweisen. Bei einer extrakraniellen arteriellen Dissektion klagen die PatientInnen über ipsilaterale Schmerzen im Hals- und Gesichtsbereich. Intrakranielle Dissektionen bewirken intrakranielle halbseitige Kopfschmerzen. Die Schmerzen bei Dissektionen sind in der Regel heftig, nicht pulsierend und dauern über Stunden/Tage an. Die Dissektion und somit die Schmerzen können der akuten Ischämie um Tage vorausgehen, transiente ischämische Attacken (TIA) sind häufige Warnzeichen. Hirnnervenausfälle (Horner-Syndrom, Diplopie, Schluckprobleme) können sowohl bei einer Vertebralis- als auch bei einer Karotisdissektion auftreten.12, 13
Epileptische Anfälle in der Akutphase des Schlaganfalls werden bei 20 % der Kinder gesehen, meist jedoch in den ersten Stunden bis Tagen und selten als primäres Symptom bei Einsetzen des Schlaganfalls.14 Wegen der relativen Häufigkeit von kindlichen epileptischen Anfällen wird eine initiale Hemiparese oft auch, ohne dass ein Krampfanfall beobachtet wurde, als postiktal beurteilt. Ein leichtes Schädel-Hirn-Trauma (SHT) Minuten bis Tage vor dem Schlaganfall scheint einen weiteren Risikofaktor darzustellen. Ein mit dem Schlaganfall einhergehender Sturz oder die Fehldiagnose einer Verwirrung bei Aphasie verzögern die Diagnose oft beträchtlich. Bei parainfektiös auftretendem Schlaganfall werden die Symptome bei Kleinkindern oft als Unlust und allgemeine infektbedingte Schwäche gedeutet. Das Alter der Kinder bei Erstmanifestation hat großen Einfluss auf mögliche Erstsymptome: Kinder 1-jährig eher fokal sensomotorische Ausfälle.15
Bildgebende Diagnostik
Bei jedem Verdacht auf einen Schlaganfall sollte dieser unmittelbar durch eine Bildgebung bestätigt und weitere Therapieoptionen diskutiert werden, nicht nur um die Diagnose zu bestätigen, sondern auch um Hinweise betreffend der Ätiologie und Prognose zu erhalten.16, 17
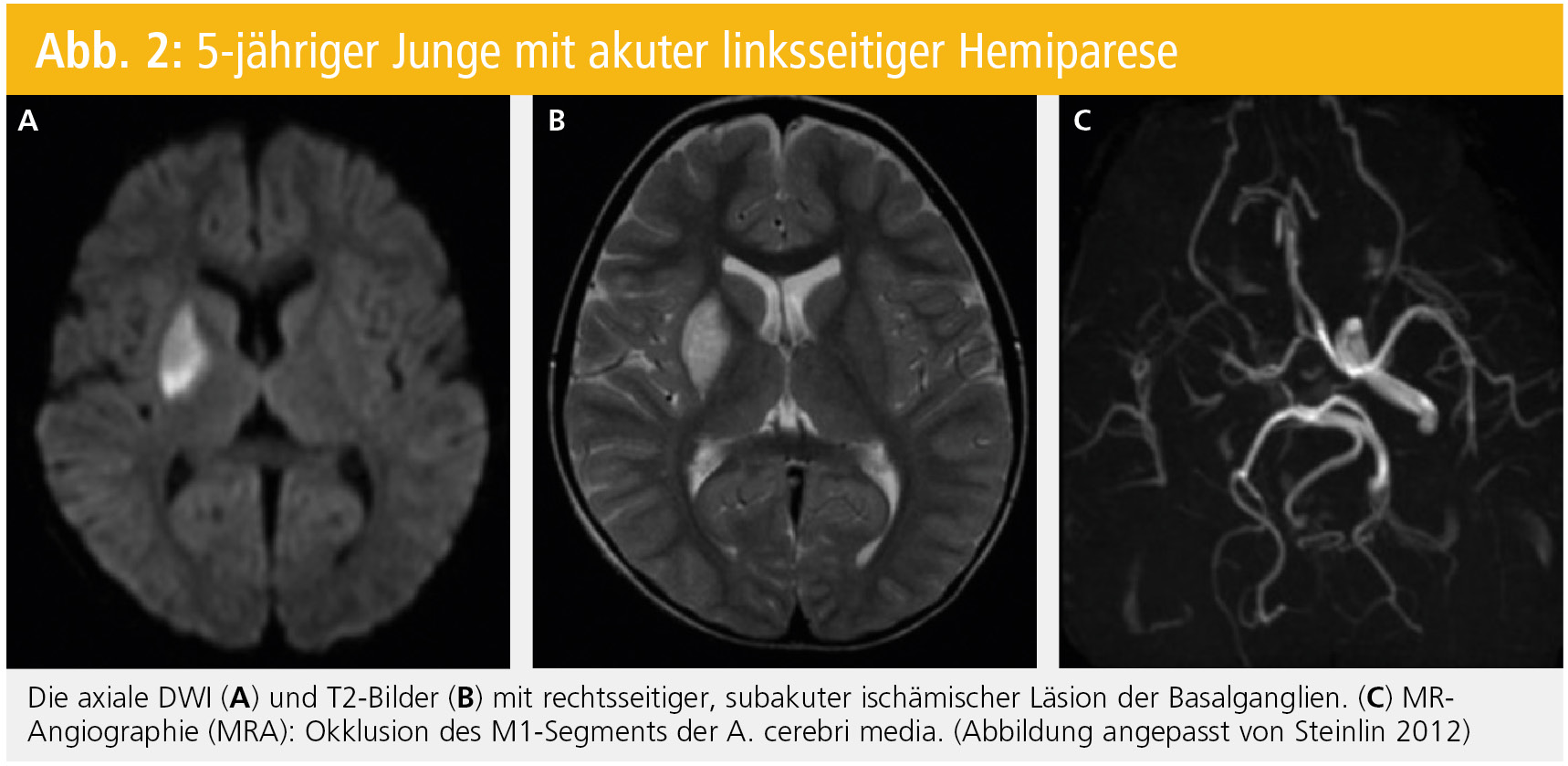
Computertomographien (CT) sind organisatorisch in den meisten Krankenhäusern innerhalb kürzester Zeit durchführbar. Sie haben jedoch den Nachteil, frühe (in den ersten Stunden), kleinvolumige und Ischämien der hinteren Schädelgrube nicht immer zu detektieren. Die Magnetresonanztomographie (MRT) mit Nachweis der Ischämie innerhalb von Minuten durch diffusionsgewichtete Bilder (DWI), die Magnetresonanzangiographie (MRA), die eine potenziell schwere Stenose oder Gefäßokklusion sichtbar macht und Perfusionsaufnahmen zur Bestimmung des „tissue at risk“ geben uns hilfreiche Information für den schwierigen Entscheid einer thrombolytischen Therapieindikation. Es wurde gezeigt, dass bei bis zu 53 % der Kinder mit akutem ischämischem Schlaganfall (AIS) Arteriopathien vorliegen können.18 Ergänzende T2- und T1-gewichtete Aufnahmen und Gradientenechosequenzen helfen uns, das Alter des Infarktes besser zu verstehen. Fettsupprimierte Bilder und kontrastverstärkte Angiogramme sind wichtig zur Detektion einer Dissektion. Enhancement der Gefäßwände in kontrastangereicherten oder so genannten „Dark blood“-Aufnahmen weisen auf eine Vaskulitis als Ursache hin.
Die konventionelle Angiographie wird nur bei unklaren Befunden in der nichtinvasiven Bildgebung, spezifischer Fragestellung oder bei endovaskulären Interventionen angewendet. Zur Verlaufsbeurteilung bei Vorliegen einer Vaskulopathie ist die Doppler-Untersuchung der intrakraniellen Gefässe als einfache Bedside-Methode unter Umständen sehr nützlich.
Ursachen und Risiken
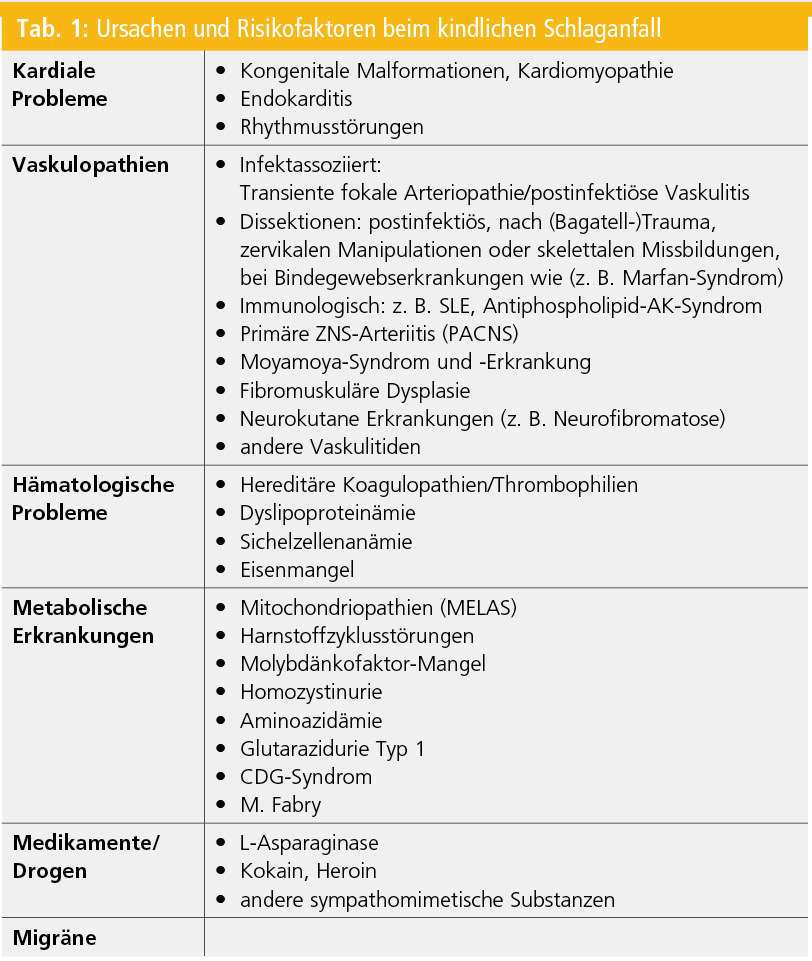
Der kindliche Schlaganfall ist ein „Multiple risk“-Problem; bei mehr als der Hälfte der Kinder können 2 und mehr Risikofaktoren gefunden werden.3, 19 Das Erkennen derselben bzw. von Risikosituationen ist hilfreich, um in der Akutsituation die Wahrscheinlichkeit eines Schlaganfalls abzuschätzen. Daneben ist die Information der vorliegenden Risikofaktoren wichtig zur Beurteilung der Gefahr eines Rezidivs. Tabelle 1 zeigt eine Übersicht und Zusammenstellung der Ursachen beziehungsweise Risikofaktoren.20
Vaskulopathien
Fokale transiente Arteriopathien und Dissektionen sind wahrscheinlich die häufigsten Ursachen für einen Schlaganfall im Kindesalter, größere Studien beschreiben eine Häufigkeit von 42–79 %.18, 21
Infektionen sind ein häufiger und bedeutsamer Risikofaktor für einen kindlichen arteriell ischämischen Schlaganfall. Beim Schlaganfall nach Varizellen findet sich neuroradiologisch oft eine Stenose, und die Kinder haben ein höheres Risiko für Rezidive oder eine TIA innerhalb der nächsten Monate. Der vermutete pathophysiologische Mechanismus, der zu einer fokalen Arteriopathie führt, ist eine parainfektiöse Reaktion und dadurch entzündliche Veränderung der Gefäßwand, wie in einem Autopsiefall von varizellenassoziierter Arteriitis und kindlichem Schlaganfall gezeigt werden konnte.22
Es konnte verschiedentlich gezeigt werden, dass bis zu 30 % der Kinder mit Schlaganfall im vorangegangenen Jahr an einer Varizelleninfektion litten.23, 24 Aber auch andere Infektionen mit Erregern wie Borrelien, Mykoplasmen, Enteroviren und Parvoviren konnten serologisch oder im Liquor im Rahmen eines Schlaganfalls nachgewiesen werden.2 Immer häufiger wird beschrieben, dass parainfektiöse Mechanismen – schon bei nur banalen Infekten der oberen Luftwege – eine große Rolle spielen.25–27
Vor allem bei Teenagern muss beim Auftreten eines Schlaganfalls ein noch nicht diagnostiziertes immunologisches Systemleiden wie SLE (systemischer Lupus erythematodes) in Betracht gezogen werden.
Auch Dissektionen treten vor allem im Kindesalter gehäuft nach Infektionen auf. Daneben gibt es aber auch andere bekannte Risikofaktoren dafür: (Bagatell-)Trauma, zervikale Manipulationen, zervikale skelettale Missbildungen, Homozysteinämie, Migräne und Vaskulopathien bei Bindegewebserkrankungen wie dem Marfan-Syndrom usw.12, 28
Die Moyamoya-Erkrankung bzw. das Moyamoya-Syndrom, eine progrediente, bilaterale Stenosierung im Bereich des Circulus Willisi mit Ausbildung von typischen Kollateralen, ist eine weitere wichtige Vaskulopathie im Kindesalter. Das Moyamoya-Syndrom kann sporadisch oder familiär auftreten, als Moyamoya-Erkrankung kommt es sekundär bei verschiedenen Grundleiden wie Sichelzellenanämie, Neurofibromatose, Trisomie 21 u. a. vor. Auch hier kann das akute Ereignis des Schlaganfalls gehäuft beim Vorliegen von zusätzlichen Risikofaktoren wie Infekt, arterieller Hypertension, hereditärer Koagulopathie oder Homozysteinämie beobachtet werden.
Seltenere Vaskulopathien sind die fibromuskuläre Dysplasie und primäre Arteriitiden (PACNS) des ZNS. Letztere sind jedoch gemäß einer kürzlich publizierten Arbeit von Bensler et al. möglicherweise unterdiagnostiziert.29 Beispielsweise könnte die nichtprogressive „medium to large primary arteriitis of the central nervous system“ (MLA) auch ursächlich für eine transiente fokale Arteriopathie der proximalen A. cerebri media sein. Klinisch zeigt sich dabei neben Warnzeichen wie Kopfschmerzen und TIA schlussendlich eine fokale Ischämie. Bei progressiver MLA stehen Kopfschmerzen, Verhaltensstörungen und auch kognitive Verschlechterungen initial im Vordergrund und sind schlussendlich gefolgt von einem Schlaganfall. In der Bildgebung weisen uni- oder multifokale Stenosen mit Gefäßwand-Enhancement darauf hin, der Liquoreröffnungsdruck ist erhöht und bei der progressiven Form sind auch im Liquor das Eiweiß und die Zellzahl leicht erhöht. Die PACNS der kleinen Gefäße entspricht der klassischen Form der zerebralen Vaskulitis.
Kardiale Ursachen
Kardiale Ursachen sind wohl der in der Bevölkerung bekannteste Risikofaktor. Dabei ist darauf hinzuweisen, dass Infarkte periinterventionell (Katheter und Operationen) häufig stumm ablaufen. Katheterinterventionen erhöhen das Risiko von Ischämien deutlich, wohingegen Operationen eher Veränderungen der weißen Substanz hervorrufen.30 Gehäuft finden sich bei Herzpatienten mit Schlaganfall auch andere davon unabhängige Risikofaktoren wie erhöhtes Lipoprotein, eine MTHFR-Mutation, Homozysteinämie, andere hereditäre Koagulopathien und Infektionen.
Hämatologische Ursachen
Hereditäre Koagulopathien sind meist nicht Hauptauslöser eines kindlichen Schlaganfalls. Verschiedene Studien konnten jedoch zeigen, dass es sich v. a. bei Antithrombinmangel, Protein-C-Mangel, erhöhtem Lipoprotein A und nachweisbaren Antiphospholipid-Antikörpern um relevante Korisikofaktoren handelt. Ein alleiniger Thrombophiliefaktor erklärt einen Schlaganfall nicht, aber multiple Faktoren, das Zusammentreffen mit anderen Risikofaktoren wie Moyamoya-Erkrankung bzw. -Syndrom oder kardialer Problematik sind bedeutend.31, 32 In den letzten Jahren wurde auch vermutet, dass vor allem bei Kleinkindern Eisenmangel oder ein niedriges Ferritin das Risiko für einen Schlaganfall erhöhen könnten.33
Im kontinentalen Europa zahlenmäßig etwas weniger von Bedeutung als in Großbritannien und Amerika sind Kinder mit Sichelzellenanämien. 11 % von ihnen erleiden bis zum 20. Lebensjahr einen Schlaganfall, wobei der Häufigkeitsgipfel für den arteriellen Schlaganfall zwischen 2 und 5 Jahren liegt. Dieses hohe Insultrisiko konnte durch präventive Maßnahmen deutlich gesenkt werden.34
Metabolische Erkrankungen
Selten, für die Pädiatrie jedoch wichtig, sind metabolische Schlaganfälle.35, 36 Dabei kann es, wie bei mitochondrialen Störungen durch Energieversorgungsprobleme des Hirngewebes oder durch toxische Ablagerungen wie bei den Harnstoffzykluserkrankungen (v. a. Ornithincarbamyltransferasemangel, OCT), zur Schädigung des Gewebes kommen, die sich klassischerweise nicht an ein Gefäßterritorium halten muss. Schlaganfälle im Rahmen von MELAS (mitochondriale Enzephalopathie und „stroke-like episodes“) treten bevorzugt in den okzipitalen Hirnabschnitten auf. Stoffwechselerkrankungen wie Morbus Fabry führen zu Vaskulopathien, welche das Auftreten eines Schlaganfalls begünstigen. Andere Stoffwechselstörungen begünstigen Kardiomyopathien oder Arrhythmien, welche wiederum Embolien verursachen können, oder Koagulopathien, wie beispielsweise bei einem CDG Syndrom („Congenital disorders of glycosylation“-Syndrom).
Die obigen Ausführungen machen deutlich, dass nach Auftreten eines kindlichen Schlaganfalls eine ausführliche Suche nach verschiedenen auslösenden Risikofaktoren folgen sollte. Neben einer sorgfältigen klinischen Anamnese und Untersuchung sind also immer auch eine ausgedehnte laborchemische Untersuchung und eine kardiologische Abklärung mit Echokardiographie und EKG indiziert.
Therapie
Zurzeit gibt es drei Guidelines zum Management des akuten arteriell ischämischen Schlafanfalls.37–39 Keine davon basiert auf Daten von pädiatrischen Studien, es handelt sich eher um Meinungen von ExpertInnen und Konklusionen aus Erwachsenenstudien.
Supportive Behandlung: Es gibt breite Übereinstimmung betreffend supportiver Behandlung während der ersten Tage: Körpertemperatur < 36,5 °C, Vermeiden von Hyper- und Hypoglykämien und Dyselektrolytämien, Blutdruckkontrollen (cave: evtl. Bedarfshypertonie), Behandlung von epileptischen Anfällen. Außerdem ist bei großvolumigen Infarkten, Ischämien in hinterer Schädelgrube und/oder Bewusstseinstrübung eine intensive Überwachung indiziert und eine Dekompression bei Schwellung des Infarktgebietes muss frühzeitig evaluiert werden.40
Thrombolyse im Kindesalter: Ein positiver Effekt wurde nachgewiesen, ohne Hinweise auf erhöhtes Risiko gegenüber Erwachsenen, aber immer noch ohne Evidenz, dass die Prognose der Kinder wirklich verbessert werden kann.41-42 Von erfolgreicher endovaskulärer Revaskularisation gibt es wenige Fallbeschreibungen.43
Die Frage, ob Heparinisierung oder Thrombozytenaggregationshemmung eingesetzt werden sollte, ist nicht geklärt. Die englischen und amerikanischen Guidelines bevorzugen – außer in Fällen von kardialen Embolien oder extrakraniellen Dissektionen – Azetylsalizylsäure (2–5 mg/kg/KG). Andere Arbeitsgruppen aus Colorado und Deutschland schlagen vor, Kinder mit einer Arteriopathie (ausgenommen Moyamoya) während den ersten 4 Wochen zu antikoagulieren.44 Als Prophylaxe nach dem akuten Ereignis hat sich Azetylsalizylsäure in einer Dosis von 2 bis 3 mg/kg/KG durchgesetzt, wobei die Dauer der Therapie ungeklärt ist und auch dem Risikoprofil angepasst werden muss.
Prognose und Wiederholungsrisiko
Noch immer besteht der Glaube, dass ein Schlaganfall im Kindesalter bei Manifestation weniger gravierend und mit einer besseren Prognose verbunden ist als im Erwachsenenalter. In einer rezenten Arbeit konnte aber gezeigt werden, dass Schweregrad und Langzeitfolgen bei Kindern und jungen Erwachsenen in etwa vergleichbar sind.45 Die Mortalität bei Kindern liegt bei 10–20 % und bei zwei Drittel der Kinder sind lebenslange Einschränkungen zu erwarten.46 Bei den meisten ist das eine Hemiparese mit oder ohne Fazialisparese und/oder eine Dysphasie.
Aber auch weitere Probleme wie Ataxie, ophthalmologische Probleme oder symptomatische Epilepsie können vorkommen. Am meisten sind die Kinder aber durch lebenslange neurokognitive und Verhaltensauffälligkeiten eingeschränkt.47, 48 Das Wiederholungsrisiko eines kindlichen Schlaganfalls beträgt 10–20 %, TIA treten bei 5–20 % auf.49 Ein erhöhtes Risiko findet sich v. a. bei Vorliegen einer Vaskulopathie in der Bildgebung, Sichelzellenanämie, Moyamoya-Erkrankung bzw. -Syndrom sowie eines genetischen Thrombophiliefaktors wie Mangel an Protein S/C, Hyperlipoproteinamie A oder Prothrombinmutation.
Resümee
Der kindliche Schlaganfall ist im Vergleich zum Schlaganfall bei Erwachsenen ein relativ selteneres, jedoch mindestens so einschneidendes Ereignis mit hoher Morbidität. Das rechtzeitige Erkennen wird erschwert durch die Mannigfaltigkeit der Symptome und die häufigen „stroke mimics“ im Kindesalter. Meist finden sich mehrere Risikofaktoren, die in Kombination den Schlaganfall auslösen. Frühzeitig akutes Therapiemanagement sowie adäquate Rehabilitation sind wichtig, um Spätfolgen möglichst zu vermindern und die Lebensqualität der Kinder und ihrer Familien zu verbessern.Noch immer besteht aber keine Evidenz betreffend der Therapieoptionen, insbesondere auch nicht dafür, ob die im Kindesalter unterschiedlichen Risikofaktoren und Reorganisationsmöglichkeiten auch die jeweiligen Therapieindikationen beeinflussen sollten. Weitere internationale, multizentrische Studien werden hoffentlich im Verlaufe der nächsten Jahre einige Fragen beantworten.
gulability and inflammation in childhood-onset arterial ischemic stroke. J Pediatr 2010; 156:651–6.