Schlaganfall und Schlafapnoe
Der Schlaganfall stellt in den westlichen Industrienationen die häufigste Ursache für eine bleibende Behinderung und die zweithäufigste Todesursache nach Herz-Kreislauf-Erkrankungen dar1. Ein erholsamer Schlaf gilt als wesentliche Voraussetzung für neuronale Plastizität und Regeneration. Randomisierte klinische Studien bei Schlaganfallpatienten zeigten besseres motorisches Lernen nach einer Schlaf- im Vergleich zu einer Nicht-Schlafbedingung2. Ziel des Artikels ist es, die komplexen Zusammenhänge zwischen Schlafapnoe (SA) und Schlaganfall zu beleuchten, da sich beide gegenseitig verursachen können und auch durch ähnliche prädisponierende Faktoren begünstigt werden.
Schlaf und Schlafapnoe als unabhängige vaskuläre Risikofaktoren
Schlaf selbst dürfte einen Risikofaktor für einen Schlaganfall (Wake-up stroke) darstellen. Zwischen 6 Uhr morgens und 12 Uhr kommt es zu einem Anstieg ischämischer und hämorrhagischer Schlaganfälle. Eine mögliche Erklärung für diesen Umstand sind zirkadiane und lageabhängige Veränderungen der Blutgerinnung, des Blutdrucks, der Herzfrequenz sowie der Katecholamine beim Erwachen3.
In den letzten 20 Jahren wurde die SA – insbesondere jene vom obstruktiven Typ – als unabhängiger Risikofaktor für Morbidität/Mortalität und kardiovaskuläre Erkrankungen anerkannt. Vor allem für die arterielle Hypertonie, Herzinsuffizienz und Herzrhythmusstörungen besteht eine gute Evidenzlage4.
In der Wisconsin-Sleep-Kohorte (n = 1.522 PatientInnen) betrug im Verlauf von 18 Jahren beim Vergleich der Gruppen mit schwerer und fehlender SA die adjustierte Hazard Ratio für die Gesamtmortalität 3 und für die kardiovaskuläre Mortalität 55. In der gleichen Studie fand sich auch eine klare Dosis-Wirkung-Beziehung zwischen der Schwere der SA und der Manifestation einer Hypertonie als wichtigstem Risikofaktor für Schlaganfall.
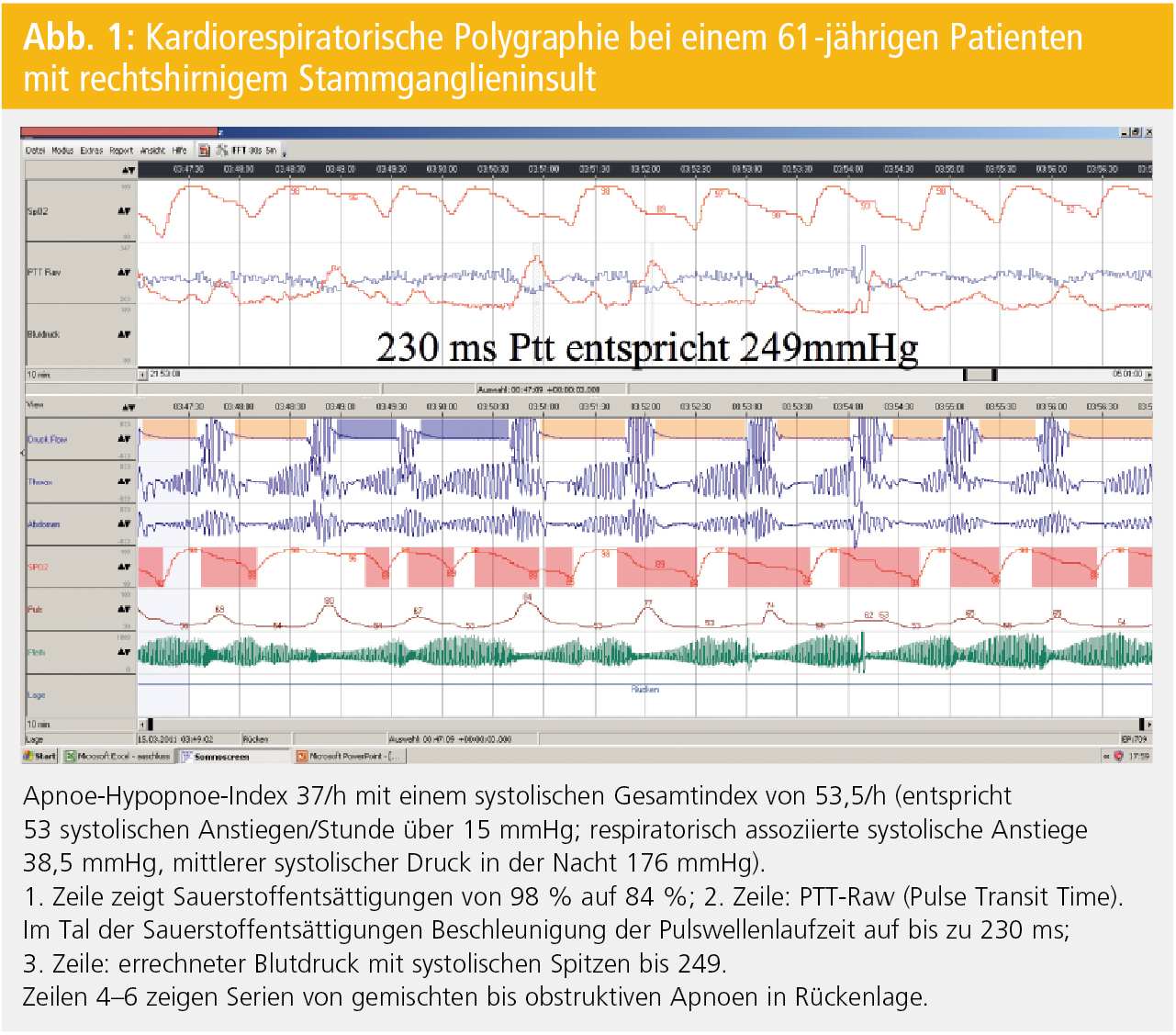
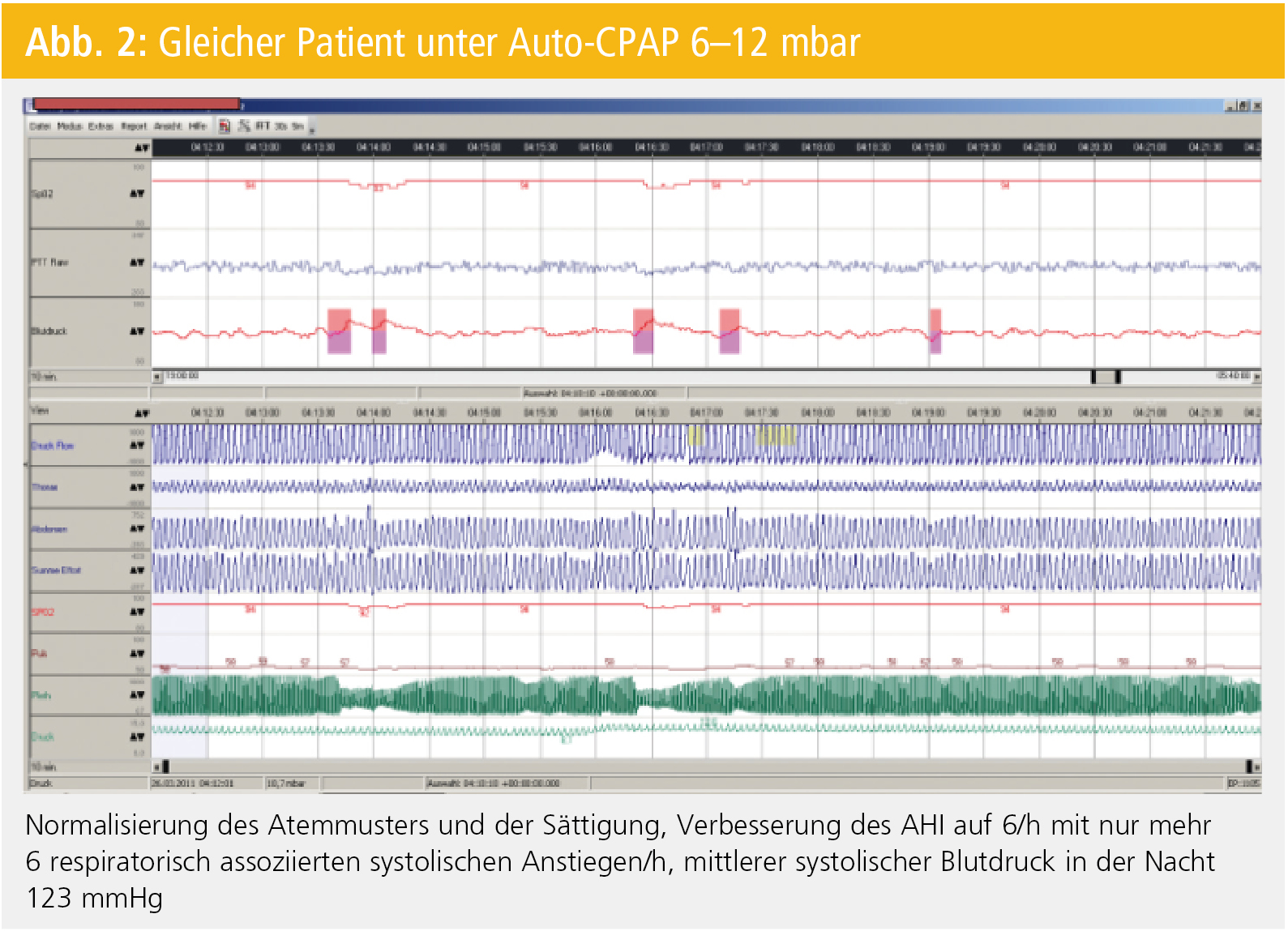
Eigene Untersuchungen mittels Pulswellenlaufzeit zeigen bei SchlaganfallpatientInnen mit SA mehr respiratorisch assoziierte Blutdruckanstiege pro Stunde als bei PatientInnen mit normaler Atmung6 (Abb. 1 und 2).
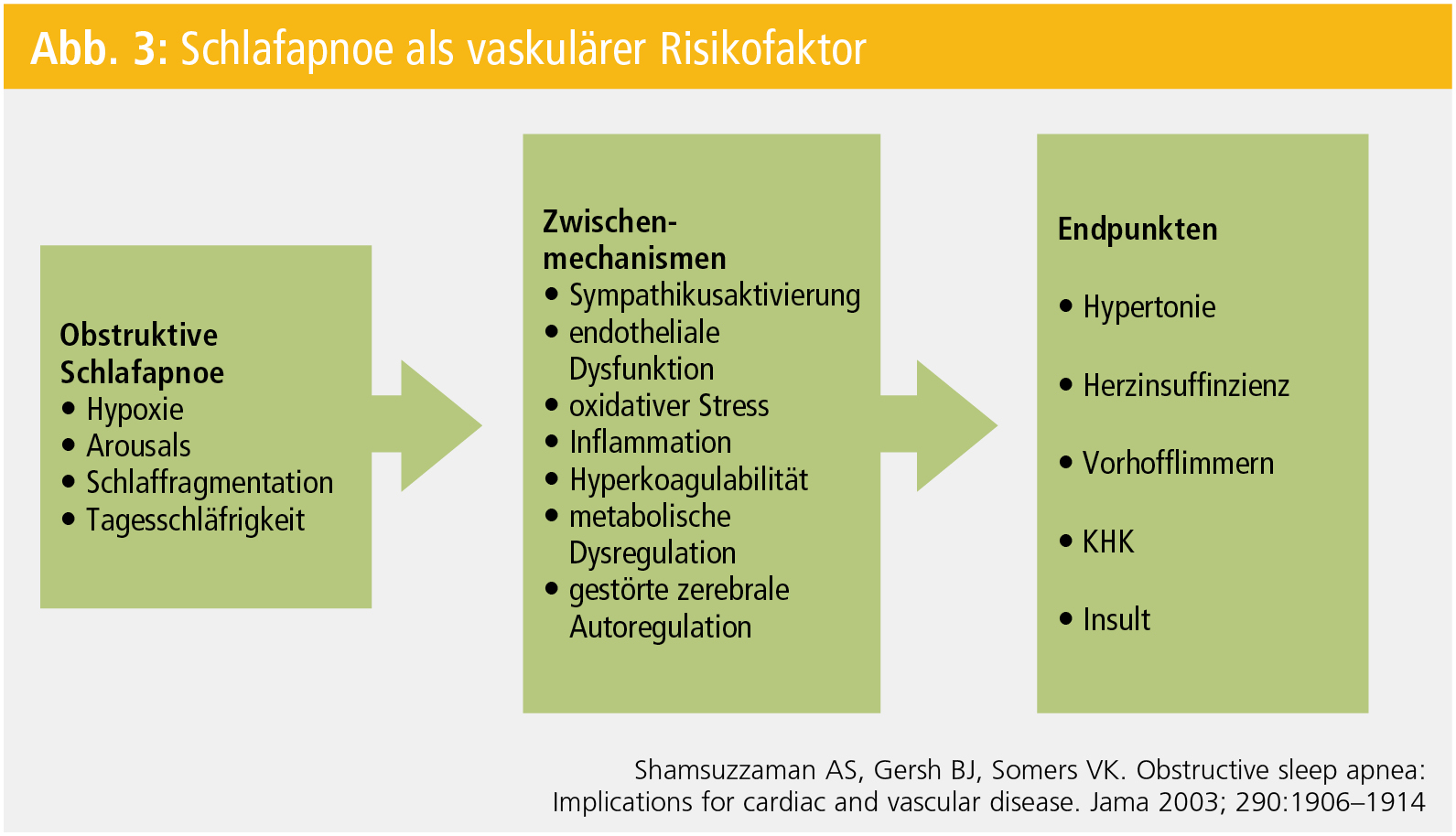
Schlafapnoe als Brandbeschleuniger der Atherosklerose: Man nimmt an, dass die repetitiven Hypoxien und Arousals als Folge der Apnoen im Sinne eines Kaskadeneffekts (Abb. 3) zu einer Erhöhung des Sympathikustonus und zu einer systemischen Entzündung führen. Die SA gilt mittlerweile als typische oxidative Stresserkrankung4. Das ständige nächtliche Valsalva-Manöver gegen verschlossene Atemwege führt zu einer enormen Druck – und Dehnbelastung der Vorhöfe und erklärt die höhere Inzidenz an Vorhofflimmern bei SA, dem wichtigsten embolischen Risikofaktor für Schlaganfall4.
SchlafapnoepatientInnen mit offenem Foramen ovale dürften durch paradoxe Embolien während langer nächtlicher Apnoen ein zusätzlich erhöhtes Schlaganfallrisiko haben4. Neben metabolischen Störungen (Insulinresistenz) gilt Hyperkoagulabilität als weiterer wichtiger Zwischenmechanismus zum vaskulären Endpunkt4.
Wie eigene Messungen der Intima-Media-Dicke bei SchlaflaborpatientInnenen zeigten, führen bereits geringgradig erhöhte Apnoe-Hypopnoe-Indexwerte (AHI-Werte) zu einer signifikanten unabhängigen Zunahme der Intima-Media-Dicke7. Serumsurrogatmarker, wie das hochsensitive CRP, scheinen Prädiktoren einer fortgeschrittenen Atherosklerose bei PatientInnen mit schwerer OSA-bezogener Hypoxie zu sein. Tagesschläfrigkeit wurde als guter Prädiktor zerebraler Atherosklerose identifiziert.
Schlafapnoe und zerebrale Durchblutung: Nächtliche Apnoen dürften einen negativen Effekt auch in Zusammenhang mit der akuten zerebralen Ischämie haben, wo das Risiko einer Ausdehnung der vulnerablen Penumbra um den Infarktkern und somit schwerer neurologischer Ausfälle besteht4. Duplexsonographische Studien zeigten eine signifikante Reduktion des Blutflusses in der Arteria cerebri media als Folge der Apnoen4. In einer nächtlichen Infrarot-Spektroskopiemessung bei SchlafapnoepatientInnen nach akutem Schlaganfall fand sich eine asymmetrische zerebrale Hämodynamik. Im Bereich der betroffenen Hemisphäre zeigten sich geringere hämodynamische Fluktuationen bzw. waren die Sauerstoffentsättigungen durch obstruktive Apnoen auf der nicht betroffenen Seite ausgeprägter8.
Klinische Charakteristika der Schlafapnoe bei SchlaganfallpatientInnen
In der Akut- und Subakutphase des Insults haben 70 % der SchlaganfallpatientInnen eine relevante SA. Nach Reduktion der Rückenlagezeit durch bessere Mobilität sowie Verbesserung der Lungen- und Herzfunktion kommt es meist zu einer spontanen Reduktion zentraler Apnoen mit Persistenz obstruktiver, oft vorbestehender Apnoen4.
Laut eigenen Daten unseres Rehabilitationszentrums liegt die Prävalenz der SA unter SchlaganfallpatientInnen bei 56 % (international 30–70 %, je nach Definition), wobei obstruktive Apnoen mit über 70 % der häufigste Typ sind9. Dabei handelt es sich meist um PatientInnen mit multiplen vaskulären Risikofaktoren, bei denen der Schlaganfall eine präexistierende Situation verschärft. Obstruktive Apnoen in der Akutphase des Schlaganfalls dürften auch auf eine gestörte neuronale Koordination der oberen Atemwege und der Atemhilfs- bzw. Zwerchfellmuskulatur zurückzuführen sein. Persistierende Apnoen vom zentralen Typ und/oder Cheyne-Stokes-Atmung (zentrale periodische Atmung) finden sich bei 30 bis 40 % der SchlaganfallpatientInnen. Oft bestehen dann ausgedehnte bihemisphärische oder Hirnstammischämien, Läsionen im autonomen Netzwerk (Inselregion) und/oder eine Herzinsuffizienz. Atemgastechnisch ist häufig eine erhöhte CO2-Hypersensibilität nachweisbar. Als Risikofaktoren für schwere Schlafapnoe bei Schlaganfall gelten männliches Geschlecht, Reinsult und unbekannte Schlaganfallätiologie4.
Als rasch verfügbare objektive Methode zum Nachweis einer SA dient die kardiorespiratorische Polygraphie. Dabei erfolgt mittels eines tragbaren Rekordersystems eine Messung des Atemflusses, der Atemexkursionen, der Körperlage und der Sauerstoffsättigung. Diese Messung dient als Entscheidungsbasis für pulmologische, kieferorthopädische und konservative Therapiestrategien und die Überweisung an ein Schlaflabor zur kompletten Polysomnographie.
Klinische Interviews zur Evaluation schlafbezogener Atmungsstörungen sind in der Neurorehabilitation nicht ausreichend und keine Prädiktoren für eine schlafbezogene Atmungsstörung9. Das klinisch sehr einprägsame Bild des korpulenten Schlafapnoepatienten mit hohem sozialem Leidensdruck durch exzessives Schnarchen, der im Wartebereich der Ambulanz einschläft, gilt also nicht für SchlaganfallpatientInnen.
In linearer Beziehung zum Schweregrad der obstruktiven schlafbezogenen Atmungsstörung steht neben einer Verlängerung des stationären Aufenthalts auch eine eindeutige Zunahme der Mortalität und Reduktion der funktionellen Kapazität4.
Therapie der Schlafapnoe nach Schlaganfall
Die Behandlung der SA bei SchlaganfallpatientInnen stellt vor allem bei schwer betroffenen PatientInnen eine interdisziplinäre Herausforderung dar. In der akuten Phase in der Stroke Unit steht daher eher die Prävention von sekundären Komplikationen (Aspirationspneumonie, Schmerzen auf der betroffenen Seite) im Vordergrund4. Eine regelmäßige Mobilisation sollte gefördert werden, wobei Pilotstudien mit Lagepolstern, die die Rückenlage nach einem Schlaganfall verhindern, erste positive Effekte zeigten10. Die abendliche Verabreichung von zentral wirksamen atemdepressiven Medikamenten (Opiaten) und Muskelrelaxanzien (Antispastika) ist nach Möglichkeit zu vermeiden. Bei adipösen PatientInnen sollte eine Gewichtsabnahme angestrebt werden.
Die Indikation zu einer nCPAP-Therapie in der Akutphase wird aufgrund der ungenügenden Datenlage und aus praktischen Gründen zurzeit noch kontrovers beurteilt4. Die Akzeptanz einer CPAP-Beatmung während der ersten 2–8 Wochen nach einem Schlaganfall beträgt je nach Studie 30–70 %4. Laut einer rezenten prospektiven Observationsstudie11 aus Spanien haben PatientInnen mit regelmäßigem CPAP-Gebrauch wegen schwerer Schlafapnoe (nur 30 %) 7 Jahre nach dem ersten Schlaganfall eine halb so hohe Mortalität wie PatientInnen, die sich in der Sekundärprävention nach dem Schlaganfall für keine Therapie entscheiden (70 %). Zudem zeigte eine kürzlich publizierte amerikanische Studie nach einer randomisierten nCPAP-Anpassung im Rahmen des Neurorehabilitationsaufenthalts eine signifikante Verbesserung der funktionellen und motorischen Kapazität ohne Effekt auf kognitive Funktionen12.
Faktoren, die eine nCPAP-Therapie in den ersten Tagen nach dem Schlaganfall favorisieren, sind: leichter bis mittelschwerer Schlaganfall, keine schwere Aphasie, faziale Parese oder Demenz, Alter 30/h, überwiegend obstruktive SA sowie exzessive Tagesschläfrigkeit4.
Für Unterkieferprotrusionsschienen besteht eine sehr gute Evidenzlage für das leichte bis mittelschwere Schlafapnoesyndrom, wobei es speziell für SchlaganfallpatientInnen noch keine genauen Daten gibt. Die im Regelfall erforderliche individuelle Anpassung einer Schiene durch einen Zahnarzt ist neben der noch fehlenden Kassenerstattung in Österreich ein Problem der täglichen Praxis.