Grundlagen der Blutgasanalyse

Foto: Shutterstock/Chamaiporn Naprom
Mittels der Blutgasanalyse (BGA) können respiratorische und metabolische Störungen des Säure-Basen-Haushaltes im Blut untersucht werden. Idealerweise sollte man hierfür Blut aus einem arteriellen Gefäß verwenden.
Redaktion: Richard Brunner
Entnahme von arteriellem Blut
Die Entnahme von arteriellem Blut kann entweder durch eine einmalige direkte Punktion einer Arterie (Abb. 1; A. radialis; Alternative: A. femoralis bzw. A. brachialis) oder aus einem liegenden arteriellen Verweilkatheter (Abb. 2) erfolgen. Das entnommene Blut wird in einem Blutgasanalysegerät untersucht. In der Regel erhält man nach 1-2 Minuten die gewünschten Werte.
Ergebnis der Blutgasanalyse
Die Blutgasanalyse zeichnet sich im Speziellen durch die Bestimmung der Parameter des Säure-Basen-Haushaltes und der Oxygenierung aus (Abb. 3). Um den genauen Ursachen einer etwaigen Störung des Säure-Basen-Haushaltes auf den Grund zu gehen bedarf es einer strukturierten Interpretation der Ergebnisse.
Interpretation der BGA
Überprüfung der Oxygenierung
Ausreichend Sauerstoff ist für den menschlichen Körper essentiell und wird über die Lunge aufgenommen. Die Aufnahme über die Lunge erfolgt über die Alveolen und hängt vom Sauerstoffpartialdruck (pO2) der Luft und vom Ausmaß der Barriere der Alveolen ab. Bei einem angenommenen (Gesamt)-Luftdruck von 729 mmHg und einer Sauerstoffkonzentration von 21% beträgt der pO2 der Umgebungsluft 153 mmHg (729 * 0,21 = 153 mmHg).
Da die Lungenalveolen eine Barriere darstellen gelangt nur ein Teil des Sauerstoffes in die Blutbahn, wo es großteils an Hämoglobin (Hb) gebunden ist. Ein Teil ist jedoch direkt im Blut gelöst; ebendieser Anteil wird in der Blutgasanalyse gemessen. Da die Barriere der Alveolen mit dem Alter zunimmt, sind die Normalwerte des pO2 im Blut altersabhängig (Abb. 4).
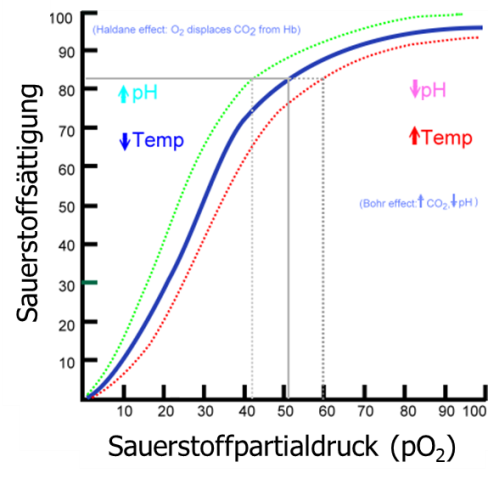
Die Sauerstoffsättigung (SpO2) – welche auch nicht-invasiv mittels Fingerclip gemessen werden kann – hängt direkt vom Sauerstoffpartialdruck (pO2) ab. Dieser Zusammenhang ist jedoch nicht linear, sondern sigmoid und wird von mehreren Faktoren beeinflusst (z.B. pH-Wert, Temperatur; Abb 5).
Interpretation des Säure-Basen-Haushaltes
Der Säure-Basen-Haushalt fußt auf zwei Komponenten. Einerseits der respiratorischen Komponente (pCO2), andererseits der metabolischen Komponente (base excess = BE). Das gemeinsame Endprodukt dieser beiden Pfeiler ist der pH-Wert des Blutes (Abb. 6).
Es können Störungen der respiratorischen Komponente und der metabolischen Komponente einzeln oder gemeinsam auftreten. Während jeweils nur einer respiratorische Störung (respiratorische Alkalose oder Azidose) zur gleichen Zeit vorherrschen kann, können mehrere metabolische Störungen gleichzeitig (z.B. metabolische Alkalose UND metabolische Azidose) auftreten.
Primäre Störung
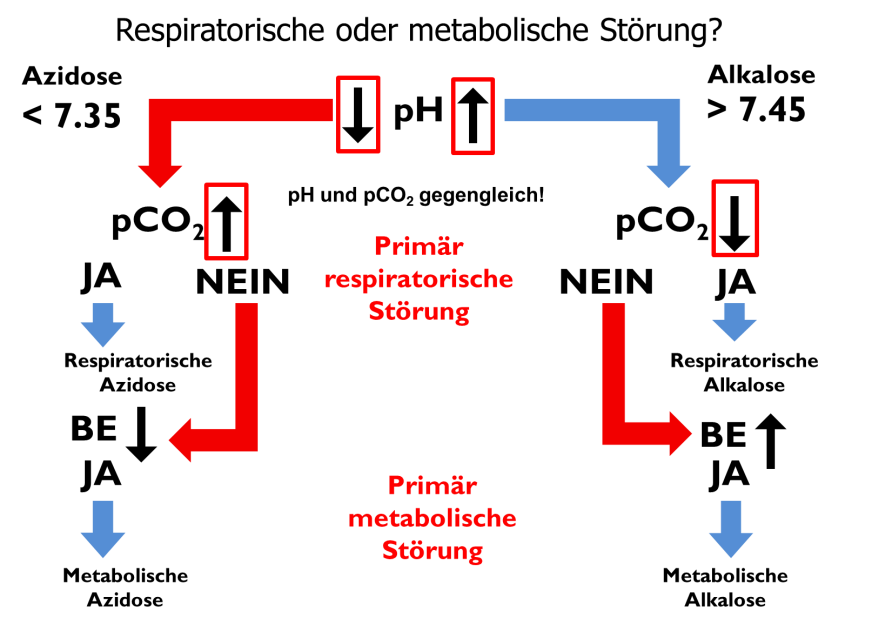
Insbesondere bei mehreren gleichzeitig auftretenden Störungen des Säure-Basen-Haushaltes ist es von großer Wichtigkeit die primäre/führende Störung zu identifizieren. Zunächst wird festgestellt ob die Azidose(n) oder Alkalose(n) führend sind. Ein pH-Wert von unter 7,35 spricht primär für eine Azidose, während ein pH-Wert von > 7,45 primär für eine Alkalose spricht. Ob die respiratorische oder die metabolische Komponente führend/ursächlich für die Störung des Säure-Basen-Haushaltes ist, kann basierend auf dem pH und dem pCO2-Wert bestimmt werden (Abb. 7).
Sind diese gegengleich verändert (z.B. pH zu niedrig und pCO2 zu hoch) handelt es sich primär um eine respiratorische Azidose. Ein zu hoher pH und erniedrigtes pCO2 wäre beweisend für eine respiratorische Alkalose. Dies bedeutet, dass diese Störung führend ist. Es schließt jedoch weitere (metabolische) Störungen nicht aus.
Sind pH und pCO2 nicht gegengleich verändert (z.b. pH niedrig, pCO2 ebenso niedrig oder normal) spricht dies primär für eine metabolische Störung.
Während die respiratorische Komponente alleinig vom pCO2 abhängig ist, ist die Interpretation der metabolischen Komponente komplexer.
Interpretation der metabolischen Komponente
Die Interpretation der metabolischen Komponente ist komplexer, da mehrere metabolische Störungen gleichzeitig auftreten können (z.B. metabolische Azidose und metabolische Alkalose). Diese können sich in ihrer Wirkung (teilweise) aufheben. Den Gesamteffekt der metabolischen Störungen wird mit dem Base Excess (BE) erfasst (Abb. 6). Während positive Werte (> 2) einer vorrangig metabolischen Alkalose entsprechen, sind negative Wert (< 2) kompatibel mit einer vorrangig metabolischen Azidose. In der klinischen Praxis sind jedoch metabolische Azidosen weitaus häufiger als metabolische Alkalosen und werden deshalb hier behandelt.
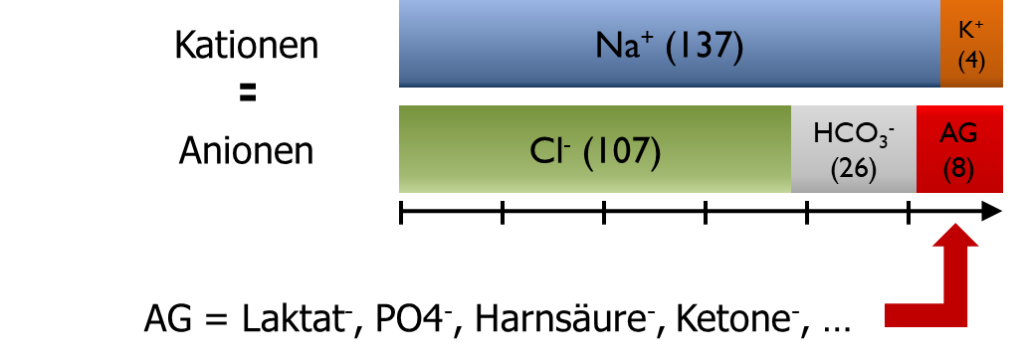
Um die metabolische Azidose weiter analysieren zu können muss zunächst der „Anion Gap“ (Anionenlücke) bestimmt werden. Die Anionenlücke ist keine echte Lücke sondern nur ein rechnerisches Hilfsmittel und entspricht der Differenz der positiven Ionen Na2+ und K+ und der negativen Ionen Cl– und HCO3- im Blut und kann mittels der Formel AG = (Na2+ + K+ – [Cl– + HCO3-]) errechnet werden (Abb. 8). Einige BGA-Geräte geben den Anion Gap (AG) selbständig aus (Abb. 3). Ein AG wird bei Werten > 11 als positiv gewertet.
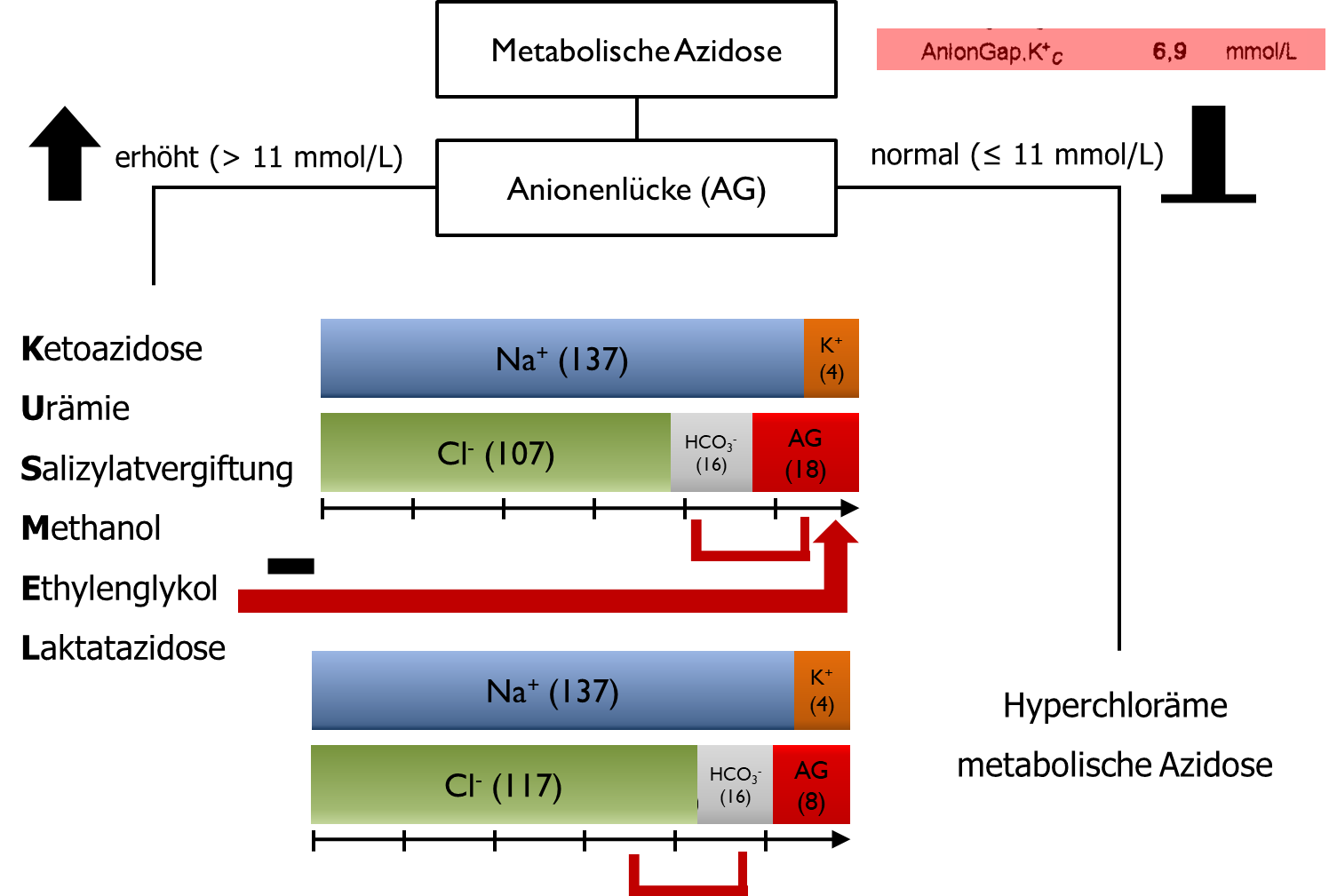
Treten bei einer metabolischen Azidose zusätzlich negative Ionen auf (z.B. Laktat, Phosphat [PO4-], Harnsäure, Ketone, …) vergrößert sich die Anionenlücke, da kompensatorisch das ebenso negativ geladene Bikarbonat (HCO3-) verringert wird. Bei einer metabolischen Azidose in Kombination mit einem positiven AG ist daher von einer erhöhten Produktion/Aufnahme dieser negativen Ionen auszugehen und eine der folgenden Ursachen wahrscheinlich: Ketoazidose, Urämie, Salizylatvergiftung, Methanolvergiftung, Ethylenglykolvergiftung oder Laktatazidose (Abb. 9).
Bei einer metabolischen Azidose in Kombination mit normalem AG wird von einer hyperchlorämen metabolischen Azidose gesprochen (Abb. 9). Hier erhöht sich der Chloridgehalt im Blut und kompensatorisch wird Bikarbonat (HCO3-) verringert. (Richard Brunner, 18.2.2019)
Hier geht es zu den Beispielen der Blutgasanalyse
Abbildungen: Richard Brunner