Anti-CTLA4-Antikörper Ipilimumab und BRAF-Inhibitor Vemurafenib – Ein doppelter Schlag gegen das metastasierte Melanom
Nach Jahren der Stagnation in der Therapie des Melanoms haben sich zwei voneinander grundsätzlich verschiedene Therapien in Phase-III-Studien gegenüber dem bisherigen Therapiestandard, dem Zytostatikum Dacarbazin (DTIC), als überlegen präsentiert. Wie schon einleitend beschrieben, hat der Anti-CTLA4-Antikörper Ipilimumab (Yervoy®) in einer Dosierung von 3 mg/kg KG (ASCO 2010, Studie MDX010-20 präsentiert von S. O’Day) durch Verbesserung des Gesamtüberlebens nach Progression unter einer Vortherapie die letzte Hürde zur Zulassung genommen.
Studien mit Ipilimumab
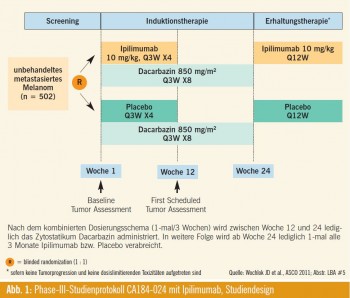
Late-Breaking Abstract # 5: Dieses Jahr wurde die mit Spannung erwartete placebokontrollierte Doppelblind-Studie CA184-024, welche DTIC +/– Ipilimumab verglich (Abb. 1), von Jedd D. Wochlok aus dem renommierten Memorial Sloan- Kettering Cancer Center in New York City vorgestellt. Auch in dieser Studie zeigte sich ein signifikanter Überlebensvorteil für die Patienten in der DTIC+Ipilimumab- Gruppe, verglichen mit der DTIC+Placebo-Gruppe. Wie in Abb. 1 beschrieben, erhielten beide Therapiegruppen DTIC 850 mg/m2 alle 3 Wochen; zusätzlich erhielt die eine Gruppe Ipilimumab 10 mg/kg KG bzw. Placebo im selben Zeitintervall. Nach 12 Wochen wurde eine Verlaufskontrolle mittels CTScan durchgeführt und danach wurde bei Stabilisierung der Erkrankung (Stable Disease, Partial Response, Complete Response) für die folgenden 12 Wochen lediglich DTIC weiter verabreicht.
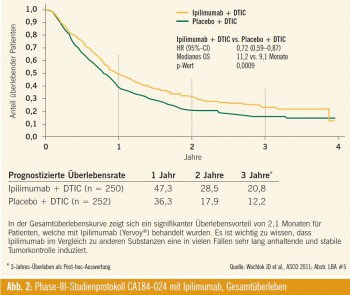
Längeres Gesamtüberleben: Aus der Überlebensanalyse nach Kaplan-Meier (Abb. 2) geht der signifikant bessere Therapieerfolg für Patienten in der Ipilimumab- Gruppe hervor (obere Kurve). Die Kurve separiert sich bereits am Anfang der Zeitachse und bleibt der Placebo- Gruppe kontinuierlich überlegen. Die gute Datenlage dieser Studie, welche 502 Patienten (250 DTIC + Ipilimumab und 252 DTIC + Placebo) auswertet, wird zusätzlich durch die außerordentlich lange Nachfolgeperiode von mehr als 3 Jahren untermauert. Das mediane Gesamtüberleben wurde um 2,1 Monate verlängert (11,2 Monate im Ipilimumab-Arm vs. 9,1 Monate im Placebo-Arm). Die errechnete 3-Jahres-Überlebensrate beträgt für DTIC + Ipilimumab 20,8 % gegenüber 12,2 % für DTIC + Placebo. Eine Verbesserung des Gesamtüberlebens um 2,1 Monate mag auf den ersten Blick sehr gering erscheinen, bedeutet aber bei diesem äußerst aggressiven Tumor einen deutlichen Fortschritt in der Behandlung, zumal in vielen Fällen das Ansprechen auf die Therapie anhaltend und stabil ist. Die Dauer des Tumor-Respons betrug in der Ipilimumab-Gruppe 19,3 Monate, wohingegen Patienten der Placebo-Gruppe lediglich 8,1 Monate profitierten.
Immunmediierte Nebenwirkungen: Jeder Therapieerfolg wird auch durch Nebenwirkungen erkauft, und dies gilt besonders für Medikamente wie Ipilimumab. Da die Substanz das körpereigene Immunsystem stimuliert und diesem die Bekämpfung der Tumorerkrankung dadurch erst ermöglicht, kommt es bei einer Großzahl der Patienten zu so genannten „immune-related adverse events“ (irAEs – immunmediierte Nebenwirkungen). Hierbei kommt es zu autoimmunen Inflammationen in diversen Organgensystemen, die mit bestehenden Therapierichtlinien grundsätzlich gut therapiebar sind, jedoch oft so intensiv ausfallen, dass der Patient keine weiteren Ipilimumab-Gaben mehr erhalten darf. Verglichen mit vorangegangenen Studien mit Ipilimumab, in welchen die intensiven, therapiewürdigen irAEs (Grad 3–4 nach der CTC-Klassifikation), wie z. B. Kolitis/Diarrhoe, Hepatopathie oder Hypophysitis, durchaus häufig vertreten waren, fand man in der CA184-024-Studie eine Kolitis-Rate von nur mehr 2 % und gar keine irAEs im endokrinen System, jedoch mit ca. 20 % äußerst häufig eine Hepathopathie. Dies mag zum Teil an der Kombination mit DTIC gelegen haben, welches hepatal metabolisiert wird. Ebenfalls ein Grund hierfür mag die gestiegene Erfahrung im Umgang mit dem Medikament bei den behandelnden Ärzten sein, sodass irAEs früher erkannt und therapiert wurden.
Da die oben beschriebenen irAEs oftmals therapielimitierend sind und die Morbidität unter Behandlung signifikant erhöhen, werden große Anstrengungen unternommen, diese genauer zu verstehen und eventuell sogar positiv zu beein – flussen. M. Callahan et al. (Abstract # 2505) fanden heraus, dass bei Patienten mit Ipilimumab-induzierter Kolitis/Diarrhoe der Serumspiegel des Zytokins Interleukin- 17 (IL-17) signifikant erhöht war. Patienten ohne therapieassoziierte Kolitis hatten auch keine erhöhten IL-17- Spiegel in Blut. IL-17 spielt auch bei Erkrankungen wie Morbus Crohn oder Colitis ulcerosa eine bedeutende Rolle.
Zerebral metastasierte Patienten: Ein Kollektiv, welches oftmals aufgrund schlechter Erkrankungsprognose aus klinischen Studien ausgeschlossen ist, sind Patienten mit zerebraler Metastasierung. D. Lawrence et al. (Abstract # 8523) untersuchen in einer Phase-II-Studie (Protokoll CA184-042) die Wirksamkeit von Ipilimumab bei Patienten mit ZNSMetastasen und fanden heraus, dass die Substanz in dieser Gruppe ähnliche Wirksamkeit hat wie bei nicht zerebral metastasierten Patienten.
Ipilimumab plus Bevacizumab: Eine weitere mit Spannung erwartete Studie wurde durch die Studiengruppe um S. Hodi (Abstract #8511) präsentiert. In dieser Phase-I-Studie wurde Ipilimumab (Yervoy®) 10 mg/kg KG mit dem VEGFAntikörper Bevacizumab (Avastin®) 15 mg/kg KG kombiniert, um synergistisch einen schnelleren und potenteren antitumorösen Effekt zu erzielen. Es zeigte sich ein additiver antineoplastischer Effekt in der beschriebenen Kombination (14/21 Patienten mit Therapieansprechen), jedoch auch ein deutlich verändertes Toxizitätsprofil (5/22 Patienten mit autoimmuner Hypophysitis). Eine weiterführende Phase-II-Studie mit einer höheren Patientenzahl ist derzeit in Planung.
Studien mit Vemurafenib
Die zweite erfolgreich in einer Phase-IIIStudie mit Melanompatienten getestete Substanz ist der für mutiertes B-raf spezifische Kinaseinhibitor Vemurafenib (vormals PLX4032). Bereits 2005 konnte gezeigt werden, dass ungefähr 50 % aller Melanome eine aktivierende Mutation in der B-raf-Kinase aufweisen, die im MAP-Kinase-Signalweg involviert ist und dass diese Veränderung das Wachstum der Tumorzellen antreibt. Zusätzlich liegen weit über 80 % dieser Mutationen an einer einzigen Position im Protein, was im Vergleich zu anderen mutierten Proteinen wie z. B. c-Kit eine einmalige Situation darstellt. Vemurafenib war der erste Kinaseinhibitor mit einer weitgehenden Selektivität für das mutierte Protein. Bereits im letzten Jahr konnte eine von Keith Flaherty und Kollegen durchgeführte Phase-I-Studie eine Ansprechrate von nahezu 80 % bei Patienten mit einer B-raf-V600E-Mutation zeigen.
In einer von Antonio Ribas am heurigen ASCO-Meeting vorgestellten Phase-IIStudie (B-raf in Melanoma 2 – BRIM2, Abstract # 8509) erhielten 132 B-rafmutierte, vorbehandelte Melanompatienten Vemurafenib in einer Dosierung von 960 mg 2-mal täglich. Die Ansprechrate betrug 53 %, wobei in 5 % komplette Remissionen beobachtet wurden. Weitere 29 % der Patienten erreichten zumindest eine Stabilisierung der Erkrankung. Bei einer medianen Nachbeobachtungszeit von 10 Monaten ist das mediane Gesamtüberleben in dieser Studie noch nicht erreicht, die 12-Monats-Überlebensrate lag bei 58 %.
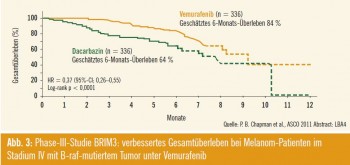
Late Breaking Abstract # 4: Mit großer Spannung wurde die randomisierte Phase- III-Studie von Vemurafenib im Vergleich zu Dacarbazin (BRIM3) erwartet, welche von Paul Chapman vorgestellt wurde. 675 nicht vorbehandelte Patienten mit einem B-raf-mutierten Stadium- IV-Melanom erhielten entweder 2-mal täglich 960 mg Vemurafenib oder 1.000 mg/m2 Dacarbazin im Abstand von 3 Wo chen. Das progressionsfreie Überleben verbesserte sich von 1,6 Monaten in der Dacarbazin-Gruppe auf 5,3 Monate in der Vemurafenib-Gruppe, ein objek – tives Ansprechen fand sich bei 5,5 % der Patienten unter Dacarbazin und bei 48,8 % der Patienten unter Vemurafenib. Aufgrund dieser positiven Daten wurde die Studie im Rahmen einer geplanten Interimsanalyse vorzeitig beendet und den Patienten ein Übertritt aus der Dacar bazin- in die Vemurafenib- Gruppe ermöglicht. Aufgrund der relativ kurzen medianen Nachbeobachtungszeit von 3,6 Monaten sind die Daten zum Gesamtüberleben noch nicht endgültig beurteilbar. Es zeigt sich jedoch ein geschätztes 6-Monats-Überleben von 84 % in der Vemurafenib-Gruppe gegenüber 64 % in der Dacarbazin-Gruppe und eine beeindruckende Reduktion des Mortalitätsrisikos von 63 % (Abb. 3).
Verträglichkeit: Die wesentlichen Nebenwirkungen der Vemurafenib-Therapie waren Arthralgien, Exantheme, Erschöpfung und bei 30 % der Patienten eine nach oft nur kurzer Sonnenexposition einsetzende phototoxische Hautreaktion. Eine spezielle Nebenwirkung von B-raf- Inhibitoren ist das Auftreten von Plattenepithelkarzinomen der Haut. Diese sind oft vom niedrig-malignen Keratoakan – thom-Typ und treten bei 20–26 % der Patienten meist innerhalb der ersten 8 Wochen nach Therapiebeginn auf. Die Grundlage dieser Nebenwirkung besteht darin, dass in diesen Tumoren eine Hras- Mutation vorliegt. Durch die teilweise Blockade des in diesen Zellen nicht mutierten B-raf-Proteins durch Vemurafenib kommt es zu einer Aktivierung des onkogenen Effekts von H-ras und damit zur Tumorentstehung. Diese Tumoren können jedoch in lokaler Betäubung entfernt werden und haben nicht zu Therapieabbrüchen geführt.
Patienten mit zerebralen Metastasen waren in der BRIM3-Studie nicht zugelassen. Frühe Berichte zeigen jedoch auch bei dieser Patientengruppe einen Benefit mit der Vemurafenib-Therapie (R. Dummer, Abstract # 8548). Eine auch im Hinblick auf das Nebenwirkungsprofil von B-raf-Inhibitoren interessante Studie wurde von Jeffrey Infante vorgestellt. In einer Phase-I/II-Studie erhielten 109 Patienten mit metastasiertem, B-raf-mutiertem Melanom ansteigende Dosen des mutationsspezifischen B-raf-Inhibitors GSK436 in Kombination mit dem MEKInhibitor GSK212. Die objektiven Ansprechraten dieser doppelten Hemmung des MAP-Kinase-Signalwegs lagen in den verschiedenen Dosisgruppen zwischen 50 und 77 %, schließt man Patienten mit stabiler Erkrankung ein, so profitierten sogar 95–100 % der behandelten Patienten. Besonders interessant war jedoch auch, dass unter der Kombinationstherapie bei weniger als 1 % der Patienten ein Plattenepithelkarzinom der Haut auftrat. Man nimmt an, dass die unterhalb von B-raf gelegene Kinase MEK auch in den Signalweg von Rasmutierten Zellen eingebunden ist und somit der tumorfördernde Effekt des Braf- Inhibitors in H-ras-mutierten Keratinozyten (welcher auch unter einer Monotherapie mit GSK436 beobachtet wurde) ausgeglichen wird.
ZUSAMMENFASSEND werden die am heurigen ASCO-Meeting präsentierten Daten die Behandlung des metastasierten Melanoms deutlich zum Positiven verändern. Gleichzeitig hat sich auch gezeigt, dass Ipilimumab und Vemurafenib als Vorreiter bereits den Anstoß zu einer Reihe von interessanten Kombinationsstudien gegeben haben, welche bereits in frühen Phasen Hoffnung auf eine weitere Verbesserung des Ansprechens, der Verträglichkeit und der Anzahl der davon profitierenden Melanompatienten geben.
Dieser Beitrag erscheint ebenfalls in
- „UNIVERSUM INNERE MEDIZIN“
- „Jatros Dermatologie/Onkologie“