ASCO 2012: Lungenkarzinom – auf dem Weg zur personalisierten Medizin
Im Fokus: Biomarker-Studien
Das Thema Biomarker war einer der Schwerpunkte auf diesem Kongress. Es geht dabei vor allem um die weitere Personalisierung der Therapie, aber auch um Marker mit prognostischem und/oder prädiktivem Wert. Dabei wurde nicht nur nach neuen Targets für therapeutische Ansätze gesucht, sondern auch die molekularbiologische Entschlüsselung bisher eher im Hintergrund stehender Pathologien wie Plattenepithelkarzinom, kleinzelliges Lungenkarzinom oder Mesotheliom in Angriff genommen.
FGFR1, PTEN, PIK3CA: Zwei detaillierte Untersuchungen zur genetischen Charakterisierung des Plattenepithelkarzinoms der Lunge, Abstract #7505 von Paik et al. und Abstract #7506 von Govindan et al., ein „Cancer Genome Atlas“-Projekt des National Cancer Institute (NCI) zeigen, dass auch das Plattenepithelkarzinom eine Reihe von aktivierenden Mutationen ausbilden kann, welche als potenzielle Therapieziele infrage kommen, so vor allem FGFR1 („fibroblast growth factor receptor type 1“), PTEN und PIK3CA.
Besonders die Amplifizierung des FGFR1 wurde in verschiedenen Abstracts (#7041, #7061, #7063 und #7545) untersucht, eine erhöhte Genexpression von FGFR1 zeigt sich in 15–25 % der Fälle und war mit einem schlechten Outcome assoziiert, womit es ein interessantes therapeutisches Ziel für diesen histologischen Tumortyp darstellt.
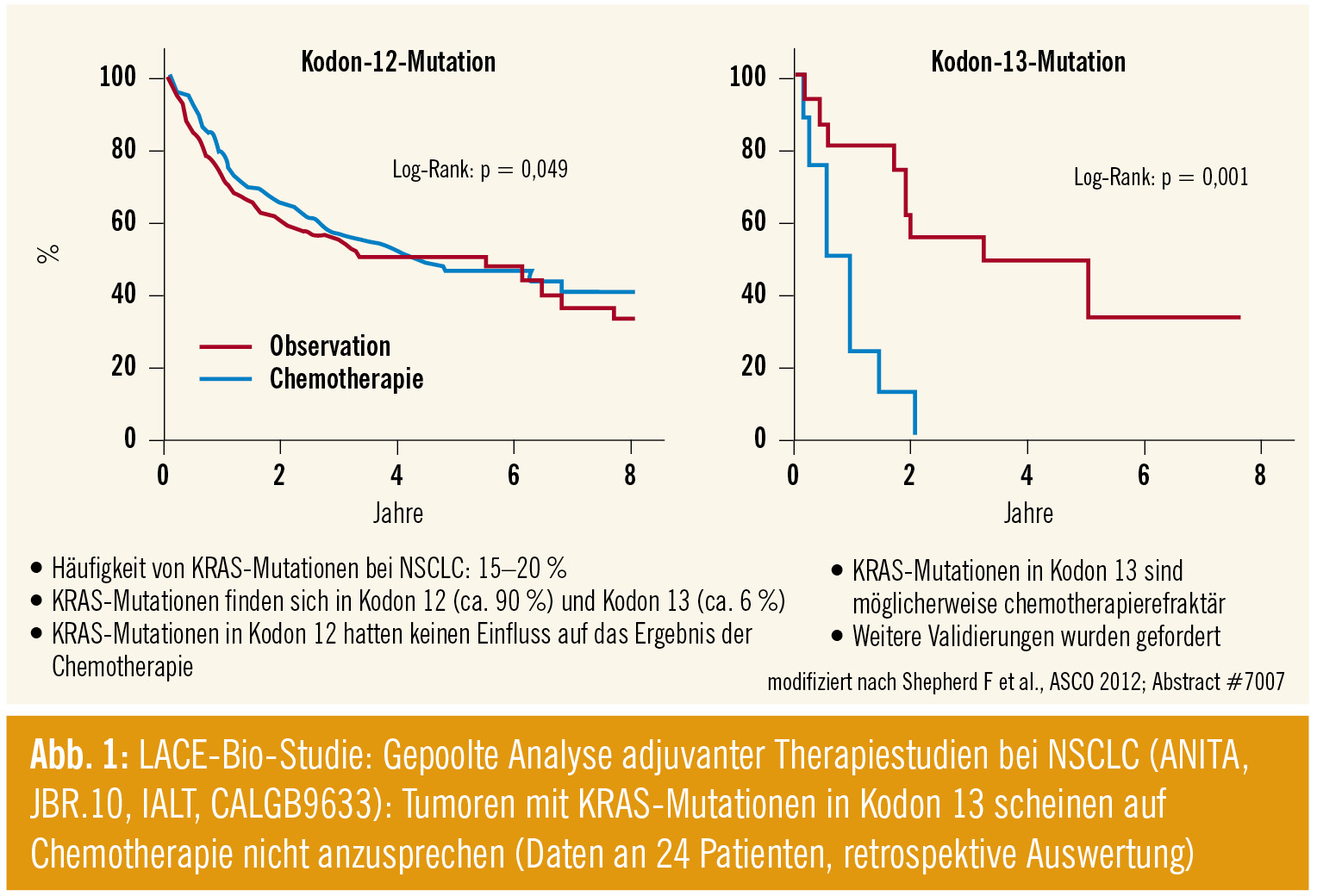
LACE-Bio-Studie: Interessant war auch eine weitere Auswertung der unter LACE-Bio zusammengefassten adjuvanten Studien bezüglich der prognostischen und prädiktiven Eigenschaften von KRAS beim NSCLC (Abstract #7007, F. Shepherd), welche zeigte, dass dieses in diesem Setting keinen prognostischen Marker darstellt. Bezüglich der Prädiktion hatten Patienten mit einer Mutation im Codon 13 einen deutlich schlechteren Verlauf (HR 5,78) unter adjuvanter Chemotherapie als die Kontrollgruppe (Abb. 1). Allerdings war diese Patientenzahl mit 24 sehr klein (Gesamtstudienpopulation mit KRAS-Untersuchung: n = 1532; davon Patienten mit KRAS-Mutationen: n = 300).
Bedeutung der Lymphknotenresektion: Eine andere Art von Biomarker wurde von Ogbata et al. (Abstract #7025) untersucht: Dabei geht es um die prognostische Bedeutung der Anzahl der resezierten und histologisch untersuchten Lymphknoten bei operierten pN0-NSCLC. Es wurden > 8000 Resektionen der SEER-Datenbank von 1998–2002 retrospektiv analysiert. Im Median wurden 6 Lymphknoten reseziert, mehr im Falle einer Pneumonektomie oder Lobektomie, weniger bei sublobularen Resektionen. Die Anzahl der untersuchten Lymphknoten korrelierte mit dem Gesamtüberleben und dem krebsspezifischen Überleben, wobei bei 8 Lymphknoten ein Plateau erreicht war (p < 0,05). Das unterstreicht die Wichtigkeit der Lymphknotenresektion zur Optimierung der Ergebnisse von Lungenresektionen – dies sollte den Thoraxchirurgen bewusst sein.
Lokal fortgeschrittenes Lungenkarzinom
Im lokal fortgeschrittenen, inoperablen Stadium befassten sich die Präsentationen mit der Kombination von Chemo- und Strahlentherapie, deren bester Abfolge und der Möglichkeiten zur Steigerung der Effizienz. Die wichtigsten Ergebnisse kann man folgend zusammenfassen:
Die Frage der Sinnhaftigkeit einer konsolidierenden Chemotherapie nach dem Abschluss einer konkomitanten Chemoradiatio beschäftigte eine Literaturzusammenstellung, eine Phase-III- sowie eine Phase-II-Studie (Abstracts #7000, #7001 und #7002). Zum jetzigen Zeitpunkt muss man festhalten, dass eine solche offenbar die klinische Effizienz nicht zu verbessern vermag. Die Überlebensdaten sind gegenüber den Kontrollgruppen nicht verbessert, die Zeit bis zur Progression ist länger, allerdings unter erhöhter Toxizität. Im Fall der Chemoradiatio mit der Kombination Pemetrexed/Cisplatin und anschließender Pemetrexed-Konsolidierung stehen derzeit nur Sicherheitsdaten zur Verfügung, eine entsprechende Phase-III-Studie ist noch ausständig. Auch die Kombination mit Bevacizumab oder Cetuximab war in diesem Setting nicht überzeugend (Abstracts #7018 und #7019). Die Studie von Okamoto et al. (Abstract #7017) mit dem Vergleich einer Standardradiatio bei älteren Patienten mit lokal fortgeschrittenem NSCLC gegenüber einer konkomitanten Therapie mit täglichem Carboplatin ergab einem Vorteil für Patienten im Chemoradatioarm. Eine Selektion hinsichtlich Allgemeinzustand und Komorbiditäten ist in diesem Fall die Voraussetzung. Ebenfalls eine sorgfältige Selektion erfordert die Durchführung einer trimodalen Therapie mit Chemoradiatio als Induktion und einer zusätzlichen Operation. Die kanadische Arbeit von Shan et al. (Abstract #7020) zeigte neuerlich, dass dies in speziellen Fällen eine Option für sonst inoperabel eingeschätzte Patienten darstellt.
Metastasiertes Lungenkarzinom
Das metastasierte Stadium ist sicherlich das am breitesten untersuchte Gebiet mit den größten Studien und den interessantesten Ergebnissen, welche auch das Potenzial besitzen, den klinischen Alltag zu beeinflussen.
Erstlinientherapie
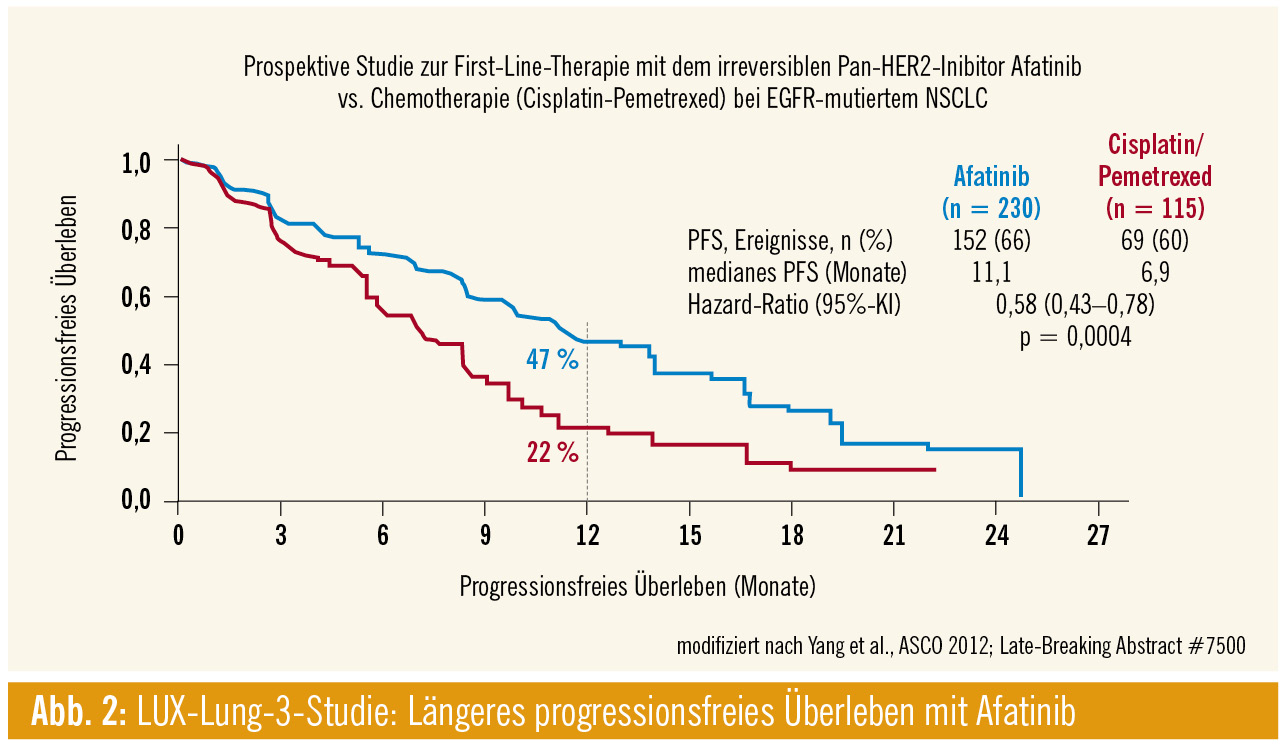
LUX-Lung-3-Studie: An erster Stelle sei hier die Studie LUX-Lung 3 von Yang et al. (LBA #7500) genannt, der Vergleich einer First-Line-Therapie mit dem irreversiblen Pan-HER2-Inhibitor Afatinib gegen eine Kombination von Cisplatin und Pemetrexed bei Patienten mit aktivierender Mutation im EGF-Rezeptor. Die Randomisierung erfolgte im Verhältnis 2 : 1, 245 Patienten waren eingeschlossen. Der primäre Endpunkt – eine Verbesserung des progressionsfreien Überlebens – wurde erreicht, das Ergebnis war hochsignifikant (11,1 vs. 6,9 Monate, HR = 0,58; Abb. 2). Für die Untergruppe der beiden häufigsten Mutationen (L585R und Deletion 19) stieg die mediane Überlebenszeit auf 13,6 Monate (HR = 0,47). Die Nebenwirkungen entsprechen jenen der Therapie mit anderen EGFR-TKI, hauptsächlich Diarrhö und Hautausschlag.
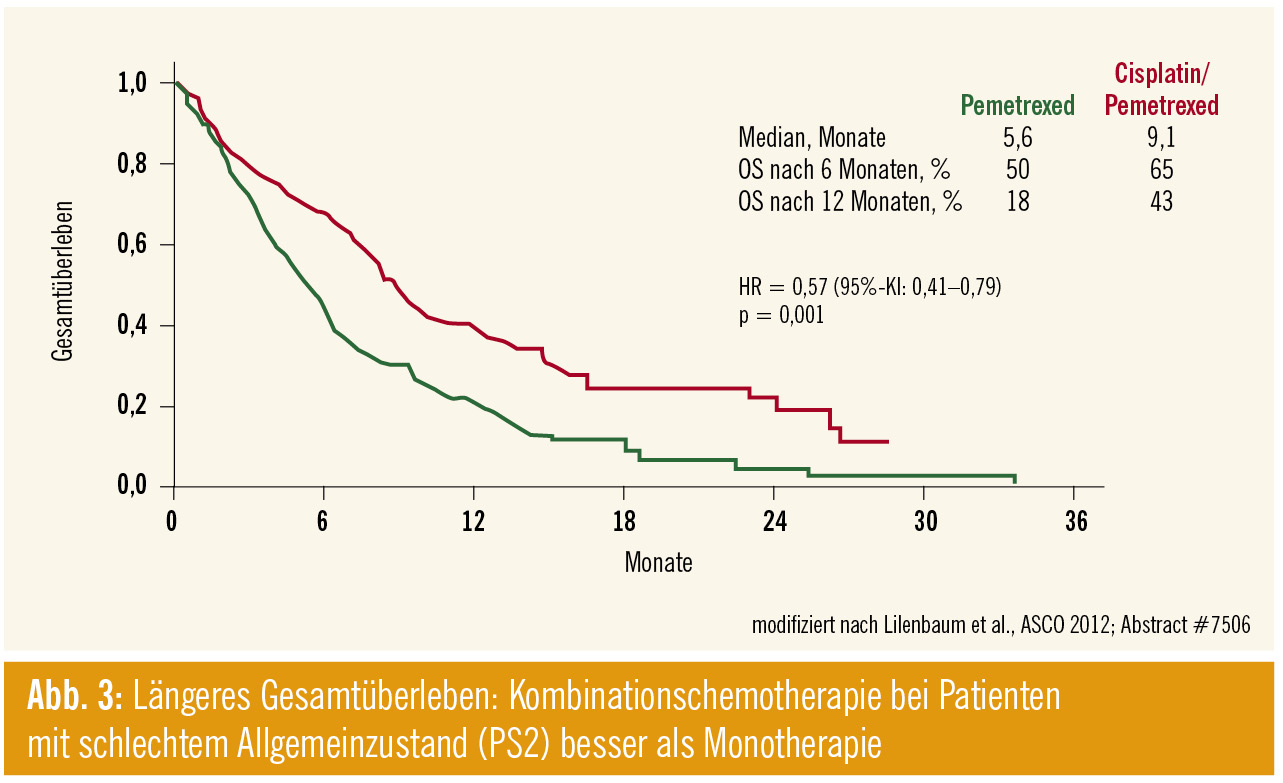
Mono- oder Kombinationstherapie bei PS2: Einer Klärung der Frage, ob Patienten in einem schlechten Allgemeinzustand (Performance Status 2) eine Monotherapie oder eine platinhaltige Kombinationstherapie erhalten sollten, näherte sich die Studie von Lilenbaum et al. (Abstract #7506). In der Studie wurde die Monotherapie mit Pemetrexed gegen eine Kombination aus Pemetrexed/Cisplatin verglichen. Dabei schnitt die Kombination im primären Endpunkt und in den sekundären Endpunkten besser ab: das Gesamtüberleben war verlängert, ebenso die Ansprechrate sowie auch die progressionsfreie Zeit (n = 205, HR = 0,57; Abb. 3).
Chemotherapie plus Tyrosinkinasehemmer: Tony Mok stellte die hypothetisch interessante Variante einer Kombination aus Chemotherapie und Tyrosinkinasehemmer vor: in FASTACT-II erhielten 451 unselektionierte Patienten Platin/Gemcitabin (Tag 1 + 8, alle 4 Wochen) mit Erlotinib oder Placebo an den Tagen 15–28 (Abstract #7519) inklusive einer Erhaltungstherapie mit Erlotinib oder Placebo. Die Patienten im Erlotinib-Arm hatten ein signifikant längeres progressionsfreies Überleben (PFS median 7,6 vs. 6,0 Monate; HR = 0,57), auch das Ansprechen war deutlich verbessert. Das Gesamtüberleben war nicht signifikant verlängert, wahrscheinlich aufgrund des hohen Anteils an TKI in der „second line“.
Update OPTIMAL-Studie: Ein weiteres Update brachten Zhou et al. mit aktuellen Daten zum Gesamtüberleben in der OPTIMAL-Studie (Erlotinib versus Gemcitabin/Carboplatin bei Patienten mit EGFR-Mutation, Abstract #7520). In dieser Population hatten die Patienten unter Erlotinib ein signifikant längeres PFS mit 13,7 vs. 4,6 Monate, HR = 0,160). Auch hier war die Gesamtüberlebenszeit nicht signifikant unterschiedlich. Bei beiden Studien könnte man kritisch anmerken, dass nach heutiger Sicht bei einer Population mit überwiegend Adenokarzinomen eine Kombination mit Gemcitabin nicht mehr den optimalen Standard darstellt.
Update WJTOG3405-Studie: Mitsudomi präsentierte das Update der Studie WJTOG3405 der westjapanischen Studiengruppe (Abstract #7521). Darin eingeschlossen waren Patienten mit einer Mutation im EGF-Rezeptor, die entweder Gefitinib oder Cisplatin + Docetaxel erhielten. Die mediane Überlebenszeit betrug in beiden Gruppen rund drei Jahre, allerdings wurden mehr als 3/4 der Patienten sowohl mit Chemotherapie als auch mit Gefitinib behandelt. Jene Patienten, welche nur Gefitinib erhielten, kamen auf eine mediane Überlebenszeit von 45 Monaten. Daraus wurde gefolgert, dass Gefitinib bei EGFR-Mutation einen Standard in der First-Line-Therapie darstellt.
Erhaltungstherapie
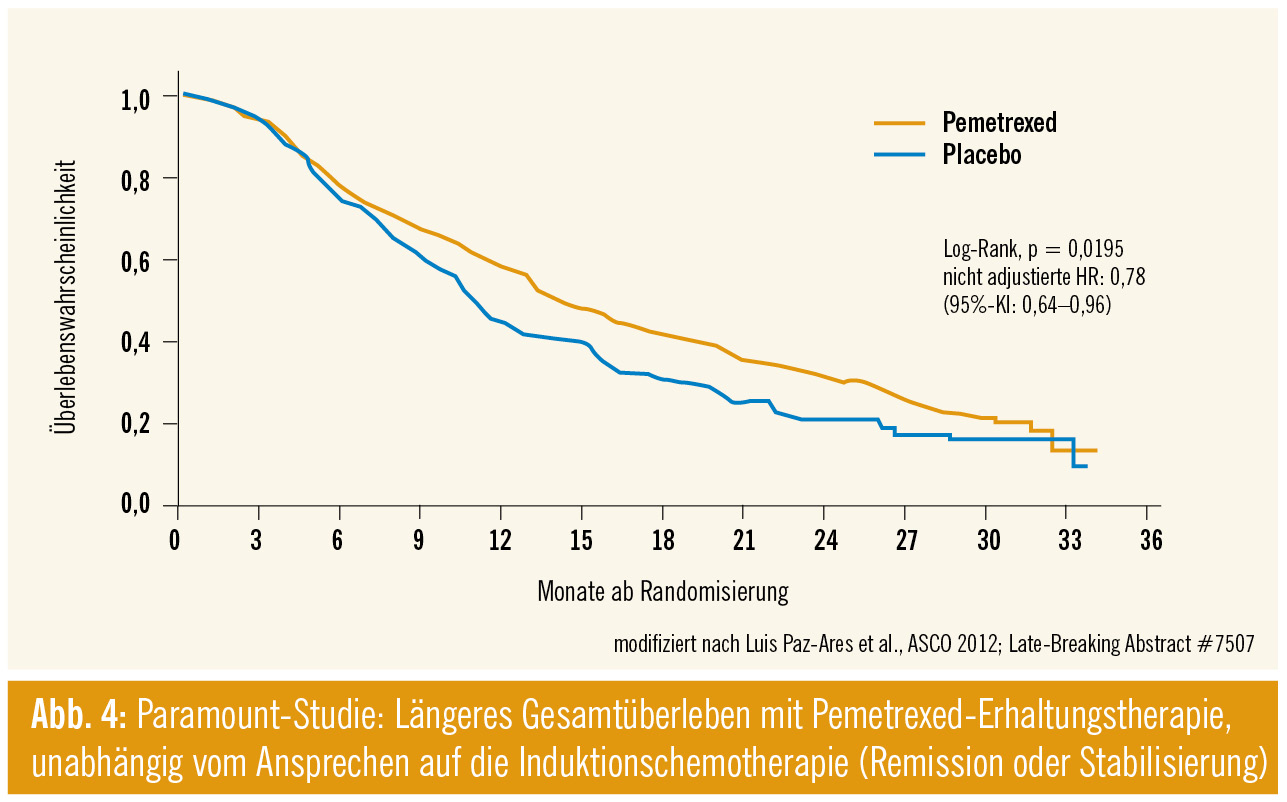
PARAMOUNT-Studie mit Pemetrexed: Das Thema Erhaltungstherapie war dominiert von den lange erwarteten Überlebensdaten der PARAMOUNT-Studie (Abstract #LBA7507). Die Studie untersuchte eine „Continuation“-Therapie mit Pemetrexed nach einer Induktionsphase mit Pemetrexed + Cisplatin. Im Vorjahr konnte bereits gezeigt werden, dass das progressionsfreie Überleben mit dieser Strategie signifikant verlängert wird, nunmehr zeigte sich auch ein Vorteil beim Gesamtüberleben (HR = 0,78; Abb. 4). Dies traf auf alle untersuchten Subgruppen zu, auch was ein unterschiedliches Ansprechen auf die Induktionstherapie betrifft (partielle Remission versus stabiler Verlauf). Damit wird die Strategie der Fortführung einer Monotherapie nach erfolgter Kombinationstherapie bestätigt, zumindest für Patienten, die eine fortlaufende Therapie tolerieren.
Weitere Therapielinien
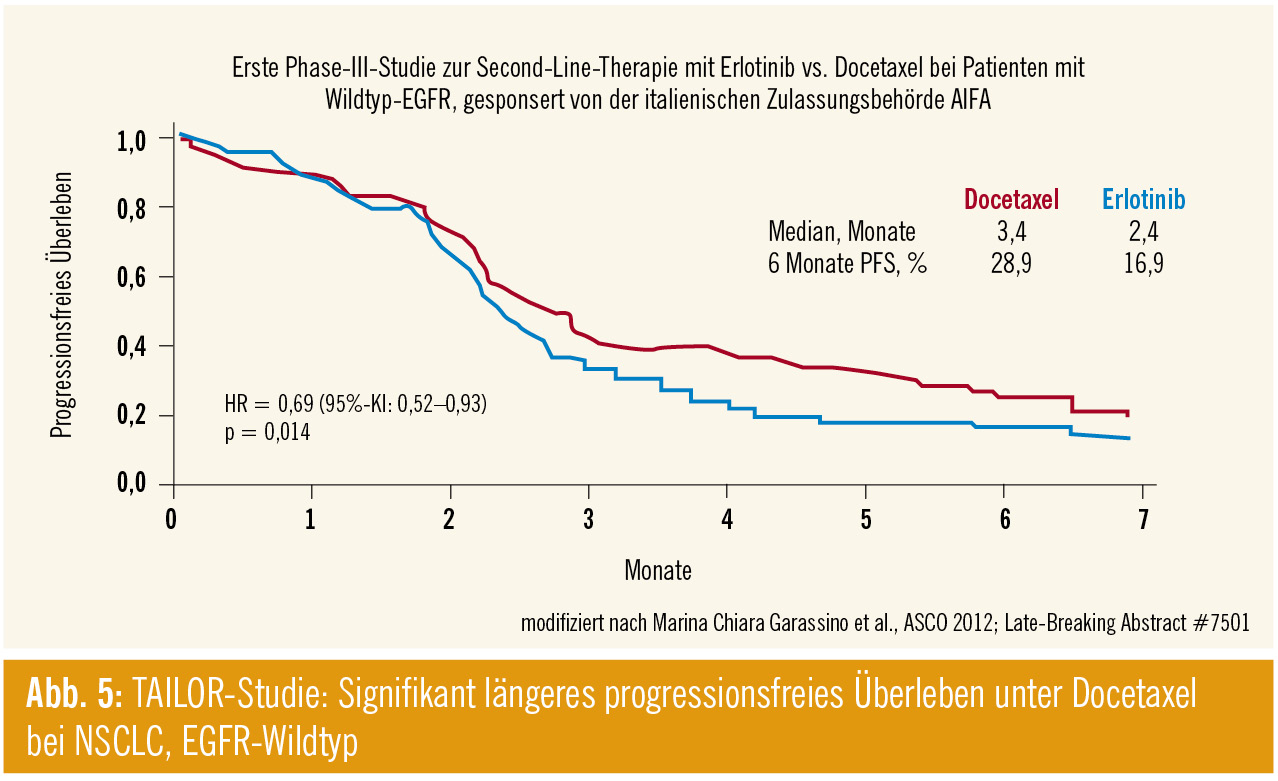
TAILOR-Studie: Einen wichtigen Beitrag lieferten Garassino et al. mit TAILOR, einer Studie zum Vergleich von Erlotinib versus Docetaxel in der Second-Line-Therapie bei Patienten mit Wildtyp-EGFR (Abstract #LBA7501; Abb. 5). Sie konnten zeigen, dass Docetaxel bei diesen Patienten das progressionsfreie Überleben, die Ansprechrate und Krankheitskontrolle signifikant verbessert. Die Daten zum Gesamtüberleben konnten noch nicht ausgewertet werden.
Auch diese Studie hat das Potenzial, die bisherige klinische Praxis zu verändern, und unterstreicht, dass man mit der Verabreichung von zielgerichteten Substanzen bei molekularbiologisch unselektionierten Patienten kritisch umgehen sollte.
Cetuximab in der Second-Line-Therapie in Kombination mit Pemetrexed oder Docetaxel wurde in SELECT geprüft, dabei konnte kein Einfluss auf das PFS oder das Gesamtüberleben festgestellt werden (Abstract #7502).
Kleinzelliges Lungenkarzinom, SCLC
Kotani präsentierte die Ergebnisse einer japanischen Studiengruppe (JCOG0509, Abstract #7003) zum Vergleich zwischen Amrubicin/Cisplatin und der Standardtherapie Irinotecan/Cisplatin beim metastasierten SCLC. Die neue Kombination konnte dabei das Ziel der „non-inferiority“ nicht erreichen, verbunden mit einer erhöhten Rate an febrilen Neutropenien, sodass gefolgert wurde, dass die Kombination Irinotecan + Cisplatin weiter den Standard in Japan darstellt.
Beim SCLC im Stadium „limited disease“ war interessant, dass die Studie von Park et al. (Abstract #7004) zeigen konnte, dass der Beginn einer konkomitanten Strahlentherapie mit dem dritten Zyklus der Chemotherapie jenem bei gleichzeitiger Gabe mit dem ersten Zyklus nicht unterlegen war, die Rate an febrilen Neutropenien war aber geringer. Diese Ergebnis unterstützt die Wirksamkeit einer konkomitanten Therapie im Stadium „limited disease“ generell und besonders den Beginn ab dem dritten Zyklus Chemotherapie – was sicher auch der gelebten Praxis entgegenkommt.
In einer weiteren japanischen Studie (Abstract #7028, Kubota et al.) beim kleinzelligen Karzinom im Stadium „limited disease“ wurde – ähnlich wie beim NSCLC – der Effekt einer konsolidierenden Chemotherapie nach erfolgter konkomitanter Chemoradiatio untersucht. Auch bei diesem histologischen Typ konnte mit der weiteren Chemotherapie keine Steigerung der Effizienz erzielt werden, sodass dass die Chemoradiatio alleine weiterhin als Standard angesehen wird.
Zusammenfassung
Wie jedes Jahr kann man auch heuer wieder feststellen, dass der Weltkongress für Onkologie einige neue Aspekte in unseren Behandlungsalltag von Patienten mit Bronchialkarzinom zu bringen vermag. Die Richtung geht immer mehr in eine therapeutische Differenzierung entsprechend der Patientenselektion. Dies trifft vor allem im Bereich der molekularbiologischen Substanzen zu. Hier gilt es bereits als obsolet, diese Substanzen ohne Target-Nachweis zu verabreichen. Damit tritt aber auch die Erforschung der molekularen Strukturen in den Mittelpunkt des Interesses. Da diese Biomarker nur bei einem begrenzten Anteil der Patienten nachweisbar sind, gestaltet sich die Rekrutierung der entsprechenden Studien oft schwierig. Die bisherigen Ergebnisse rechtfertigen aber in jedem Fall eine gezielte Vorgehensweise, sodass wir zwar langsam, aber beständig dem Ziel einer individualisierten Therapie beim Lungenkarzinom näher kommen.