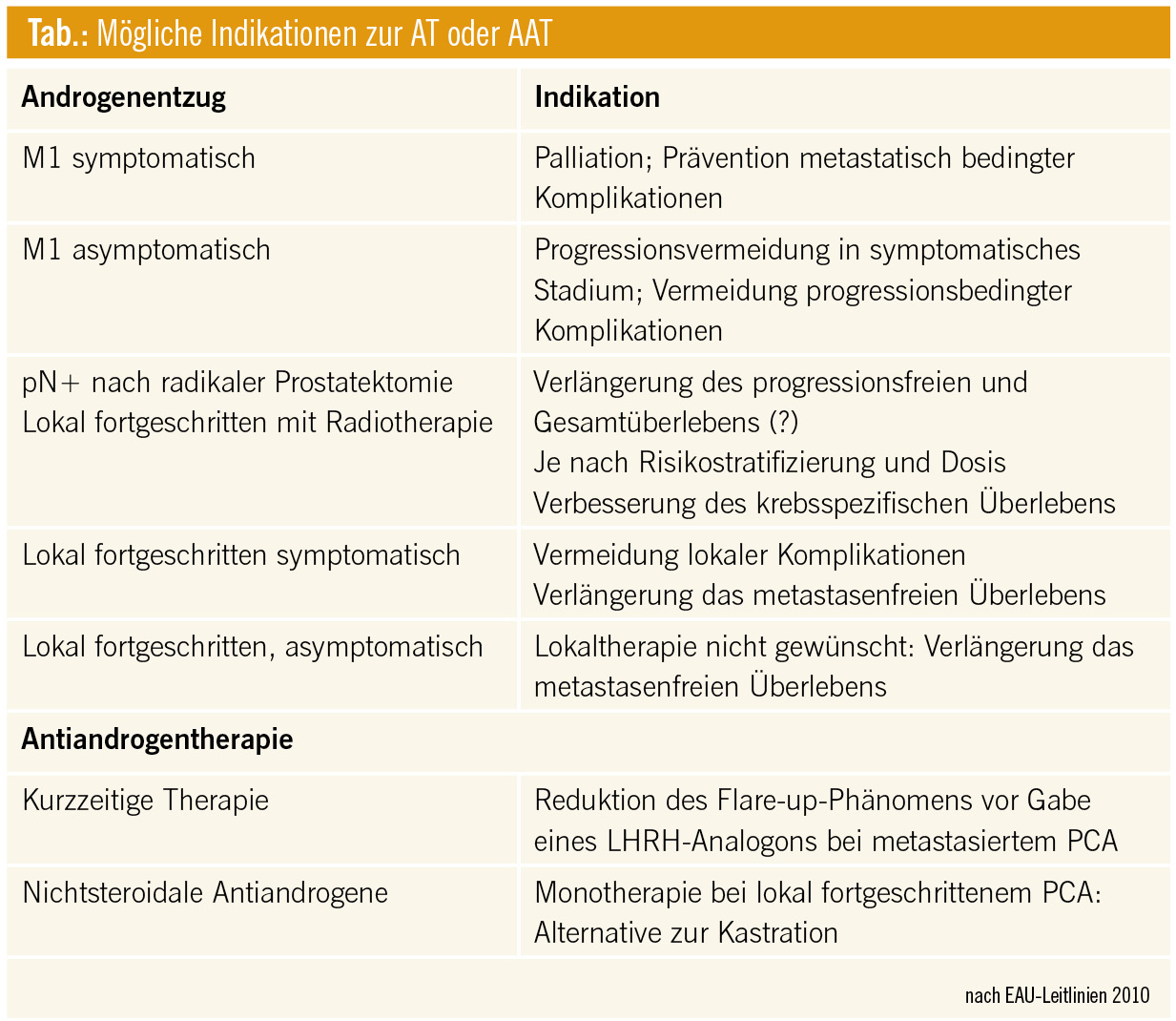
ASCO 2012: Neues zur intermittierenden Androgenblockade
Hypothesen zum Einsatz der IAD: Grundsätzlich wurde die IAD aus mehreren interessanten Hypothesen entwickelt (Hinauszögern des kastrationsrefraktären Stadiums, Reduktion der Nebenwirkungen, geringere Medikamentenkosten), mit Ausnahme einer Phase-III-Studie (Da Silva, Eur Urol 2009) bestehen zum heutigen Zeitpunkt jedoch nur etwa ein gutes Dutzend kleiner, inhomogener Phase-II-Studien in der Literatur. Speziell der in Tierexperimenten postulierte Effekt einer Verzögerung der Androgenresistenz wurde zwischenzeitlich nicht bestätigt, die Hoffnung auf eine äquivalente Tumortherapie bei reduzierten Nebenwirkungen besteht jedoch nach wie vor, auch wenn in den wesentlichen internationalen Guidelines (EAU, S3-Leitlinien der DGU) die IAD aufgrund der fehlenden Studien nur sehr vorsichtig empfohlen wird („no longer investigational“, „kann eingesetzt werden, fehlende Langzeitdaten“).
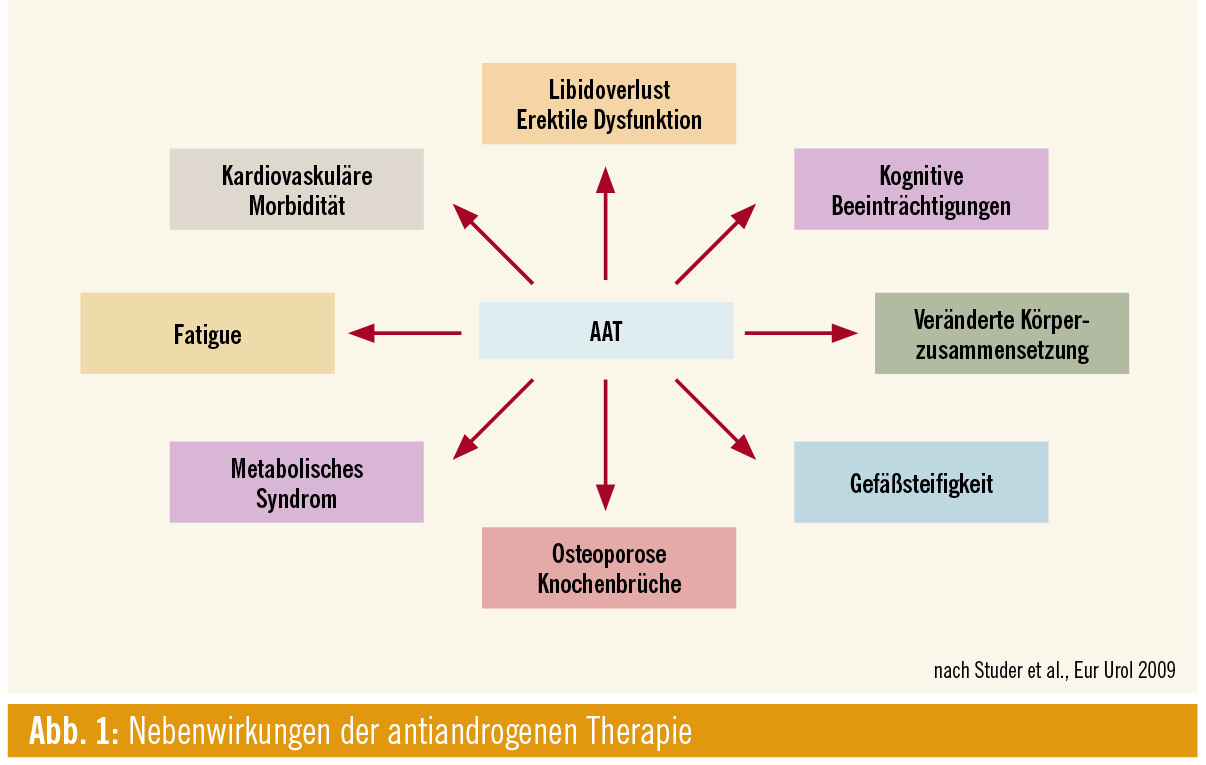
Unbestritten ist heutzutage jedenfalls die Vielzahl möglicher Nebenwirkungen einer (kontinuierlichen) Hormontherapie beim Prostatakarzinom (Abb. 1). Während schon bisher gute Kenntnisse bezüglich der sexuellen Nebenwirkungen (erektile Dysfunktion, Libidoverlust) und auch der negativen Auswirkungen auf die Knochendichte vorhanden waren, werden nun immer deutlicher auch Auswirkungen auf den Glukose- und Lipidstoffwechsel publiziert, die in einer (retrospektiv festgestellten) Zunahme des metabolischen Syndroms und des kardiovaskulären Risikos resultieren.
Interessant ist hier wiederum, dass diese Erkenntnisse sich auch in den bisherigen Phase-III-Daten von Da Silva und Klotz (nicht publiziert) insofern widerspiegeln, als auch in diesen Studien die prostatakarzinomspezifische Mortalität im IAD-Arm höher lag, das kardiovaskuläre Risiko aber bei der kontinuierlichen Hormonablation höher lag.
Studienergebnisse: Vor diesem brisanten Hintergrund wurden am ASCO 2012 nun die ersten Ergebnisse einer internationalen Multicenterstudie präsentiert. Ziel war der Nachweis einer Nichtunterlegenheit (non-inferiotity) der IAD versus maximale Androgenblockade (MAB) (Goserelin und Bicalutamid) bei nicht vorbehandelten Patienten mit Metastasierung und einem PSA 5–100 ng/ml. Im Zeitraum 1995–2008 wurde von mehreren renommierten Studiengruppen (wesentlich: SWOG, ECOG, EORTC) die Studie S9346 angeboten. Insgesamt wurden 3.040 Männer in die Studie aufgenommen. Nach einer Induktionsphase von 6 Monaten wurden jene Männer, die mit dem PSA < 4 ng/ml ansprachen, in den IAD- (n = 770) versus MAB-Arm (n = 765) randomisiert. Das Durchschnittsalter lag in beiden Gruppen bei 70 Jahren, primärer Endpunkt war eine non-inferiority im Gesamtüberleben.
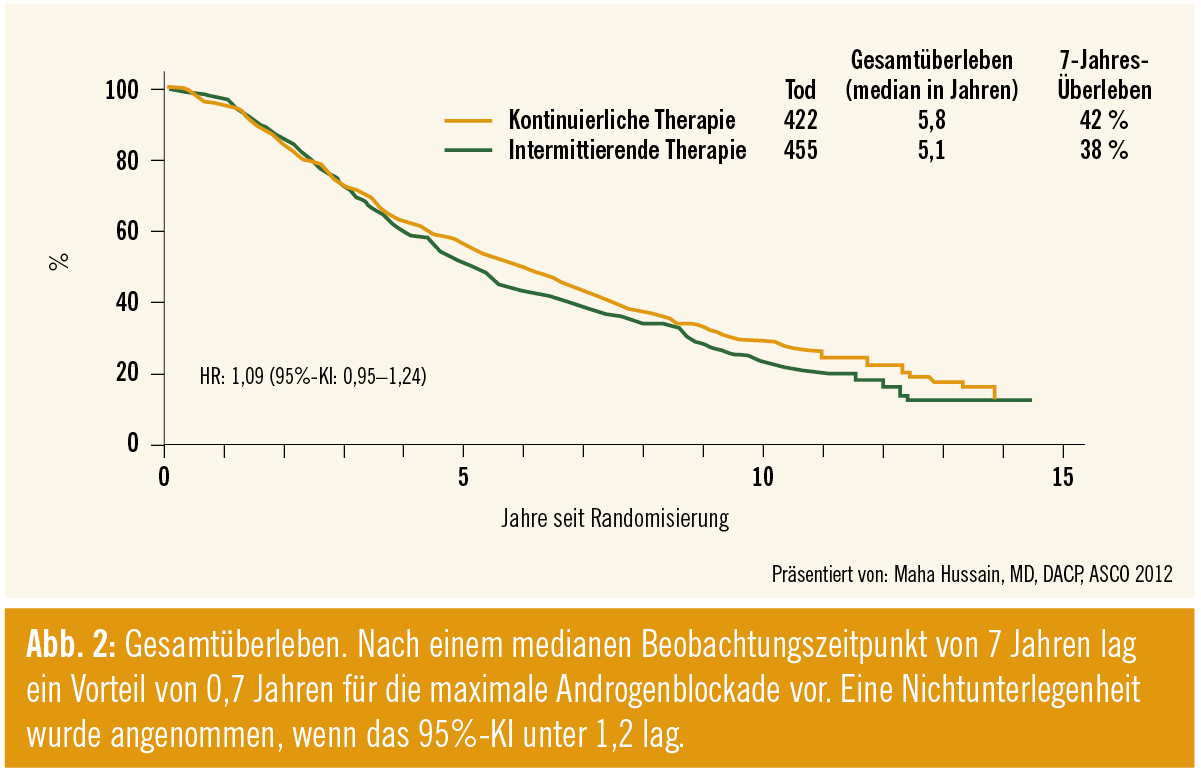
Nach einem medianen Beobachtungszeitpunkt von 7 Jahren lag ein Vorteil von 0,7 Jahren (5,8 vs. 5,1) für die MAB vor (HR 1,09 % (95%-KI: 0,95–1,24) (Abb. 2). Eine Nichtunterlegenheit wurde angenommen, wenn das 95%-KI unter 1,2 lag.
Wesentliche Subgruppenanalysen waren minimale versus ausgeprägte Metastasierung, hierbei zeigte sich vor allem ein Vorteil für jene Männer, die eine nur geringe Metastasierung hatten (keine viszeralen Metastasen, keine Metastasierung von Schädelknochen oder Rippen) (HR: 1,23; 95%-KI 1,02–1,49). Dies entsprach einem Überlebensvorteil von 7,1 versus 5,2 Jahren. Bei ausgeprägter Metastasierung zeigte sich ein geringer Vorteil für die IAD (5,0 vs. 4,4 Jahre).
Insgesamt kommen die Autoren dieser Studie zu dem Schluss, dass die IAD der kontinuierlichen Hormonblockade unterlegen ist und in der geprüften Indikation nicht angeboten werden sollte.
Interessante Fragen, die sich in Zusammenschau der neuen Daten ergeben, sind im Wesentlichen:
1) Bedeutet die maximale Androgenblockade in der kontinuierlichen Therapie den Therapiestandard (z.B. Goserelin und Bicalutamid)?
2) Wäre die Unterlegenheit auch mit einer alleinigen LHRH-Analoga oder LHRH-Antagonisten-Therapie vorgelegen? Immerhin gibt es eine große Metaanalyse aus 27 Publikationen aus dem Jahr 2000 (n = 8.000 Männer), wo der Zusatz eines Antiandrogens zur Hormonablation je nach Stadium und Aggressivität des Tumors einen Unterschied im Gesamtüberleben von 2 bis max. 5 % zugunsten der MAB zeigte. Bei einer beträchtlichen Zunahme der Nebenwirkungen ist dieser Unterschied für die meisten Patienten nicht ausreichend relevant, sodass die MAB zum Beispiel in Österreich wenig Einsatz findet.
3) Zu welchem Zeitpunkt sollte der Einsatz einer Therapie erfolgen, und in welchem Maß hängt das vorliegende Ergebnis vom Zeitpunkt der Intervention ab?
In der prominentesten Studie zu dieser Fragestellung (EORTC-Studie 30891) wurden 1.002 Patienten mit einem lokal fortgeschrittenen, asymptomatischen PCA prospektiv randomisiert einer sofortigen Hormontherapie bzw. einer verzögerten Therapie im symptomatischen Progress zugeführt und zeigten nach einer mittleren Nachbeobachtungszeit von 10 Jahren keinen statistisch signifikanten Vorteil in Bezug auf das tumorspezifische Überleben (29 % vs. 26,2 %) bei Männern mit früher Therapie. Immerhin 25,6 % verstarben nicht tumorbedingt, ohne eine ADT trotz fortgeschrittenem PCA benötigt zu haben.
Die interessanteste Frage erscheint jedoch zu sein, ob es bei einer Therapieform (die Hormonablation beim metastasierten Prostatakarzinom ist eine palliative Therapie), bei der eine Verbesserung des gesamt- oder karzinomspezifischen Überlebens per se nicht nachgewiesen ist, eine „Unterlegenheit“ geben kann? Ist im Umkehrschluss hierbei ein Nachweis einer Wirksamkeit der Hormontherapie gegeben? Wäre ein dritter Arm (Therapie nur bei Symptomatik) notwendig gewesen?
Weitere Spekulationen einer möglichen Sinnhaftigkeit einer IAD wären auch zu tätigen, wenn man die wachsende Kaskade an Therapiemöglichkeiten für das kastrationsrefraktäre Stadium betrachtet. In der Ära von First- und Second-Line-Chemotherapie, Abirateron, Sipuleucel und weiteren Entwicklungen (z. B. Alpharadin), wo in den meisten Fällen eine Hormonblockade weiter aufrechterhalten wird, ist eine langfristige Abwägung von Nutzen zu Nebenwirkungen immer schwieriger zu beurteilen.