Neue Entwicklungen am Gebiet der Stammzelltransplantation
In insgesamt 14 Sitzungen des letzten ASH-Meetings wurde das Thema allogene und autologe Stammzelltransplantation (SCT) behandelt. Aus diesen wurden 5 klinisch relevante Themen herausgegriffen.
Komorbidität und allogene Stammzelltransplantation
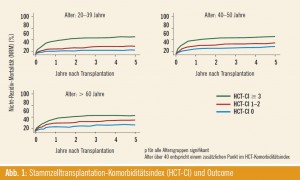
In mehreren Abstracts von Sorror M. at all bestätigte sich, dass der HCT-CI (Hämatopoetic Cell Transplantation-Comorbidity Index; HCT-Komorbiditätsindex) eine hohe Aussagekraft bezüglich der transplantassoziierten Mortalität (Transplant-related Mortality, TRM) und Inzidenz der Graft-versus-Host-Erkrankung (GVHD) bei allogener Stammzelltransplantation hat (Z. B. Mohamed L. Sorror, Abstr. #145, #665, #326).
Beim HCT-Komorbiditätsindex werden vor allem die kardialen, pulmonalen und hepatalen Komorbiditäten hoch bewertet. Dies ist plausibel, da besonders nach allogener Stammzelltransplantation die pulmonalen und hepatalen Toxizitäten hauptverantwortlich für die transplantassoziierte Mortalität sind. Ostronoff zeigte bei insgesamt 3000 Patienten, dass der HCT-Komorbiditätsindex in Hinsicht auf die transplantassoziierte Mortalität für alle Altersgruppen in signifikanter Weise prädiktiv ist (Abb. 1) (Fabiana Ostronoff et al., Abstr. #665). In einem weiteren Abstract von Sorror M. war der HCT-Komorbiditätsindex prädiktiv für die Entwicklung einer Grad-III/IV-GVHD, und die GVHD-assoziierte Mortalität war bei Patienten mit hoher Komorbidität signifikant erhöht (Mohamed L. Sorror, Abstr. #156).
Indikationen und Art der Stammzelltransplantationen weltweit
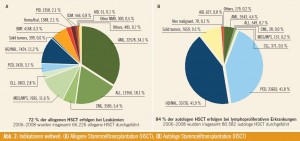
Bei insgesamt 140.000 Stammzelltransplantationen, die zwischen 2006 und 2008 analysiert wurden, zeigte sich, dass in Europa 60 % autologe Stammzelltransplantation durchgeführt werden, von den 40 % allogenen Stammzelltransplantationen werden jeweils 20 % mit HLA-gematchten verwandten Spendern bzw. mit unverwandten Spendern durchgeführt (Abb. 2) (Dietger Niederwieser, Abstr. #1016).
Bei den allogenen Stammzelltransplantationen sind die akuten Leukämien mit insgesamt 52 % die führende Indikation. Jeweils 11 % der Patienten werden mit myelodysplastischen Syndromen (MDS) bzw. mit Non-Hodgkin-Lymphomen (NHL) transplantiert. Autolog werden 40 % der Patienten mit multiplem Myelom bzw. 40 % der Patienten mit Non-Hodgkin-Lymphom/Morbus Hodgkin transplantiert. Als Stammzellquelle dient in Europa zu 71 % das periphere Blut. Dies führt zum nächsten Thema:
Welche Stammzellquellen sollen für allogene Stammzelltransplantationen verwendet werden? Zu diesem Thema fand der Vortrag von Claudio Anasetti in der Plenarsitzung große Beachtung (Claudio Anasetti, Abstr. #1). Es wurden in einer randomisierten Phase-III-Studie Patienten mit akuten Leukämien, chronisch myeloischen Leukämien (CML), MDS und Myelofibrosen entweder mit peripheren Blutstammzellen oder mit Knochenmark von unverwandten Spendern transplantiert. Beide Gruppen waren bezüglich Risikofaktoren vergleichbar. 53 % der Patienten, die periphere Stammzellen erhielten, erkrankten an einer chronischen GVHD, gegenüber nur 40 % der Patienten, die Knochenmark erhielten. Somit ist es eine valide Option, bei Patienten mit Niedrigrisiko-Erkrankungen bzw. bei denen mit einem schnellen Engraftment zu rechnen ist, auch Knochenmark zu verwenden, sofern der unverwandte Spender einer Entnahme des Knochenmarkes zustimmt.
Allogene Stammzelltransplantation und Myelodysplasie: Cutler et al. publizierten bereits 2004 in der Zeitschrift Blood, dass Patienten unter 60 Jahren mit einem Niedrigrisiko-MDS (low und intermediate I nach dem International Prognostic Scoring System, IPSS) ein besseres Gesamtüberleben nach einer myeloablativen SCT hatten. Es profitierten jedoch Patienten in der „Low und intermediate I“-Risikogruppe von einer Verzögerung der Stammzelltransplantation, während „High und intermediate II“-IPSS-Patienten von einer frühzeitigen Stammzelltransplantation profitierten. Koreth et al. zeigten in einem Abstract, dass Patienten über 60 Jahre von einer dosisreduzierten allogenen Stammzelltransplantation dann profitieren, wenn sie im Stadium „Intermediate II bzw. high“-IPPS ohne Verzögerung durchgeführt werden. Im Gegensatz dazu hatten Patienten mit einem „Low bis intermediate I“-IPSS von einer frühen dosisreduzierten allogenen Stammzelltransplantation nicht profitiert (Tab.) (John Koreth, Abstr. #115). Diese Daten wurden allerdings nicht in einer prospektiv randomisierten Phase-III-Studie erhoben. Der Einsatz von hypomethylierenden Substanzen scheint keinen Einfluss auf die Toxizität einer nachfolgenden allogenen Stammzelltransplantation zu haben. Damaj et al. zeigten in einer retrospektiven Studie von 470 Patienten mit MDS, die einer Stammzelltransplantation zugeführt wurden, dass Patienten mit einer Azacitidin-Monotherapie keine erhöhte transplantassoziierte Mortalität hatten, dass aber Patienten mit einer Kombination von Azacitidin und Chemotherapie ein signifikant schlechteres Outcome hatten (Gandhi Damaj, Abstr. #160). Die Risikostratifizierung der myelodysplastischen Syndrome mittels IPSS und die Indikation zur Stammzelltransplantation nicht zuletzt unter Berücksichtigung des HCT-Komorbiditäts-Scores bleiben auch nach der Präsentation dieser Daten eine klinische Herausforderung. Entscheidend ist sicherlich, bei einem MDS-Patienten mit einem „Low Risk“-IPSS bei beginnender Progression den richtigen Zeitpunkt für die Durchführung einer Stammzelltransplantation zu wählen.
Autologe Stammzelltransplantation: To PET or not to PET: Die Rolle des PET-CT wurde in mehreren Abstracts bewertet. Die frühe PET-guided Induktionstherapie zeigte unklare Ergebnisse. So wurden in einer randomisierten Phase-II-Studie jeweils 35 Patienten mit hochmalignem Lymphom behandelt (Douglas A. Stewart, Abstr. #500). Die Patienten, die nach R-CHOP-Induktionstherapie PET-negativ wurden, erhielten weitere 4 konsolidierende R-CHOP-Zyklen, während Patienten mit PET-Positivität einem intensiveren Protokoll (mit einem Zyklus intensivierter Chemotherapie gefolgt von autologer Stammzelltransplantation) zugeführt wurden. Im Ergebnis zeigten beide Gruppen ein gleiches progressionsfreies Überleben. Hier wäre eine Studie wünschenswert, bei der die Stammzelltransplantation wirklich konsolidierend eingesetzt wird; das würde heißen, dass beide Patienten das volle R-CHOP-Programm bekommen sollten, da ja auch die gesamte Anthrazyklin-Dosis, was das Überleben der Patienten betrifft, entscheidend ist. Die Frage des Interims- PET und der therapeutischen Konsequenzen bleibt weiterhin offen. Klarer waren die Ergebnisse beim Hodgkin-Lymphom. In der Marseiller Gruppe um Devillier et al. wurden Patienten mit Hodgkin-Lymphom bei Rezidiv nach einer Induktionschemotherapie mit einem PET-CT untersucht. 77 % der Patienten wurden durch die konventionelle Rezidivtherapie vor autologer Stammzelltransplantation PET-negativ und erreichten leicht ein Gesamtüberleben von 99 % nach 5 Jahren, während bei der PET-positiven Gruppe ein 5-Jahres-Überleben von 55 % beobachtet wurde. Patienten, die PET-positiv waren, profitierten ausschließlich von einer Tandem-ASCT (Raynier Devillier, Abstr. #335).
Auch beim rezidivierten follikulären Lymphom bei Patienten, deren PET-Status nach der Rezidivtherapie und vor autologer Stammzelltransplantation evaluiert wurde, hatten die Patienten mit einem negativen PET-CT ein signifikant besseres PFS (Loic Ysebaert, Abstr. #1612). Beim Mantelzell-Lymphom war der PETStatus vor autologer Stammzelltransplantation ebenfalls ein prognostischer Marker (Jonathan B. Cohen, Abstr. #3113).
Autologe Stammzelltransplantation beim multiplen Myelom: Besonders im Lichte der steigenden Überlebenszeiten bei multiplen Myelom durch den Einsatz von Bortezomib und der Imide war die Präsentation von Saad interessant (Ayman A. Saad, Abstr. #504): Patienten, die nach einer autologen Stammzelltransplantation rezidivierten, können von einer 2. Stammzelltransplantation durchaus profitieren. Die transplantassoziierte Mortalität lag bei 2 %, und wie bei der Ersttransplantation wurde ein problemloses trilineares Engraftment innerhalb von 28 Tagen beobachtet. Patienten mit einer längeren Remissionsdauer als 36 Monate nach der ersten ASCT hatten ein medianes Gesamtüberleben nach Zweittransplantation von 49 Monaten vs. 27 Monaten bei Patienten mit früheren Rezidiven.
KEY MESSAGES
Komorbidität und allogene Stammzelltransplantation
- Hohe Aussagekraft des Stammzelltransplantation-Komorbiditätsindex für die transplantassoziierte Mortalität in allen Altersgruppen und für die GVDH- assoziierte Mortalität (Graft-versus-Host-Erkrankung)
Indikationen und Art der Stammzelltransplantationen weltweit
- In Europa werden 60 % autologe und 40% allogene Stammzelltrans – plan tationen durchgeführt, die führende Indikation zur allogenen Stammzelltransplan tationen sind akute Leukämien. Als Stammzellquelle wird in zwei Drittel der Fälle das periphere Blut verwendet.
- Bei Patienten mit AML, CML, MDS und Myelofibrosen, die entweder mit Stammzellen aus dem Blut oder dem Knochenmark von unverwandten Spendern transplantiert wurden, hat sich herausgestellt, dass mehr Patienten, deren Stammzellquelle das periphere Blut war, an einer chronischen GVHD erkrankten. Damit wird das Knochenmark als Quelle der allogenen Stammzelltransplantation unter bestimmten Voraussetzungen zu einer validen Option.
Stammzelltransplantation bei myelodysplastischen Syndromen (MDS)
- MDS-Patienten über 60 Jahre mit schlechter Prognose können u. U. von einer dosisreduzierten allogenen Stammzelltransplantation profitieren, wenn diese ohne Verzögerung durchgeführt wird.
- Eine Azacitidin-Monotherapie hat keinen negativen Einfluss auf den Verlauf nach Stammzelltransplantation.
To PET or not to PET?
- Der Stellenwert der PET-CT-gesteuerten Therapie bei aggressiven Lymphomen (DLBCL) bleibt offen, während der prognostische (therapiesteuernde) Stellenwert in Studien bei Morbus Hodgkin, bei rezidivierten follikulären Lymphomen und beim Mantelzell-Lymphom eindeutiger war.
Stammzelltransplantation beim multiplen Myelom
- In ausgewählten Fällen können Patienten mit multiplem Myelom von einer 2. Transplantation profitieren