Best of Oncology & Best of Hematology 2011
Vom Histo-Befund zur Driver-Mutation: Onkologische Innovationen haben jene in der Kardiologie mittlerweile überholt: Während in den 1980er Jahren die Zahl der in kardiologischen Indikationen entwickelten Substanzen jene auf onkologischem Gebiet deutlich überstieg, ist es heute genau umgekehrt. Ermöglicht hat diese Entwicklung die molekulare Charakterisierung von Tumorerkrankungen, mit deren Hilfe histopathologisch definierte Krankheitsbilder in einzelne Entitäten aufgeteilt werden können. Prof. Dr. Martin Fey, Klinik und Poliklinik für Medizinische Onkologie, Bern, wies auf die Notwendigkeit hin, zielgerichtete Therapien nicht mehr nur bei einem histologisch definierten Patientengut zu untersuchen, da sonst negative Studienergebnisse die Folge sein können. „Die Auswahlkriterien müssen mit der molekularen Diagnostik mithalten.“ Allerdings sind die gefundenen Merkmale oft schwer zu überblicken. Fey brachte das Beispiel einer umfassenden Sequenzierung des gesamten Genoms eines Lungenkarzinoms bei einem schweren Raucher1. Im Vergleich zur normalen DNA des Patienten fanden sich neben einer Liste an ,losses‘ und ,gains‘, Einzelnukleotid- Polymorphismen und strukturelle Anomalien zwischen den Chromosomen. Eine Analyse der Anzahl der Mutationen im Karzinom in Korrelation zur Zahl der Pack Years erbrachte die Akkumulation einer Mutation pro drei gerauchten Zigaretten.
Driver-Mutationen, die eine neue zielgerichtete Therapie ermöglichen, bestimmen zunehmend das Feld solider Tumoren, wie zuletzt beim Adenokarzinom der Lunge (EML4-ALK; Therapie Crizotinib) oder beim Melanom (BRAF; Therapie Vemurafenib) gezeigt werden konnte. Als Gegenbeispiel, den Versuch einer En – titätsbestimmung mittels Ausschlus s – kriterien, wurden „triple-negative“ Mammakarzinome besprochen: Sie sind immunhistochemisch als ER-, PR- und HER2-negativ charakterisiert und haben biologische Gemeinsamkeiten mit BRCA1-mutierten Mammakarzinomen. „Allerdings bedeutet dieses Profil nicht, dass sie eo ipso BRCA1-mutiert sein müssen, und auch nicht, dass sie eo ipso ,basal-like‘ sind“, warnte Fey vor dem Abhaken triple-negativer Mammakarzinome als einer bereits definierten molekularen Entität.2
Eine Frage der Endpunkte: Ocaña et al. heben in ihrem Review zur Literatur über Bevacizumab hervor, dass eine positive Studie auf klinisch relevanten Unterschieden in wichtigen Endpunkten beruhen sollte, idealerweise dem Gesamtüberleben, während ein Gewinn an progressionsfreier Lebenszeit leicht überschätzt wird3. So wäre es nicht unbedingt überraschend, wenn – wie beim Ovarialkarzinom – eine wirksame Erhaltungstherapie gegenüber keiner Therapie das progressionsfreie Überleben verlängert. Sollte der Unterschied zwischen zwei Patientengruppen darin bestehen, dass eine Gruppe nach abgeschlossener First-Line-Therapie remissionserhaltend therapiert wird, während die andere Gruppe bis zum Beginn der Second-Line-Therapie eine Therapiepause hat, beide Gruppen aber gleich lange überleben, dann ließe sich die Erhaltungstherapie durch klinische Vorteile wie die Verbesserung der Lebensqualität überzeugend argumentieren oder durch die Definition von Risikogruppen, bei denen ein Überlebensvorteil zu erwarten ist.
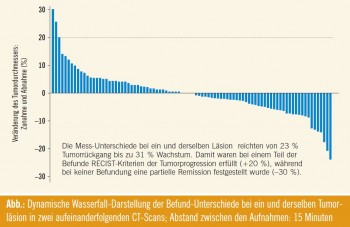
Kritische Bewertung des Ansprechens: Ein radiologischer Response entspricht nicht automatisch einem klinischen Benefit und kann – wie in einer Studie von Oxnard gezeigt wurde – sogar das tatsächliche Ansprechen variabel zum Ausdruck bringen.4 In der Studie wurden bei NSCLC-Patienten zwei konsekutive CTScans derselben pulmonalen Läsionen innerhalb von 15 Minuten angefertigt und Radiologen, die über das kurze Zeitintervall zwischen der Bildgebung nicht informiert waren, zur Begutachtung vorgelegt. In einem Gutteil der Fälle stellten die Befunder substanzielle Größenzunahmen oder -abnahmen fest (Abb.), wobei die Unterschiede vor allem bei kleineren Tumoren signifikant waren und hier dann auch häufig die Kriterien der Tumorprogression erfüllten. Umgelegt in die Praxis ergab sich bei Läsionen in der Größenordnung von 4 cm eine Messvariabilität im Bereich von 3,5–4,5 cm. Einen Tumorrückgang um weniger als 10 % sehen die Autoren deshalb kritisch, während ein Rückgang um 10–30 % als potenzieller therapeutischer Effekt gewertet wurde, auch wenn damit nach RECIST nur ein „minor response“ erfüllt ist.
Es wurde festgehalten, dass die Respons- Grenzen der (mittlerweile überarbeiteten) RECIST-Kriterien aus den 1970er Jahren resultieren, wo nur wenige Substanzen verfügbar waren und ein Tumorrückgang vorzugsweise durch einen raschen Zelluntergang erreicht wurde, während man bei neueren Substanzen auch klinische Prädiktoren miteinbeziehen sollte. Heute wird die Wirksamkeit neuer Medikamente oft in Wasserfall-Diagrammen dargestellt. Die ursprüngliche Intention dieser Methode bestand darin, den zusätzlichen Nutzen einer Therapie, die bereits Ansprechkriterien nach RECIST erreichen konnte, auch bei jenen Patienten darzustellen, die man sonst als Nonresponder klassifiziert hätte. Würde man Läsionsunterschiede im Bereich von 10 % als „Impräzisionsfaktor“ ausklammern, wären vielleicht einige der aktuellen Darstellungen nicht mehr ganz so eindrucksvoll. „Wir sollten kritischer mit den Responskriterien umgehen“, meinte Fey zu diesem Thema abschließend.
Neue Pathways in der Hämatoonkologie: Für Professor Andreas Neubauer, Klinik für Hämatologie, Onkologie und Immunologie, Phillips-Universität Marburg, Deutschland, ergaben sich entscheidende Fortschritte durch die Erforschung des Genoms und die Identifikation wesentlicher Signalwege. Als Beispiel wurden Haarzellleukämien genannt, die selten sind und genetisch ein bisher unbekanntes Land darstellten. Tiacci et al. entschlüsselten das Genom von Haarzellen mittels Exon-Sequenzierung, wobei Mutationen in fünf Genen (BRAF, CSMD3, SLC5A1, CNTN6, OR8J1) gefunden wurden5. Die Besonderheit der Untersuchung bestand darin, dass in einer Reihe von vergleichend untersuchten Lymphomen und Leukämien nur Haarzell- Leukämien onkogene BRAF-Mutationen als genetische Driver aufwiesen (BRAF-V600E), und zwar in 100 % der Fälle, womit sich neben dem proof of principle beim Melanom eine weitere Indikation für BRAF-Inhibitoren eröffnen könnte.
Interferon als stammzellaktive Therapie bei CML? Im Zeitalter von targeted therapies und der Stammzellforschung wurde die CML-Studie V als interessantes immun- und stammzellaktives Konzept hervorgehoben. Die Studie untersucht die Gabe von pegyliertem Interferon (IFN) bei Patienten mit chronisch myeloischer Leukämie in der Hoffnung, die lebenslange Imatinib-Therapie einmal absetzen zu können, weil Patienten nicht mehr „nur“ chronisch krank, sondern tatsächlich geheilt sind. Das Problem besteht darin, das CML-Patienten selbst nach Erreichen einer kompletten molekularen Remission nach Absetzen von Imatinib ein Rezidiv erleiden können, was damit erklärt wird, dass CMLStammzellen gegenüber Imatinib unempfindlich sind. Bei IFN besteht die Hoffnung, dass dieses Zytokin auch Stammzellen angreifen kann. In einer ers ten Pilotstudie wurden Patienten über 2 Jahre mit einer Kombination aus Imatinib+ IFN behandelt, danach wurde Imatinib abgesetzt und IFN als Erhaltungstherapie weitergeführt.6 Entgegen dem Paradigma, dass das Absetzen von Imatinib mit größter Wahrscheinlichkeit zum Rückfall führt, konnte die IFN-Erhaltungstherapie bei den meisten Patienten die Ansprechqualität bewahren oder die Tiefe der Remission sogar weiter verbessern (medianes Follow-up: 2,4 Jahre nach Imatinib-Stopp). Eine Erklärung dafür liefert die These, dass IFN ruhende Stammzellen stimuliert, die dann gegenüber konventionellen Therapien empfindlich werden. Es wurde auch postuliert, dass Imatinib die T-Zell-Aktivierung unterdrückt und die Immunogenität von CML-Zellen durch Downregulation von BCR-ABL-assoziierten Selbst-Antigenen abschwächt, weshalb IFN erst nach Absetzen von Imatinib seine volle Immunstimulation entfalten soll (z. B. durch Aktivierung zytotoxischer T-Zellen). Weiter bemerkenswert ist die Beobachtung anhaltender Remissionen selbst nach Absetzen von Interferon, was mit der Persis – tenz zytotoxischer T-Zellen erklärt wurde. Man kann dazu sagen, dass diese explorativen ersten Ergebnisse umso interessanter sind, als die historische IFN-Monotherapie nur bei einem Drittel der CML-Patienten (und hier vorzugsweise bei jenen mit guter Prognose) eine zytogenetische Remission erzielen konnte.
Zum Besten des Jahres zählte die Entwicklung von JAK2-Hemmern bei myeloproliferativen Erkrankungen, die voranschreitende Charakterisierung von TET2 bei hämatoonkologischen Erkrankungen oder der Einzug der Epigenetik als neuer Hoffnungsträger nicht zuletzt bei AML und vieles andere mehr. Bei so viel Bestem wurde abschließend noch darauf hingewiesen, dass selbst Altes besser wird, die allogene Stammzelltransplantation7, die mit dosisreduzierten Konditionierungsregimen, einer besseren GvDHProphylaxe und anderen supportiven Maßnahmen heute erfolgreicher eingesetzt werden kann als noch vor 15 Jahren.
Quelle: Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Onkologie, Plenarsitzung „Best of the Year“, 30. 9. 2011, Basel
1 Lee W et al., Nature 2010; 465:473–477
2 Foulkes WD et al., N Engl J Med 2010; 363:1938–48
3 Ocaña A et al., J Clin Oncol 2011; 29:254–256
4 Oxnard GR et al., J Clin Oncol 2011; 29:3114–3119
5 Tiacci E et al., New Engl J Med 2011; 364:2305–2315
6 Burchert A et al., J Clin Oncol 2010; 28:1429–1435
7 Gooley TA et al., New Engl J Med 2010; 363:2091–2101