CML: „Therapiefreie Remission“ als neues Behandlungsziel
Der Beitrag erörtert die Fragen, wie man bei der Zielsetzung „therapiefreie Remission“ vorgeht, wer sich dafür am besten eignet und was zu erwarten ist.
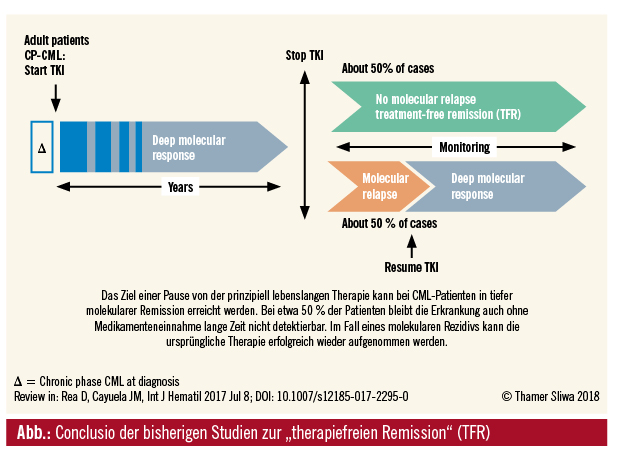
Die ersten Studien zur therapiefreien Remission kommen aus Frankreich, am bekanntesten ist die STIM-Studie, „Stop Imatinib“. Bei diesen Patienten, die nach damaligen Kriterien in kompletter molekularer Remission waren, bei denen die Erkrankung über einen Zeitraum von mindestens 2 Jahren hindurch nichtdetektierbar war, wurde Imatinib abgesetzt. Man hat in diesen Studien beobachtet, dass ein Therapiestopp bei etwa der Hälfte der Patienten (40–60 %) möglich ist, ohne dass die Remission verloren geht. Gleichzeitig hat man gelernt, dass die meisten Rezidive, wenn sie auftreten, früh, innerhalb der ersten 6 Monate auftreten und bei einer Reinitialisierung der Therapie die meisten Patient wieder die tiefe Remission wiedererlangen.
Es wurden daraufhin verschiedene Studien zur therapiefreien Remission mit Imatinib und neueren Substanzen initiiert (z. B. A-STIM, EUROSKI, HOVON, STIM2, ENESTop, ENESTfreedom, DASFREE u. v. m), vor allem um folgende Fragen zu klären: Wie lange ist die optimale Therapiedauer vor einem Absetzversuch, wie tief sollte die Remission vor dem Absetzen sein, und wie lange muss diese Remission stabil geblieben sein; beeinflusst die Art der Vortherapie den Erfolg der therapiefreien Remission, oder spielen bestimmte Risikofaktoren der Erkrankung selbst eine Rolle, vor allem aber: Gefährdet ein Rezidiv den Langzeitheilungserfolg, oder kann die Therapie im Falle eines Rezidivs für den Patienten unbeschadet wieder aufgenommen werden?
Über all diese Fragen weiß man heute so gut Bescheid, dass Absetzversuche auch außerhalb von klinischen Studien in der Praxis sicher sind, sofern bestimmte Kriterien eingehalten werden.
Therapiefreie Remission mit Nilotinib
2017 wurde Nilotinib als bislang einzige Substanz für das Therapieziel „therapiefreie Remission“ von der EMA zugelassen. Grundlage hierfür sind die beiden Studien ENESTop (TFR nach Switch von Imatinib auf Nilotinib) und ENESTfreedom (TFR nach First-Line-Therapie mit Nilotinib).
ENESTop: Die Studie inkludiert 163 Philadelphia-Chromosom-positive CML-Patienten in chronischer Phase (CML-CP), die initial mit Imatinib (> 4 Wochen) und danach mit Nilotinib (≥ 2 Jahre) behandelt wurden. Patienten in tiefer molekularer Remission (MR4,5) erhielten noch eine Konsolidierungstherapie mit Nilotinib über 52 Wochen, danach wurde die Therapie abgesetzt. Das letzte Update erfolgte am EHA 2018 mit dem Ergebnis, dass etwa die Hälfte (52 %) der Patienten nach 144 behandlungsfreien Wochen (knapp 3 Jahre) immer noch in therapiefreier Remission war. Von jenen Patienten, die ihre molekulare Remission verloren haben, haben nach Wiederaufnahme der Therapie 97 % eine MMR* und über 90 % eine MR4,5** wiedererlangt.
ENESTfreedom: Die Studie inkludiert 215 Philadelphia-Chromosom-positive CML-Patienten in chronischer Phase. Ein Therapiestopp wurde vorgenommen, wenn eine tiefe molekulare Remission (MR4,5) unter Nilotinib als Erstlinientherapie insgesamt etwa 3 Jahre lang (2 Jahre und 1 Jahr Konsolidierung) angehalten hat. Das letzte Update wurde am EHA präsentiert mit einem ähnlichen Ergebnis wie in der ENESTop-Studie: Nach 144 behandlungsfreien Wochen (knapp 3 Jahre) war etwa die Hälfte der Patienten (48,7 %) immer noch in therapiefreier Remission. Von jenen Patienten, die ihre molekulare Remission verloren haben, haben nach Wiederaufnahme der Therapie nahezu alle Patienten (99 %) eine MMR* und 92 % eine MR4,5* wiedererlangt.
Fazit: Die wesentliche Schlussfolgerung aus diesen Studien ist, dass das Absetzen sicher ist und dass bei keinem Patienten eine Progression in die akzelerierte Phase oder Blastenkrise stattgefunden hat.
Wichtige Kriterien für die therapiefreie Remission
Somit sind wir bei der CML heute in der Lage, bei Patienten mit lang andauernder tiefer molekularer Remission (MR4,5 und tiefer) einen Absetzversuch vorzunehmen (Abb.). Wichtige Aspekte, die man bei Absetzen der Therapie berücksichtigen muss, sind zusammengefasst folgende:
Bei Patienten in tiefer molekularer Remission (MR4,5 und tiefer) kann ein Absetzversuch unternommen werden.
- Die Substanz, mit der eine MR4,5 erreicht wird, spielt per se keine Rolle. Jedoch ist mit Imatinib als Erstlinientherapie vor dem Absetzversuch eine stabile Remission über einen längeren Zeitraum gefordert (z. B. über 5–6 Jahre) als mit Zweitgenerations-TKI wie Nilotinib oder Dasatinib (z. B. über 3 Jahre).
- Patienten müssen engmaschig monitiert werden, vor allem zu Beginn des Absetzversuchs (monatliche Kontrollen in den ersten 6 Monaten, danach abgestuft immer längere Intervalle).
- Nach dem Absetzen der Therapie können vorübergehend muskuloskelettale Schmerzen auftreten.
- Bei Auftreten eines Rezidivs sollte die gleiche Therapie wieder aufgenommen werden, die zuvor abgesetzt wurde.
Generell gilt, wenn eine tiefe molekulare Remission (MR4,5) schnell erreicht werden soll, dann empfiehlt sich eine Erstlinientherapie mit einem Zweitgenerations-TKI (derzeit ist nur Nilotinib zugelassen). Eine tiefe molekulare Remission wird damit nicht nur schneller, sondern auch bei mehr Patienten erreicht – und es bleiben auch mehr Patienten in therapiefreier Remission (Deininger et al., Curr Hematol Malig Rep 2017; 12:495–505).
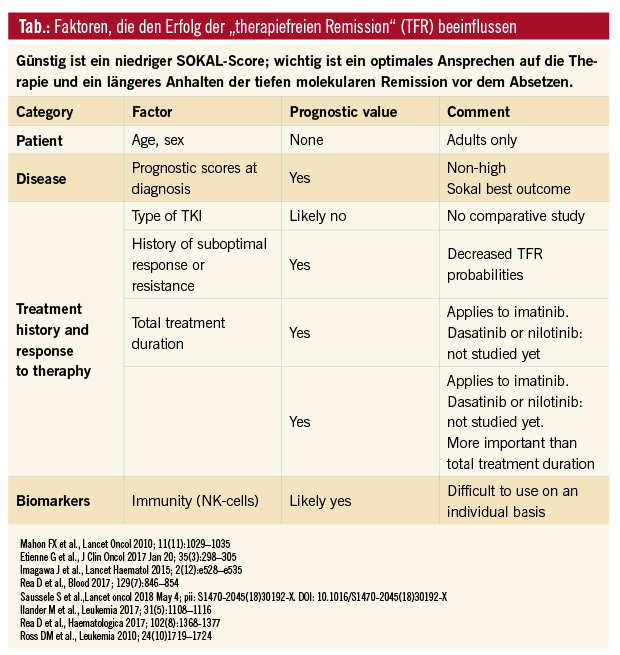
Zu den prognostischen Faktoren, lange in der therapiefreien Remission zu bleiben, zählt der Prognosescore bei Diagnose (gute Voraussetzungen haben Patienten mit einem niedrigen Risikoscore, Sokal low und intermediär), die Gesamttherapiedauer (gilt vor allem für Imatinib) sowie die Dauer der tiefen molekularen Remission vor dem Absetzen. Bei Patienten, die im Therapieverlauf einmal ein suboptimales Ansprechen hatten oder die auf eine Therapie resistent waren, sollte derzeit kein Absetzversuch durchgeführt werden (Tab.).
Resümee
Das Absetzen der prinzipiell lebenslangen Therapie ist bei Patienten mit chronischer myeloischer Leukämie möglich und gewährt Patienten eine Therapiefreiheit, in der sie frei von möglichen Nebenwirkungen sind und weniger an ihre Erkrankung erinnert werden. Sollte ein Rezidiv auftreten, kann die Therapie erfolgreich wieder aufgenommen werden.