DGHO 2012: Moderne Reproduktionsmedizin ermöglicht Kinderwunsch
Gonadenschutz unter Chemotherapie: Moderne Therapien haben in den letzten Jahren die Überlebensraten von Tumorpatienten deutlich erhöht; bei den Leukämien liegen die Heilungsschancen bei jüngeren Patienten bei 70 %, berichtet Dr. Nicola Gökbuget, Frankfurt, Leiterin der Studienzentrale der Medizinischen Klinik des Universitätszentrums für Tumorerkrankungen. Bedingt durch immer spätere Schwangerschaften (momentaner Altersdurchschnitt: 30 Jahre) werden Onkologen vermehrt mit der Fragestellung des noch unerfüllten Kinderwunsches der Patientinnen konfrontiert. Bei Patientinnen, die sich im noch reproduktionsfähigen Alter befinden beziehungsweise sich in der Kindheit Therapien zur Behandlung maligner Erkrankungen unterziehen mussten, ist die Infertilität als Spätfolge der Therapie eine zunehmende Fragstellung, betont Gökbuget. Bei ALL-/AML-Patientinnen wird von einem niedrigen Gesamtrisiko für Infertilität von < 20 % nach Polychemotherapie berichtet (Lee SJ et al., JCO 2006). Bei Patientinnen, die sich einer Stammzelltransplantation unterzogen haben, liegen die Schwangerschaftsraten allerdings bei unter 4,5 % (Leader et al., BJH 2011). Das Risiko einer Gonadentoxizität ist stark abhängig vom Alter der Patientinnen. Neue Regime sind möglicherweise weniger gonadotoxisch, führt Gökbuget weiter aus. Es besteht insgesamt eine starke Variabilität der Infertilität nach verschiedenen Chemotherapieregimen, bei einigen Substanzen sind bis dato Langzeitergebnisse laut Gökbuget noch nicht bekannt. Tabelle 1 gibt eine Übersicht über das Risiko einer Gonadentoxizität nach verschiedenen Chemotherapieregimen. Bei Frauen stellen Amenorrhöen sowie eine verfrühte Menopause, bei Männern ein Hormonmangel weitere Risiken für eine Infertilität dar.
Infertilitätsrisiko durch Bestrahlung: Eine Ganzkörperbestrahlung, die vor allem vor Stammzelltransplantationen durchgeführt wird, kann einen negativen Effekt sowohl auf die endokrinen als auch auf die gonadalen Funktionen ausüben und diese zum Teil irreversibel schädigen. Hierbei sind sowohl die Produktion von Sexualhormonen als auch die Keimzellen betroffen. Der toxische Effekt der Bestrahlung ist bei Frauen sowohl alters- als auch dosisabhängig; zum Teil kommt es zusätzlich zu einer Schädigung des Uterus. Beim Mann kommt es bei > 4 Gray zu einer Schädigung der Keimzellen, ab 20 Gy zu einer Schädigung der Leydig-Zellen, die weniger chemosensitiv sind.
Bei Männern ist die Spermienfunktion allerdings häufig schon im Vorfeld krankheitsbedingt eingeschränkt, unter Chemotherapie kommt es dann durch eine Schädigung der Spermatogonien Typ B zur Azoospermie. Die Erholung hängt dann von der Zahl der Spermatogonien Typ A ab, führt Gökbuget weiter aus.
Für Frauen besteht die Möglichkeit der ovariellen Transportation (Zeitbedarf mindestens 3 Tage) zur Fertilitätserhaltung; hierbei kommt es zu einer laparoskopischen Verlagerung der Ovarien außerhalb des Strahlenfeldes. Zu einem späteren Zeitpunkt erfolgt die Rückverlagerung der Ovarien, welche allerdings anatomisch meist nicht mehr funktionell sind, sodass danach eine In-vitro-Fertilisation notwendig ist. Die Erfolgsraten liegen zwischen 50- 80 % im Hinblick auf Fertilitätserhaltung und Ovarialfunktion. Eine Reimplantation von Ovargewebe bleibt, so die Expertin, noch immer ein experimenteller Ansatz, da hier das Risiko einer Reimplantation von Tumorzellen gegeben ist. Hier müsste bei Leukämien, so die Expertin, die minimale Resterkrankung im Ovarialgewebe bestimmt werden.
Problematik der Fertilitätserhaltung bei Leukämiepatienten: Vor allem bei Leukämiepatienten stehen die behandelnden Ärzte bei fertilitätserhaltenden Maßnahmen vor großen Problemen, bemerkt Gökbuget weiter. Hier sei zumeist ein rascher Therapiebeginn erforderlich: Die Patienten haben häufig einen eingeschränkten Allgemeinzustand, Neutro- und Thrombopenien sowie das Risiko von Organinfiltrationen. Ein verzögerter Beginn der Chemotherapie stellt daher keine Option bei Erwachsenen dar.
Fertilitätseinschränkungen bei Lymphompatienten: Ca. 0,9–1,2 % der Frauen sind von einer vorzeitigen Ovarialinsuffizienz („premature ovarian failure“, POF-Syndrom) betroffen. Die Menopause setzt bei diesen Patientinnen bereits vor dem 40. Lebensjahr ein. Vor allem Frauen, die sich einer Therapie in Folge einer malignen Erkrankung (Chemo- bzw. Strahlentherapie) unterzogen haben, sind von diesem Syndrom betroffen. Nichtalkylierende Substanzen haben ein geringeres Risiko für die Entwicklung einer ovariellen Insuffizienz, führt Dr. Barbara Lawrenz, Reproduktionsmedizinerin der Universitätsfrauenklinik Tübingen, aus.
Vor allem Ganzkörperbestrahlungen führen – verglichen mit alleiniger Chemotherapie – häufiger zur Ovarialinsuffizienz bzw. vorzeitigen Menopause. Ein entscheidender Risikofaktor stellt allerdings auch hier das Alter zum Therapiezeitpunkt dar: Frauen über 32 Jahren haben ein erhöhtes Risiko für ein POF (9 % vs. 0,9 % in der allgemeinen Bevölkerung), selbst dann, wenn sie ein Behandlungsregime ohne alkylierende Substanzen erhielten. Insgesamt ist die fertile Phase nach der Chemotherapie verkürzt, führt Lawrenz weiter aus. Das Wiedereinsetzen der Monatsblutung wird allerdings von vielen behandelnden Ärzten falsch gedeutet, denn dies weist nämlich noch nicht auf eine wiederbestehende ovarielle Funktion hin, betont Dr. Lawrenz.
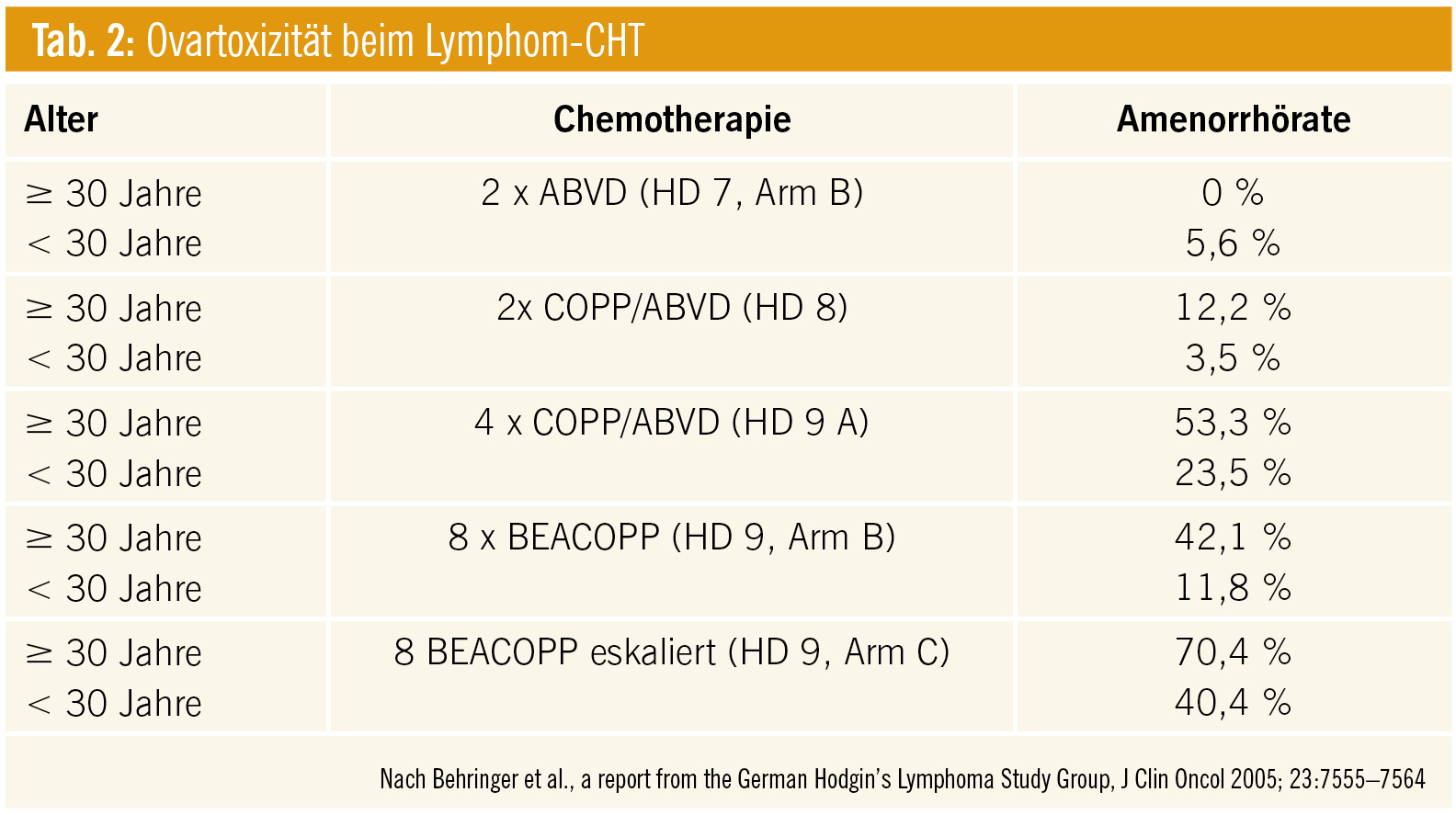
Ein wichtiger Marker zur Bestimmung der ovariellen Reserve ist das Anti-Müller-Hormon. Bei einer Studie mit Lymphompatientinnen konnte allerdings festgestellt werden, dass – verglichen mit einer altersgleichen gesunden Patientenkohorte – das Anti-Müller-Hormon bereits vor Beginn der Therapie durch die Krankheit selbst deutlich erniedrigte Werte aufwies. Die ovarielle Reserve wurde danach, bedingt durch die Chemotherapie, weiter eingeschränkt (Lawrenz B et al., Fertil Steril 2012). Die Ursachen der Fertilitätseinschränkung bei Frauen bleiben weiter unklar. Möglicherweise haben hier, ähnlich wie bei den Männern, zirkulierende Zytokine einen Einfluss. Eventuell könnte aber auch der konsumierende Charakter der Erkrankung dafür verantwortlich sein, meint die Reproduktionsmedizinerin. Tabelle 2 gibt einen Überblick über die Ovartoxizität bei Lymphomchemotherapien.
Erfolgsaussichten fertilitätserhaltender Maßnahmen bei der Frau: Bei Durchführung einer hormonellen Stimulation ist ein Zeitraum von ca. 14 Tagen einzuplanen. Ein Beginn in der zweiten Zyklushälfte ist bei Patientinnen mit geplanter Chemotherapie ebenfalls möglich. Die Entnahme der Oozyten erfolgt mittels vaginaler Follikelpunktion. Bei bestehender Partnerschaft werden diese fertilisiert und kryokonserviert, bei Patientinnen ohne Partner unbefruchtet kryokonserviert. Das Risiko einer Überstimulation (besonders starkes Ansprechen auf die Stimulation) ist vorhanden und kann unter Umständen zu einer Verschiebung des Beginns der Chemotherapie führen. Aktuelle Daten des deutschen Netzwerks FertiProjekt zeigen allerdings, so Lawrenz, dass das Risiko für „relative Komplikationen“ hier nur bei 2,9 % pro hormonell stimulierter Patientin liegt. Es kommt im Normalfall daher zu keiner Verschiebung der geplanten Chemotherapie (Lawrenz B et al., Fertil Steril 2010). Die Zeitdauer der hormonellen Stimulation zur Oozytengewinnung beträgt median 17,5 Tage. Von der Entnahme der Eizelle bis zum Start der geplanten Chemotherapie dauert es gemäß einer aktuellen Untersuchung im median 4,5 Tage (Lawrenz et al., Onkologie 2011). Bezogen auf die Effektivität kann man festhalten, dass die Anzahl der gewonnenen Oozyten durch Stimulation vor Chemotherapie bei 11 liegt (verglichen mit 9,5 bei gesunden Patientinnen aus dem deutschen IVF-Register). Die Fertilisationsraten (IVF; ICSI) liegen mit 61,3 % bei Stimulation vor Chemotherapie nur knapp unter jenen im IVF-Register vermerkten (62,5 %). Grund hierfür ist, dass Patientinnen vor Chemotherapie intensiver stimuliert werden, um die Erfolgschancen zu erhöhen, so Lawrenz.
Eine weitere Option zur Fertilitätserhaltung der weiblichen Patienten stellt die Kryokonservierung von Ovargewebe dar. Diese laparoskopische Entnahme von Ovargewebe benötigt nur 2 Tage, das „Angehen“ sowie die Lebensdauer des Retransplantates sind noch experimentell, so Lawrenz. Bisher wurden 18–20 Schwangerschaften nach der Retransplantation von Ovargewebe berichtet. Die Methode ist partnerunabhängig. In den nächsten Jahren ist weiterer Erfahrungsgewinn zu erwarten, resümiert die Reproduktionsmedizinerin.
Möglichkeiten der Fertilitätserhaltung beim Mann: Für Männer steht als Behandlungsoption die Spermien-Kryokonservierung zur Verfügung, die von 27–67 % der betroffenen Männer in Anspruch genommen wird. Nach Abschluss der Tumortherapie kommt es zu einer Insemination, IVF oder ICSI. Die Methoden der Spermien-Kryokonservierung kommen häufig bei erkrankungsbedingten Spermienschädigungen, wie z. B. eingeschränkter Motilität oder niedriger Spermienzahl zum Einsatz. Als weitere Möglichkeit stehen noch die Asservierung von Hodengewebe sowie die Extraktion von testikulären Spermien zur Verfügung (TESE).
Frühzeitige Beratung: Für Patientinnen, die bei Diagnosestellung in einem Alter sind, in dem die Familienplanung noch nicht abgeschlossen ist, eröffnen sich durch die moderne Reproduktionsmedizin dennoch einige Möglichkeiten, die Fertilität entweder prätherapeutisch zu erhalten oder aber Schwangerschaften nach Abschluss der Therapie zu ermöglichen. Besonders wichtig ist es in diesem Zusammenhang, die Patienten frühzeitig zu beraten; eine weitere Entscheidung sollte dann in Abhängigkeit von der onkologischen Therapie getroffen werden, postuliert Lawrenz.