Erstlinie Nierenzellkarzinom: Entscheiden molekulare Marker die Therapie?
Die Therapielandschaft des metastasierten Nierenzellkarzinoms hat sich in den letzten drei Jahren erheblich gewandelt. Zunächst wurde mit der Studie CheckMate-214, einer randomisierten Phase-III-Studie, die Überlegenheit des PD-1-Checkpoint-Inhibitors Nivolumab in Kombination mit dem CTLA-4-Inhibitor Ipilimumab gegenüber Sunitinib bei Patienten mit intermediärem oder ungünstigem IMDC-Risiko bewiesen. Patienten im Check-Point-Inhibitor-Arm erreichten ein signifikant längeres Überleben (OS) und signifikant höhere Response-Raten (ORR). Nach längerer Nachbeobachtungszeit zeigte sich schließlich auch ein deutlicher Benefit im progressionsfreien Überleben (PFS). Besonders die Rate an Komplettremissionen (CR) war in diesem Ausmaß beim Nierenzellkarzinom zuvor nicht beobachtet worden.
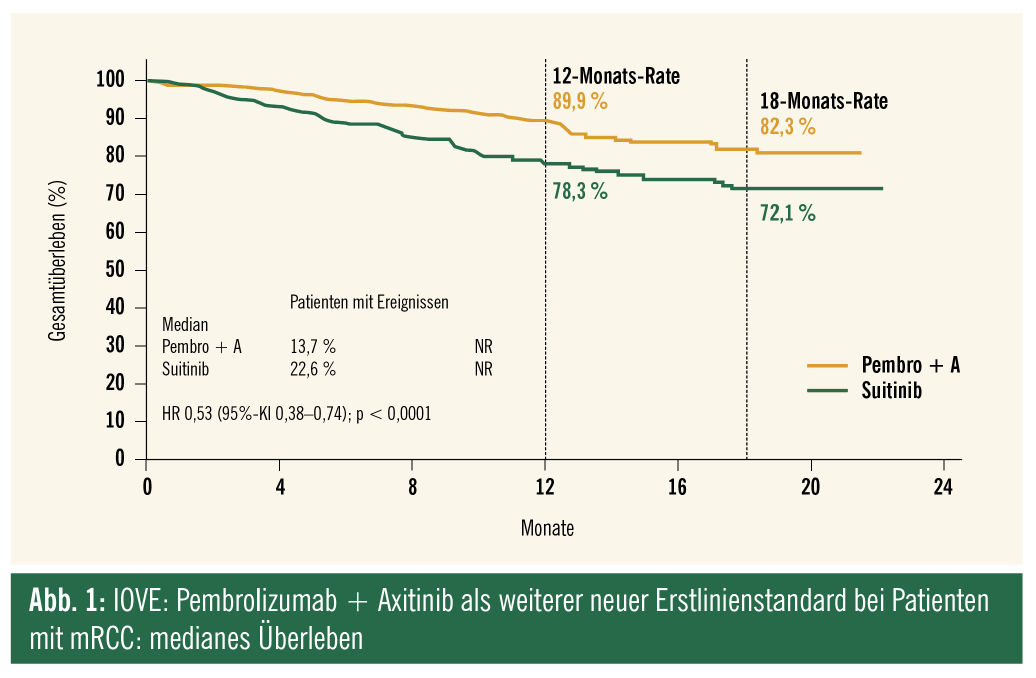
Eine weitere Kombinationsstudie erreichte zwei Jahre später ihre primären Endpunkte: Die Kombination des PD- 1-Checkpoint-Inhibitors Pembrolizumab mit dem VEGFR-Tyrosinkinase-Inhibitor Axitinib demonstrierte signifikante Überlegenheit in Bezug auf OS, progressionsfreies Überleben (PFS) und ORR gegenüber Sunitinib bei Patienten jedes IMDC-Risikoprofils (Abb. 1). Weitere Kombinationsstudien mit der Strategie VEGFR-TKI bzw. VEGF-Antikörper mit PD-L1-Checkpoint- Inhibitoren (JAVELIN Renal 101 und IMmotion 151) konnten bislang lediglich eine signifikante Verbesserung des PFS und der ORR, nicht aber des OS demonstrieren, weswegen sie derzeit eine untergeordnete Bedeutung haben.
Somit sind in den aktuellen EAU-Guidelines sowie in dem geplanten Update der ESMO-Guidelines folgende Behandlungs-Szenarien zu finden: Beide Kombinationen, Nivolumab + Ipilimumab oder Pembrolizumab + Axitinib sind Standard of Care bei Patienten mit intermediärem und ungünstigem IMDC-Profil; Pembrolizumab + Axitinib ist zusätzlich auch Standard of Care bei Patienten mit günstigem IMDC-Risiko. Die TKI-Monotherapie in der Erstlinie ist nach den Guidelines eine Option, wenn die neuen Standards nicht verfügbar/kontraindiziert sind.
IO-IO oder IO-VE?
Die Therapiewahl zwischen Nivolumab + Ipilimumab (IOIO) und Pembrolizumab + Axitinib (IOVE) stellt die Behandler vor allem bei Patienten mit intermediärem oder ungünstigem IMDC-Risiko vor die Qual der Wahl. Bislang gibt es keine Empfehlung, einen speziellen molekularen Marker als Entscheidungsgrundlage heranzuziehen, was aber nicht bedeutet, dass dies nicht im klinischen Alltag Sinn machen würde; zahlreiche Grundlagenergebnisse geben Hinweise, welche Faktoren wir bei der Therapiewahl beachten könnten.
PD-L1 als Marker
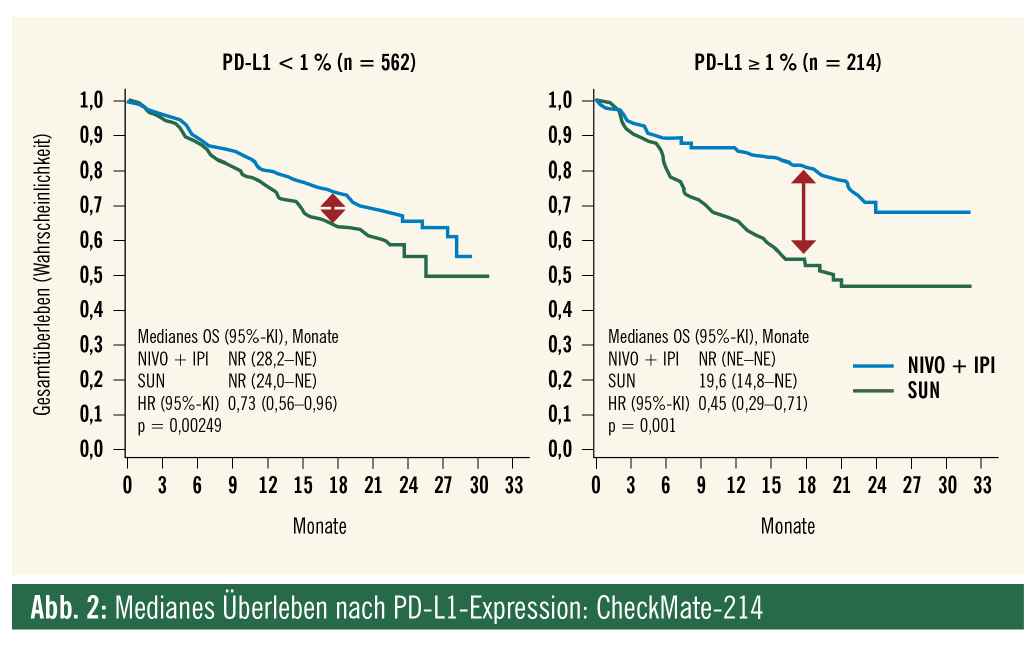
PD-L1-Expression ist ein prognostischer Marker, und Patienten mit PD-L1-Expression haben in der Regel einen aggressiveren Tumorverlauf (im Gegensatz zur PD-1-Expression auf T-Lymphozyten, die keinen ungünstigen prognostischen Marker darstellt). PD-L1-Expression scheint prädiktiv für einen besonderen Benefit durch IOIO-Therapie zu sein. In der Studie CheckMate-214 lag die CR-Rate bei 16 %, und das mediane OS war noch nicht erreicht (versus 19,6 Monate mit Sunitinib, p < 00001) (Abb. 2).
PD-L1-Expression als Entscheidungsgrundlage für die Therapie heranzuziehen wird sehr kontroversiell diskutiert. Verfügbare Tests und Definitionen von PD-L1-Positivität/Negativität waren in den Studien nicht einheitlich. Die größte Schwierigkeit liegt jedoch in der Tatsache, dass PD-L1 ein dynamischer Biomarker ist: Die Expression kann sich mit der Dauer des Krankheitsverlaufes ändern, sie kann im Primum und in der Metastase oder auch in verschiedenen Metastasen unterschiedlich sein. Diese Dynamik ist Ausdruck der intratumoralen Heterogenität und des evolutionären Wachstumsmusters. Weiters wird die PD-L1-Expression durch TKI moduliert, was zur Dynamik des Expressionsprofils beiträgt. PD-L1-Expression korreliert auch mit MET-Expression, einer Kinase, die bei Resistenz auf VEGFR-TKI wie Sunitinib hochreguliert ist und eine aggressive Biologie anzeigt. Dies erklärt auch, warum bei PD-L1-Expression ein schlechtes Ansprechen auf Sunitinib und andere klassische VEGFR-TKI zu erwarten ist.
PD-L1-Expression ist nicht nur an Tumorzellen, sondern in variablem Ausmaß auch an Immunzellen feststellbar; heute werden zumeist kombinierte Ergebnisse der PD-L1-Expression (Tumorzellen und Immunzellen) angegeben.
Genexpressionssignatur als Marker
Die Analyse von Transkriptom-Signaturen wurde als begleitendes Forschungsprojekt bei Studien mit dem PD-L1-Inhibitor Atezolizumab und dem VEGF-Inhibitor Bevacizumab durchgeführt (Studien IMmotion 150 und IMmotion 151). Spezielle Genexpressionssignaturen konnten dem Benefit durch eine Therapie zugeordnet werden: Die Angiogenese-Signatur korrelierte mit gutem Ansprechen auf Sunitinib, die T-Effektor- Signatur korrelierte erwartungsgemäß mit Ansprechen auf Atezolizumab. Bei Patienten mit einer Myeloid-Inflammationssignatur schien nur durch die Kombination aus PD-L1-Inhibitor und Anti- VEGF-Therapie ein Benefit gegeben zu sein, nicht durch alleinige PD-L1-Inhibitortherapie.
Tumor Mutational Burden (TMB) als Marker
Im Gegensatz zu anderen Tumorentitäten konnte beim RCC bislang keine Assoziation zwischen TMB und Outcome mit Immuncheckpoint-Inhibitoren festgestellt werden. Indel-Mutationen (Insertion, Deletion) könnten eine größere Rolle spielen; dies ist aber noch Gegenstand der aktuellen Forschung.
Histologische Kriterien als Marker
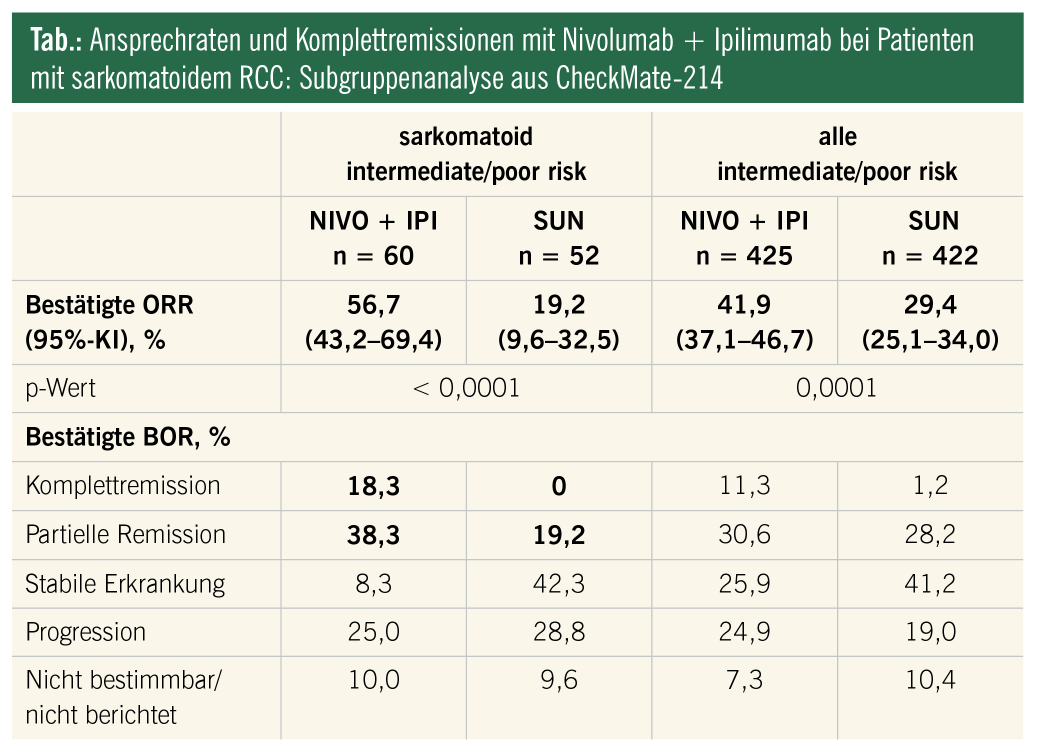
Patienten mit sarkomatoiden Tumoren, einer hochaggressiven Variante, die sowohl bei klarzelligen als auch nichtklarzelligen Histologien zu beobachten ist, profitieren erheblich von einer IO-basierten Therapie, insbesondere von der IOIO-Therapie (Tab.). Die CR-Rate in dieser Population war nie höher, und das mediane Überleben ist ebenfalls bislang unerreicht (Tab.).
Erstlinien- Therapieentscheidungen …
… auf Basis molekularer und klinischer Befunde
Beim mRCC gibt es derzeit keine anerkannten molekularen Marker, die für Therapieentscheidungen in der Erstlinie herangezogen werden. Dennoch sollte die Fülle an Forschungsergebnissen dazu veranlassen, einige kritische Überlegungen anzustellen.
- Patienten mit günstigem IMDC-Risiko haben häufiger eine starke Angiogenese-Signatur und oftmals noch keine sehr ausgeprägte T-Effektor-Signatur: Demnach können diese Patienten von einer Anti-VEGFR-Therapie-basierten Therapie profitieren. Bislang gibt es in Bezug auf Patienten mit günstigem IMDC-Risiko noch Ungewissheit, ob diese Patienten wirklich mehr von IOVE als reiner TKI-Monotherapie profitieren.
- Patienten mit inflammatorischer/ Myeloid-Signatur: Dieses Profil spiegelt sich bereits im Labor wider: Es sind Patienten mit einer hohen Neutrophilen-Lymphozyten-Ratio (NLR); oft ist dies von erhöhtem CRP begleitet: Diese Patienten benötigen vermutlich einen immunmodulierenden TKI (in Form von vorangehender TKI-Therapie oder in Form von IOVE-Kombinationstherapie?). Hohe CRP-Werte reflektieren hohe Interleukin-6-Spiegel, was wiederum Myeloid Derived Suppressor Cells (MDSCs) triggert; diese hemmen das Ansprechen auf IO.
- Alle anderen Patienten profitieren vermutlich in hohem Ausmaß von IOIO-Kombinationen, insbesondere, wenn eine sarkomatoide Differenzierung vorliegt (Tab.).
Weitere Faktoren, die in Therapieentscheidungen einfließen, sind …
- Alter und die damit verbundene Frage: Kann man mit einem vorsichtig dosierten TKI unter Umständen auch eine normale Lebenserwartung erreichen? Dies hätte auch den Vorteil eines gut bekannten, gut steuerbaren – und nach Absetzen rasch reversiblen – Toxizitätsprofils).
- lokal nicht therapierbare Hirnmetastasen? Die IO-Therapie ist, solange es einen Bedarf für höher dosiertes Kortison gibt, nicht sinnvoll, allerdings waren die Ergebnisse mit klassischen TKI bislang auch sehr bescheiden; Cabozantinib scheint hier eine Ausnahme zu sein: es wurde hier eine beeindruckende Wirksamkeit im ZNS bis hin zu Komplettremissionen bei einzelnen Patienten berichtet.
- nichtklarzelliges RCC: Wenngleich es noch keine Phase-III-Daten gibt, sind die Ergebnisse mit IO vielversprechend.
Literatur:
-Motzer RJ et al., New Engl J Med 2018
-Motzer RJ et al., Lancet Oncol 2019-Rini BI et al., New Engl J Med 2019
-Escudier B et al., Ann Oncol 2019-Albiges L et al., Journal of Urology 2019
-Callea M Cancer Immunol Res 2015-McDermott DF et al., Nature Med 2018
-Ciccarese C et al., Clin Genitourin Cancer 2018
-Suarez C et al., Results from Keynote 427, cohort B, ESMO 2019