Etablierte Konzepte und zukünftiges Potenzial – Die gesunde Stammzelle in der Therapie
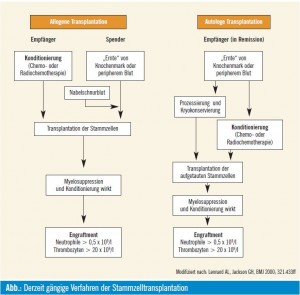 Parallel zur klinischen Entwicklung der Stammzelltransplantation wuchsen auch unsere Erkenntnisse zu den dahinterliegenden Prozessen. Einerseits wurden die immunologischen Effekte aufgeklärt, die zumindest bei der allo – genen Stammzelltransplantation den wesentlichen Teil des Therapieerfolgs bewirken, andererseits konnte auch die autologe Stammzelltransplantation weitestgehend optimiert werden und gehört heute zur Primärbehandlung nach Induktionstherapie von Erkrankungen wie dem multiplen Myelom sowie zur Rezidivtherapie von PatientInnen mit malignen Lymphomen. In der Abbildung (modifiziert nach Lennard and Jackson, 2000) werden die derzeit gängigen Verfahren der Stammzelltransplantation dargestellt.
Parallel zur klinischen Entwicklung der Stammzelltransplantation wuchsen auch unsere Erkenntnisse zu den dahinterliegenden Prozessen. Einerseits wurden die immunologischen Effekte aufgeklärt, die zumindest bei der allo – genen Stammzelltransplantation den wesentlichen Teil des Therapieerfolgs bewirken, andererseits konnte auch die autologe Stammzelltransplantation weitestgehend optimiert werden und gehört heute zur Primärbehandlung nach Induktionstherapie von Erkrankungen wie dem multiplen Myelom sowie zur Rezidivtherapie von PatientInnen mit malignen Lymphomen. In der Abbildung (modifiziert nach Lennard and Jackson, 2000) werden die derzeit gängigen Verfahren der Stammzelltransplantation dargestellt.
Ziel von aktuellen Forschungsanstrengungen ist es, zusätzlich modulierend einzugreifen. Unsere Erkenntnisse zur Biologie der Stammzelle erweitern sich ständig, sodass die Manipulation von Stammzellen zum therapeutischen Einsatz auch ohne komplette Stammzelltransplantation möglich erscheint. Die partielle Transplantation wäre auch ein Einsatzgebiet für pluripotente Stammzellen (iPS), die in Zukunft – ohne die ethischen Probleme embryonaler Stammzellen – für die ergänzende Behandlung degenerativer Erkrankungen eingesetzt werden könnten.
Autologe Stammzelltransplantation
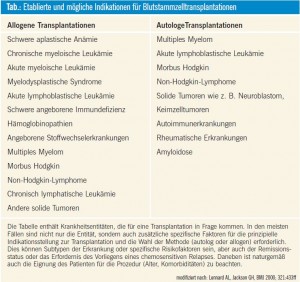
Das Konzept der autologen Transplantation beruht auf der Hochdosistheorie. Diese besagt, dass nach konventioneller Chemotherapie eine Resterkrankung im Körper zurückbleibt und eine Dosissteigerung der Chemotherapie, die allerdings ohne Stammzellgabe zur dauerhaften Insuffizienz der Blutbildung führen würde, eine langfristige Tumorkontrolle ermöglichen kann. Somit macht die Stammzelltransplantation eine Hochdosis-Chemotherapie erst möglich und kann die Heilungschancen bei verschiedenen Krebserkrankungen erhöhen. Bei der autologen Stammzelltransplantation werden patienteneigene Stammzellen entnommen, früher aus Knochenmark, heute meist durch Gewinnung aus peripherem Blut. Die sich daraus ergebende Problematik besteht in der möglichen Kontamination der gewonnenen Stammzellen mit Tumorzellen, aus denen nach Transplantation ein Rezidiv erwachsen kann. Daher werden Stammzellen erst nach einigen Zyklen konventioneller Chemotherapie in Remission entnommen („Invivo- Purging“). Versuche, Stammzellen ex vivo von Tumorzellen zu trennen („Exvivo- Purging“), sind derzeit kein Routineverfahren. Bei Patienten, die unter Erkrankungen mit einer hohen Mitbeteiligung des Knochenmarks leiden, besteht die Gefahr einer hohen Kontaminationsrate der Stammzellen durch Tumorzellen; sie stellen daher keine Indikation zur autologen Transplantation dar und kommen möglicherweise für eine allogene Transplantation in Frage (Tab.). Seitens der Toxizität ist die autologe Transplantation bei entsprechender Auswahl der Patienten und dank der Entwicklung moderner supportiver Therapien ein risikoarmes Routineverfahren.
Allogene Stammzelltransplantation
Aus historischer Sicht stammt das Konzept der allogenen Transplantation aus der Überlegung, gesunde Stammzellen zu transplantieren. Die Beobachtung der Abstoßungsreaktion (Graft-versus-Host- Erkrankung) und der dabei ablaufenden Immunprozesse (Graft-versus-Tumorbzw. -Leukämie-Effekt) zeigten sehr bald, dass der therapeutische Effekt einer allogenen Stammzelltransplantation neben der Zerstörung von Tumorzellen im Rahmen der Konditionierung (klassisch Hochdosischemotherapie und Ganzkörperbestrahlung) in einer durch die transplantierten Stammzellen mediierten Immuntherapie zur dauerhaften Unterdrü – ckung der minimalen Resterkrankung beruht. Voraussetzung zur allogenen Transplantation ist die Verfügbarkeit eines HLA-identen Spenders (Geschwisterspender oder Fremdspender), alternativ ist als Quelle auch HLA-identes Nabelschnurblut möglich. Die Toxizität (einschließlich therapiebezogener Mortalität) der klassischen myeloablativen Stammzelltransplantation ist beträchtlich und durch die Hochdosischemotherapie, die für das Engraftment notwendige zusätzliche Immunsuppression sowie die Graftversus- Host-Erkrankung bedingt. Allerdings stellt diese Therapieform für manche Erkrankungen die einzige Chance auf Heilung dar (Tab.). Da aufgrund der genannten Toxizität nur junge gesunde Patienten myeloablativ transplantiert werden können und wie erwähnt der immunologische Prozess wichtiger als der Hochdosischemotherapieeffekt ist, wurden Protokolle mit reduzierter Intensität der Konditionierung entwickelt: RIC (reduced intensity conditioning). Niedrig dosierte Chemotherapie und/oder Bestrahlung zusammen mit Immunsuppressiva ermöglichen ein Engraftment und damit eine immunologische Kontrolle der Erkrankung. Die niedrigere Intensität bedingt allerdings das Vorliegen einer Remission nach konventioneller Therapie vor der Transplantation, und auch bei dieser Modalität kann die Toxizität – wenn auch geringer als bei der klassischen Konditionierung – durch die immunologischen Prozesse beträchlich sein. Für viele Indikationen ist der Stellenwert der RIC-Transplantation noch offen.
Stellenwert der Stammzelltransplantation gegenüber neuen Medikamenten
In der Entwicklung neuer Therapieoptionen in der Medizin werden meist gleichzeitig verschiedene Wege beschritten. Während die Stammzelltransplantation bei einigen Krankheitsentitäten als Standardtherapie etabliert wurde, wurden parallel Medikamente entwickelt, die zielgerichtet pathophysiologische Prozesse angreifen und damit zu einer Heilung oder Krankheitskontrolle führen sollen.
So wurden beispielsweise für das multiple Myelom zielgerichtete Therapien (Proteasomeninhibitoren und IMIDS [immunmodulatory drugs]) entwickelt. Allerdings ist die autologe Stammzelltransplantation weiterhin Standard für junge Myelompatienten, denen diese Prozedur zugemutet werden kann.
Bei der chronisch myeloischen Leukämie wurde die Stammzelltherapie, die bei geeigneten Patienten frühzeitig eingesetzt wurde, von Tyrosinkinaseinhibitoren (TKI) verdrängt und spielt heute nur bei Patienten, die auf TKI nicht ansprechen oder relapsieren, eine Rolle.
Für alle Indikationen gilt, dass eine genaue Abwägung erfolgen muss zwischen der durch die (allogene) Stammzelltransplantation möglichen Heilung, die allerdings mit therapiebezogener Mortalität und Morbidität verbunden ist, und einer meist weniger toxischen Dauermedikation, die jedoch nur in den seltensten Fällen zur Heilung führen kann.
Die Zukunft wird weisen, inwieweit integrative Therapiekonzepte, die beide Modalitäten beinhalten, für den Patienten den größtmöglichen Vorteil bieten können.
Stammzelltransplantation bei nichtmalignen Erkrankungen
Angeborene Stammzellerkrankungen: Eine weitere Indikation zur allogenen Stammzelltransplantation stellen angeborene Erkrankungen der blutbildenden Stammzelle dar, wie sie zum Beispiel bei Hämoglobinopathien wie der Thalassämie bestehen können. Hier steht der Ersatz der fehlenden Funktion im Vordergrund. Eine Elimination von Tumorzellen ist ebensowenig erforderlich wie ein Graft-versus-Leukemia-Effekt.
Autoimmunerkrankungen: Einzelbeobachtungen, welche die Remission von gleichzeitig bestehenden nichtmalignen Erkrankungen wie z. B. Autoimmunerkrankungen im Rahmen der allogenen Stammzelltransplantation bei Leukämiepatienten beschreiben, belegen ebenfalls das Konzept der Stammzelltransplantation als Immuntherapie. Blutstammzelltransplantationen in rheumatologischen Indikationen werden durchgeführt, die Abwägung zwischen Vorteil und Toxizität ist hier allerdings kritisch zu sehen, möglicherweise könnte die systemische Sklerose eine Indikation darstellen. Derzeit sollte der Einsatz der Transplantation nur in klinischen Studien erfolgen.
Neuere Ansätze
Eine Optimierung der Stammzell-Ernteverfahren, die Möglichkeit der „In-vitro- Kultur“ von Stammzellen im Labor sowie neue Möglichkeiten zum zielgerichteten partiellen Einsatz von Stammzelltransplantationen werden in Zukunft zu einer höheren Sicherheit der Transplantate und zu einer Erweiterung möglicher Indikationen beitragen.
Das gilt auch für sanftere Konditionierungsprotokolle, die älteren PatientInnen mit hämatologischen Erkrankungen oder Tumoren zu Gute kommen. Neue Ansätze zur Immunsuppression werden Transplantationen unbhängiger von HLA-Subtypen machen.
Das gilt auch für verbesserte Mediatoren zur Gentherapie, Tumorvakzine und Agentien zur Radionuklid-Konditionierung.
Gentherapie: Im Rahmen der Gentherapie wird üblicherweise ein defektes durch ein intaktes Gen ersetzt, was prinzipiell nur bei so genannten monogenetischen Erkrankungen sinnvoll ist. Die weltweit erste gentherapeutische Behandlung wurde 1990 bei einem Mädchen mit angeborener SCID (Severe Combined Immune Deficiency) durchgeführt.
In diesem Fall wurde das intakte Gen (CD132) in Blutstammzellen transferiert und dann mittels Stammzelltransplantation eingebracht. Trotz der Notwendigkeit, diese Prozedur aufgrund der begrenzten Lebensdauer der Leukozyten immer wieder zu wiederholen, ist sie stabiler und länger effektiv als die Einbringung von Genen im Zuge einer In-vivo- Gentherapie in differenziertere Zellen. Zu beachten ist allerdings die Toxizität der Konditionierung und die Gefährdung des Patienten durch Viren, die zum Gentransfer eingesetzt werden. Obwohl bereits viele klinische Studien durchgeführt worden sind, handelt es sich hierbei immer noch um experimentelle Ansätze, deren Wirksamkeit und Langzeiteffekte noch zu belegen sind.
Auch Verfahren, die sich damit beschäftigten, Gene einzubringen, die eine therapeutische Funktion erfüllen sollen (z. B. gezielte Freisetzung letaler Genprodukte in Tumorzellen), waren bis jetzt langfristig nicht erfolgreich. Probleme stellten einerseits die Stabilität (= Wirksamkeit) des eingebrachten Gens sowie andererseits mögliche unerwünschte Wirkungen der Prozedur dar. Trotz teilweise erfolgreicher klinischer Studien gibt es daher bislang kein zugelassenes Gentherapie-Protokoll.
Tumorvakzine: Zur Stimulierung des Immunsystems werden Tumorvakzine derzeit z. B. für die Bekämpfung von Non- Hodgkin-Lymphomen getestet. Für die Optimierung der Immuntherapie sind aber noch weitere Forschungsarbeiten notwendig.
Radionuklid-Konditionierung: Bei diesen experimentellen Ansätzen hat man versucht, Radionuklide an Antikörper gegen Stammzellantigene zu koppeln. Man kann damit eine höhere Strahlungsdosis spezifisch fokussieren und systemische Nebeneffekte reduzieren. Für derartige Ansätze sind auch Nanopartikel in Erprobung.
Zukunft: Stammzellen als biologischer Jungbrunnen?
Ausdifferenzierte Körperzellen kann man durch Fusion mit embryonalen Stammzellen (ES-Zellen) oder auch Eizellen in einen pluripotenten Zustand versetzen und auf diese Weise induzierte pluripotente Stammzellen (iPS) erzeugen. Ein Pionier auf diesem Forschungsgebiet ist der in den USA forschende Österreicher Thomas Hochedlinger (Wu and Hochedlinger, 2011).
Da nur wenige Gene für die Reprogrammierung von Bindegewebszellen (Fibroblasten) zu pluripotenten Zellen aus verschiedensten Organen wie z. B. Blut, Leber, Gehirn oder Pankreas notwendig sind, kann man mittlerweile bei der Herstellung von iPS auf ES-Zellen verzichten.
Bei den vier für die iPS-Herstellung notwendigsten Genen (c-MYC, KLF-4, OCT-4 und SOX-2) fehlt interessanterweise das NANOG-Gen, das für die Selbsterneuerung von Tumorstammzellen ver – antwortlich ist. Es wird jedoch in Kombination mit einem weiteren Gen (LIN-28) benötigt, wenn man bei der Reprogrammierung auf das Proto-Onkogen c-MYC verzichten will.
Mit ähnlichen Experimenten konnte die prinzipielle Möglichkeit gezeigt werden, dass durch Veränderung der Expressionsmusters verschiedener Transkriptionsfaktoren der Zelltyp von somatischen Zellen geändert werden kann, was zur Entdeckung der so genannten Transdifferenzierung führte. Mittlerweile ist bekannt, dass derartige Transdifferenzierungen auch in der Natur vorkommen und eine zentrale Rolle bei der Entstehung von Tumor-Stammzellen spielen, wobei es auch durchaus sein kann, dass epitheliale Zellen zu mesenchymalen (Stamm-)Zellen transdifferenzieren und vice versa.
Während also einerseits die Hoffnung auf viele neue Behandlungsoptionen durch verjüngte Zellen, die von den Patienten selbst stammen, genährt wird, muss die biologische Nähe zu grundlegenden Mechanismen der Onkogenese im Auge behalten werden. Die neuen Verfahren der In-vitro-Herstellung von iPS werden auf jeden Fall – ebenso wie die Erfahrungen mit der seit dem Klonschaf Dolly (im Jahr 1997) bekannten Möglichkeit des Klonens mit Hilfe von Eizellen durch Zellkerntransfer – unser Wissen über die Krebsentstehung verbessern. Dies gilt besonders auch für epigenetische Prozesse, die entscheidend bei der Differenzierung, aber auch Transoder Entdifferenzierung von Stammzellen bzw. diversen anderen Körperzellen verantwortlich sind (Ohi et al., 2011).
Schlussfolgerung
Die Anwendung von Erkenntnissen und Technologien aus der Stammzellforschung in der klinischen Praxis hat sich bei etablierten Methoden wie der Transplantation von hämatopoetischen Stamm – zellen als für die Patienten sinnvoll erwiesen. Indikationen und Stellenwert gegenüber anderen Methoden sind natürlich regelmäßig zu überprüfen. Die neuen Erkenntnisse aus der Stammzellforschung lassen weitere Therapiegebiete und Anwendungen für die Zukunft erwarten.
FACT-BOX• Gesunde Stammzellen können therapeutisch eingesetzt werden.
• Etablierte Therapieverfahren sind die autologe und allogene Blutstammzelltransplantation.
• Durch die Transplantation mediierte Immuneffekte haben wesentlichen Anteil am Therapieerfolg.
• Gesunde Stammzellen könnten in Zukunft Vehikel für Gen-, Immun- und Vakzin – therapien sein.
• Denkbare, aber noch nicht etablierte Manipulationsmöglichkeiten von gesunden Stammzellen könnten die Behandlung verschiedenster Erkrankungen revolutionieren.
Literatur:
– Jenq RR, van den Brink MR (2010), Allogeneic haematopoietic stem cell transplantation: individualized stem cell and immune therapy of cancer. Nat Rev Cancer 10:213–221
– Lennard AL, Jackson GH (2000), Stem cell transplantation. BMJ 321:433–437 – Ohi Y, Qin H, Hong C, Blouin L, Polo JM, Guo T et al. (2011), Incomplete DNA methylation underlies a transcriptional memory of somatic cells in human iPS cells. Nat Cell Biol 13:541–549
– Thomas ED, Ashley CA, Lochte HL, Jr., Jaretzki A, 3rd, Sahler OD, Ferrebee JW (1959), Homografts of bone marrow in dogs after lethal total-body radiation. Blood 14:720–736
– Wu SM, Hochedlinger K (2011), Harnessing the potential of induced pluripotent stem cells for regenerative medicine. Nat Cell Biol 13:497–505