Grundlagen und klinische Aspekte der supportiven Ernährungstherapie – Die Rolle der Ernährung in der Hämato-Onkologie
Nahrungsbedarf und Definition der Mangelernährung bei Tumorpatienten: Der tägliche Energiebedarf liegt bei 25–35 Kilokalorien pro Kilogramm Körpergewicht und Tag.
Bei Tumorpatienten ist auf eine tägliche Eiweißzufuhr von 1,2 ± 1,5 g pro kg Körpergewicht zu empfehlen. Auf eine ausreichende Versorgung mit Mikronährstoffen (Vitaminen, Spurenelementen) ist zu achten; als Minimum sollten die Zufuhrempfehlungen für die künstliche Ernährung gesunder Personen eingehalten werden. 1
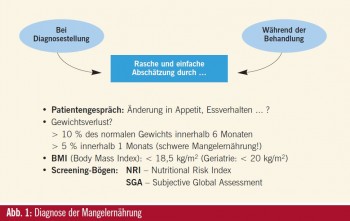
Wir sprechen von Mangelernährung bei Patienten mit einem Gewichtsverlust von mehr als 10 % innerhalb der letzten 6 Monate bzw. mehr als 5 % innerhalb eines Monats oder einem Body Mass Index (BMI) von unter 18,5 (Abb. 1). Diese Parameter können schnell und einfach bei der Aufnahme von Patienten erhoben werden. Eine genauere Abschätzung kann mittels verschiedener standardi – sierter Screening-Verfahren (Subjektives Global Assessment [SGA], Maastricht Index [MI], Mini Nutritional Assessment [MNA], Nutritional Risk Index [NRI]) erfolgen, wobei beim Nutritional Risk Index neben dem Körpergewicht auch noch der Albumingehalt mit einbezogen wird.
Tumorkachexie: Bei Tumorpatienten können der Tumor selbst sowie die Nebenwirkungen der lokalen bzw. systemischen Therapien während der unterschiedlichen Erkrankungsstadien den Ernährungszustand des Patienten negativ beeinflussen (Abb. 2). Zwischen 30 und 80 %2, 3der Patienten haben als erstes Symptom ihrer Tumorerkrankung einen klinisch relevanten Gewichtsverlust von mehr als 10 % ihres Ursprungsgewichtes. Ein Tumor kann eine chronische Entzündungsreaktion auslösen und dadurch signifikante metabolische Effekte aus – lösen. Es kommt zu einer gesteigerten Lipolyse, Inappetenz mit erhöhtem Ruheumsatz und durch eine systemische inflammatorische Reaktion des Körpers auf den Tumor mit katabol wirkenden appetithemmenden und proinflammatorischen Zytokinen zur Tumorkachexie.4 Ähnlich wie bei manchen chronisch entzündlichen Erkrankunegen scheint der ständige inflammatotische Reiz des Tumors zu einer katabolen Stoffwechsellage zu führen. Der Begriff „konsumierende Erkrankung“ beschreibt dieses Zustandsbild sehr gut. Erhöhtes CRP und reduziertes Albumin sind Indikatoren dieser systemischen inflammatorischen Reaktion und stellen bei einigen Tumorerkrankungen einen unabhängiger Prognosefaktor dar. (Glasgow Index). Die Kombination von reduzierten Nahrungsaufnahme und tumorassoziierter inflammatorischer Reaktion führt somit nicht zu einem Abbau der Fettmassen wie beim gesunden Fastenden, sondern zu einem Verlust von Körpereiweiß5 des funktionellen Körpergewebes6 wie Muskelmasse und Albumin. Auch verschiebt sich intrazelluläre Flüssigkeit in den extrazellulären Raum, und es kann zu einer Insulinresistenz mit Glukoseintoleranz im Spätstadium kommen.
Weiters kann – durch Krankheit und Katabolismus bedingt – die Aktivität auf die eines bettlägrigen Patienten absinken, was zu einem weiteren Eiweißverlust von bis zu 300 Gramm pro Woche führen kann.
Das Abschätzen des Ernährungszustands adipöser Tumorpatienten ist naturgemäß schwieriger. Ein Patient mit einem BMI von 30 kann 20 % seines Körpergewichtes abnehmen, um normalgewichtig zu werden, und würde erst bei einem BMI von unter 18,5 als untergewichtig gelten. Dies würde bedeuten dass ein 170 cm großer und 95 kg schwerer Patient erst nach einer Gewichtsabnahme von 35 kg einem Ernährungsteam vorgestellt wird. Dies ist besonders durch die steigenden Anzahl von übergewichtigen aber mangelernährten Personen zu beachten.
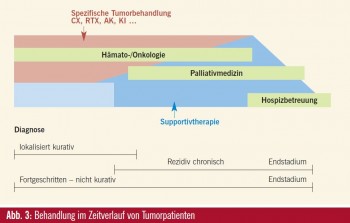
Behandlungsoptionen im Krankheitsverlauf: Patienten werden je nach Alter und Art der Tumorerkrankung sehr unterschiedlich in der Intensität und Dauer spezifisch gegen Ihre Grunderkrankung therapiert und immer durch supportivmedizinischen Maßnahmen begleitet (Abb. 3). Patienten mit metastasiertem Kolorektalkarzinom mit einer Krankheitsdauer von 2–3 Jahren werden je nach Alter oder Komorbidität zwischen 6 bis 12 Monate mit Chemotherapien und oder Antikörpern therapiert werden. In Europa sind 40 % aller Patienten mit diagnostiziertem Kolorektalkarzinom über 75 Jahre alt (Eurocare), eine Population, die in keinen randomisierten medikamentösen Studien vertreten ist und die wahrscheinlich wegen bestehender Komorbiditäten und erhöhter Nebenwirkungen der Therapien von einer zusätzlichen Ernährungstherapie profitieren könnte.
Prognostische Bedeutung des Gewichtsverlusts bei Tumorpatienten: Patienten mit Gewichtsverlust haben eine ungünstigere Prognose als Patienten, die ihr Gewicht stabil halten können.7, 8 Es werden signifikant mehr behandlungsbedingte Nebenwirkungen bei Patienten, die an einem Gewichtsverlust leiden, beobachtet. Ca. 30 % der Patienten versterben an tumorbedingter Kachexie und Erschöpfung. Somit beeinflusst die Mangelernährung die Lebensqualität und Tolerabilität von Chemotherapien negativ. 9–12
Nach der Sepsis ist die Tumorkachexie die häufigste Todesursache bei Patienten, die an Tumoren erkranken.13 Auch ist der Eiweißgehalt des Körpers ein sehr aussagekräftiger Prädiktor für das Auftreten von Neutropenien nach Chemotherapie bei Patientinnen mit Mammakarzinom.14 Es ist aber nicht klar, ob die Unterernährung per se oder die primär zugrunde liegende Erkrankung für die schlechte Prognose der Patienten verantwortlich ist. Bei Patienten mit HNO-Tumoren15, Pankreaskarzinomen16, Magenkarzinomen und Ösophaguskarzinomen spielt die Mangelernährung eine große Rolle.
HNO-Tumorpatienten haben während der Lokaltherapie ein tägliches Kaloriendefizit von bis zu 900 Kilokalorien pro Tag – und die Mangelernährung kann zum Abbruch einer potenziell kurativen Therapie führen.
Bezüglich supportiver Ernährungstherapie wird der behandelnde Arzt im klinischen Alltag mit folgenden Fragen befasst17:
Kann eine enterale/parenterale Ernährung den Ernährungszustand und die Lebensqualität von Tumorpatienten verbessern?
Eine konsequente Ernährungsberatung und Therapie verbessert den Ernährungszustand und die Lebensqualität der betroffenen Patienten18 und kann auch die Überlebenszeit mancher Tumorpatienten verlängern.19–22
Es scheint wichtig zu sein, frühzeitig mit der Ernährungstherapie zu beginnen.23 Patienten im Endstadium ihrer Erkrankung, mit massiver diffuser Entzündungsreaktion und erheblichem Gewichtsverlust können von einer Ernährungstherapie nur noch wenig profitieren.
Leider ist die Datenlage bezüglich randomisierter Studien limitiert, und viele Empfehlungen beruhen auf klinischen Erfahrungen oder Empfehlungen von Expertengremien.
Gibt es eine spezifische Ernährung für Tumorpatienten?
Es gibt keine Daten von kontrollierten Studien, die den Wert einer spezifischen enteralen Ernährung belegen. Gerade hier muss der Patient ausführlich aufgeklärt werden, um ihn vor extremen Ernährungsformen zu schützen. Es gibt aber Hinweise, dass die Glukosetoleranz bei Tumorpatienten verschlechtert sein kann. Die Anzahl der Studien, die lipidfreie und lipidhältige enterale Ernährung vergleichen, ist limitiert. Im Prinzip sollte der Tumorpatient eine ausgewogene Ernährung mit 1–1,2 g Eiweiß pro Tag und Kilogramm Körpergewicht erhalten.24 Ob die Zugabe von Omega-3-Fettsäuren sinnvoll ist, ist unklar.25
Wann sollte eine enterale Ernährungstherapie begonnen werden?
Eine enterale Ernährungstherapie sollte begonnen werden, wenn der Patient mangelernährt ist (Definition siehe oben), oder auch wenn der Patient über eine längere Periode (10 Tage) weniger als 60 % der benötigten Ernährung zu sich nehmen kann. Dies gilt speziell bei Radio-Chemotherapien, um therapieassoziierte Gewichtsverluste primär schon zu verhindern, z. B. bei gastrointestinalen oder HNO-Tumoren, ebenso bei Patienten, die an einer schweren Mukositis leiden.
Kann die metabolische Situation durch Appetitanreger oder andere therapeutische Interventionen gebessert werden?
Steroide können kurzzeitig den Appetit steigern26, die Übelkeit senken und damit auch die Nahrungsaufnahme insgesamt erhöhen, haben aber keinen Langzeitaffekt auf die fettfreie Körpermasse bzw. die Muskelmasse. Auch der Wert der Androgene ist hier bescheiden. Wesentlich und in Studien gut untersucht ist der Wert der primären Prophylaxe von therapieinduzierter Emesis/Nausea (Erbrechen und Übelkeit).
Gibt es eine Indikation für eine enterale Therapie während einer Chemotherapie?
Diesbezüglich gibt es keine klaren Daten27, es ist aber sinnvoll, die allgemeinen supportiven medizinischen Regeln wie Prophylaxe von Emesis, Mukositis etc. einzuhalten und auf den Ernährungszustand des Patienten während der Chemotherapie zu achten um frühzeitig einen Gewichtsverlust zu erkennen.
Gibt es eine Indikation für enterale Ernährungstherapie während einer autologen oder allogenen Stammzelltransplantation?
Hier gibt es keine klare Indikation.28
Wie soll bei Patienten im Endstadium einer Erkrankung ernährt werden?
Bei Patienten, die zumindest eine Lebenserwartung von 2–3 Monaten haben, kann eine Ernährungstherapie sinnvoll sein.29, 30 Es sollte eine Ernährungstherapie schon frühzeitig bei Gewichtsverlust eingeleitet werden, weil Interventionen im Endstadium von Tumorerkrankungen meist zu spät kommen. Hier ist eine Ernährungstherapie von fraglichem Wert31 und sollte keinesfalls zu invasiven Maßnahmen verleiten (PEG-Sonde, Port-a-Cath). Es ist darauf zu achten, dass dem Patienten ausreichend Flüssigkeit zugeführt wird – bei Schluckstörungen kann man sich auch mit subkutanen Infusionen behelfen.32 Meistens wird eher das subjektive Gefühl einer Mundtrockenheit für die Patienten als äußerst störend empfunden, während das Hungergefühl nicht primär im Vordergrund steht.
Gibt es Hinweise dafür, dass eine Ernährungstherapie das Tumorwachstum stimuliert?
Es gibt keinerlei Daten, die belegen, dass eine enterale Ernährung das Überleben von Tumorpatienten verkürzt.33, 34 Solche theoretischen Überlegungen sollten keinen Einfluss auf eine sinnvolle Ernährungstherapie haben, und es scheint klinisch wenig sinnvoll zu sein, einen Patienten mit erhöhtem Ruheumsatz und kataboler Stoffwechsellage nicht ausreichend zu ernähren.
Parenterale Ernährung (PE)
Wann sollte eine parenterale Ernährung begonnen werden?
1. Eine parenterale Ernährung ist indiziert, wenn beim Patienten eine orale/enterale Nahrungszufuhr < 500 kcal/Tag für 3–5 bzw. mehr als 5 Tage zu erwarten ist. Wenn über eine Periode von 10–14 Tage eine orale enterale Ernährung < 60 % des Bedarfs erwartet wird.
2. Wenn eine orale Ernährung über längere Zeit nicht zu einer ausge – glichenen Energiebilanz führt.
3. Wenn parenterale Ernährung sowohl die Nebenwirkungen als auch die Compliance von aktiven systemischen Therapien verbessern kann.
Im Prinzip sollte die parenterale Ernährung nur Ergänzung einer unzureichenden enteralen/oralen Ernährung sein, in jedem Fall sollte diese aber frühzeitig auch unterstützend eingesetzt werden. Meistens wird die parenterale Ernährung für eine limitierte Zeit zur Überbrückung verwendet, bis wieder eine volle enterale/ orale Ernährung des Patienten möglich ist.
Spezielle Supplementierung der PE: Es gibt keinerlei Daten, ob die Supplementierung der parenteralen Ernährung mit speziellen Substanzen wie z. B. Insulin oder Omega-3-Fettsäuren irgendeinen Effekt haben. Theoretisch wäre eine Insulinsupplementierung bzgl. der Insulinresistenz sinnvoll, dennoch zeigen sich hier keine signifikanten positiven Ergebnisse – daher ist es wahrscheinlich wichtiger, die zugeführte Glukose von vornherein möglichst einzusparen/zu reduzieren.
Parenterale Ernährung bei Patienten mit fortgeschrittenen Tumorerkrankungen: In einigen Studien wurde der Wert der parenteralen Ernährung als supportive Therapie bei mangelernährten Patienten mit fortgeschrittenen Tumorerkrankungen untersucht. Zumeist wurden die Patienten ergänzend zu einer enteralen Ernährung parenteral unterstützt und ca. 30 % des Ernährungsbedarfs wurde intravenös zugegeben.
Es zeigten sich positive Ergebnisse, was das Überleben, die Lebensqualität und auch die Therapietoleranz dieser Patientengruppe betraf. Zusätzlich wurde ein Anstieg des BMI, des Albumins, der Lebensqualität, des Appetits und der physischen Belastbarkeit dokumentiert.35–37 Diese Ergebnisse sind interessant, müssten allerdings in größeren Phase-3-Studien belegt werden, da eine parenterale, nächtliche Substitution mittels „Home – care“ zwar machbar, aber doch aufwändig ist. Auffällig bei 2 Studien (Shang und Hasenberg) ist, dass die Patienten in der Kontrollgruppe ausreichend enteral ernährt wurden und dass in beiden Gruppen kein Ernährungsdefizit bestand. Dennoch schnitt die Gruppe mit der parenteralen supportiven Ernährung besser ab als die ausschließlich enteral ernährte Patientengruppe.
Gerade Patienten, die eine Radiochemotherapie erhalten, leiden im Verlauf der Therapie zunehmend an Übelkeit, Diarrhoe, Hautreaktionen und Mukositis, die eine Nahrungsaufnahme erschweren. 38–40 In der Regel können nur zwischen 40 und 70 % der Patienten eine geplante potenziell kurative Radiochemotherapie bei HNO-Tumoren ohne Unterbrechung abschließen. Hier ist bezüglich Heilung eine konsequente Durchführung der Therapie essenziell, und bei dieser Patientengruppe scheint eine Ernährungstherapie während einer kurativen Therapie angebracht zu sein.41, 42 Bei Patienten mit bestehender schwerer Mangelernährung und bestehenden Toxizitäten, welche die enterale Nahrungsaufnahme erschweren, ist eine randomisierte Ernährungsstudie aus ethischen Gründen schwer durchzuführen.43
Homecare und Komplikationen: Eine andauernde PE setzt eine funktionierende Heimbetreuung voraus, da eine monatelange PE nicht im Krankenhaus durchgeführt werden kann und soll. Die nötige Implantation von permanenten Kathetern wie Hickman oder Port-a- Cath-Systeme verlangen Erfahrung im Management dieser Systeme. Es muss mit einer gewissen Komplikationsrate von 2 bis 9 % gerechnet werden44, 45 (z. B. Kathetersepsis), jedoch sind keine Todesfälle durch eine parenterale Ernährung zu verzeichnen.
Weiters ist auf die Leberfunktion zu achten46, die Menge der infundierten Fettlösung sollte 1 g/kg KG nicht überschreiten. Das optimale Verhältnis von Fett und Kohlenhydraten ist zwar umstritten, der Fettanteil kann aber ohne Nachteil bei über 35 % der Gesamtenergiezufuhr liegen. Es muss das Umfeld des Patienten mit der Unterstützung durch niedergelassene Kollegen, mobile Krankenschwestern sowie Einschulung betreuender Angehöriger unterstützt werden.44 Es ist z. B. in der mobilen Palliativversorgung durchaus möglich, dass Angehörige die parenterale Ernährungstherapie nach Einschulung übernehmen.
Stammzelltransplantation und PE: Die Indikation bezüglich parenteraler Ernährung ist bei diesen Patienten gegeben, da durch die Mukositis, Übelkeit, Erbrechen und Diarrhoe im Rahmen der Konditionierungschemotherapie eine parenterale Unterstützung nötig ist.
Es ist davon auszugehen, dass 90 % der Patienten, die eine allogene Stammzelltransplantation mit Ganzkörperbestrahlung erhalten, parenteral ernährt werden müssen.
Tumorwachstum und PE: Wie bei der enteralen Therapie gibt es keine Hinweise darauf, dass durch eine parenterale Ernährung das Tumorwachstum stimuliert wird.
In einer Metaanalyse wurde in 12 Publikationen bei insgesamt 140 Patienten, die parenterale Unterstützung erhielten, vs. 84 Kontrollpatienten kein Hinweis bezüglich einer Tumorstimulation erbracht.
Zusammenfassung
Die Ernährungstherapie muss möglichst frühzeitig im Verlauf der Tumorerkrankung durchgeführt werden und soll nicht erst bei massiven Mangelerscheinungen initiiert werden. Dies setzt voraus, dass der Ernährungszustand von onkologischen Patienten bereits bei Diagnosestellung genau beurteilt wird. Die Richtlinien der klinischen Ernährungsmedizin sollten bei Diagnose bereits beachtet werden, und es sollten nicht erst im Endstadium einer Erkrankung invasive ernährungstherapeutische Maßnahmen wie parenterale Ernährung, PEG-Sonde etc. gesetzt werden.
Da gerade bei fortgeschrittenen Kolorektalkarzinomen, Mammakarzinomen und anderen Tumorerkrankungen die Fortschritte der spezifischen onkologischen Therapien zwar kontinuierlich, aber noch immer nicht dramatisch sind, sollte der Wert von unterstützenden Therapien wie Ernährungstherapie nicht außer Acht gelassen und in weiteren Studien untersucht werden.
Erfreulicherweise fand heuer in der ÖGHO- Frühjahrstagung erstmals eine Sitzung der Gesellschaft für Hämato-Onkologie und der Arbeitsgemeinschaft für Klinische Ernährung (AKE) statt, und es ist zu hoffen, dass aus dieser Kooperation in Zukunft auch gut konzipierte, durchführbare klinische Studien entwickelt werden, um den Wert der Ernährungstherapie bei hämatoonkologischen Patienten exakt zu beurteilen. Hierbei ist sicher zu beachten, dass die unterschiedlichen Patientengruppen (kurative Behandlung, intensive systemische oder Lokaltherapie, palliative Behandlung, chronisch erkrankte Patienten) unterschiedliche Therapien und auch Ernährungstherapien benötigen.
1 Stratton R et al., Wallingford: CABI Publishing; 2003
2 Esper D et al., Nutr Clin Pract 2005; 20:369–376
3 Persson C et al., Clin Nutr 1999; 18:71–77
4 Fearon K et al., Surg Oncol Clin N Am 2001; 10:109–126
5 Tisdale MJ, Science 2000; 289:2293
6 McMillan DC et al., Clin Nutr 2000; 19:403–406
7 Andreyev HJN et al., Eur J Cancer 1998; 34(4):503–509
8 van Bokhorst-de et al., Cancer 1999; 86:519–527
9 Ravasco P et al., Support Care Cancer 2004; 12:246–252
10 Ravasco P et al., Radiother Oncol 2003; 67:213–220
11 Ravasco P et al., Clin Oncol 2003; 15:443–450
12 Ravasco P et al., J Clin Oncol 2005; 23:1431–1438
13 Ambrus JL et al., J Med 1975; 6(1):61–64
14 Aslani A et al., Cancer 2000; 88:796–803
15 Collins MM et al., Ann Royal Coll Surg 1999; 81(6):376–381
16 Wigmore SJ et al., Br J Cancer 1997; 75(1):106–109
17 Braga M et al., Clin Nutr 2009; 28:378–386
18 Baldwin C et al., Clin Nutr 2004; 23(6):1267–1279
19 Ravasco P et al., J Clin Oncol 2005; 23(7):1431–1438
20 Gogos CA et al., Cancer 1998; 82:395–402
21 Tandon S et al., Indian J Med Res 1984; 80:180–188
22 Druml W et al., 3rd ed. Vienna: Arbeitsgemeinschaft KlinischeErnährung (AKE); 2004
23 Bozzetti F et al., J Parenter Enteral Nutr 1989; 13(4):406–420
24 Nitenberg G et al., Crit Rev Oncol Hematol 2000; 34(3):137–168
25 Fearon KC et al., Gut 2003; 52(10):1479–1486
26 Ottery FD et al., Sem Oncol 1998; 25(Suppl. 6):35–44
27 Klein S et al., Nutr Clin Pract. 1994; 9:91–100
28 Muscaritoli M et al., Am J Clin Nutr 2002; 75(2):183–190
29 Bozzetti F et al., Clin Nutr 2003; 22(2):109–111
30 Howard L et al., Nutrition 2000; 16:625–628
31 Jonkers-Schuitema CF, Clin Nutr 2004; 23(6):1253–1255
32 Bruera E et al., Support Care Cancer 1996; 4(2):147–150
33 Rossi Fanelli F et al., Clin Nutr 1991; 10:228–232
34 Bozzetti F et al., Tumori 1999; 85(3):163–166
35 Lundholm K et al., Cancer 2004; 100:1967–1977
36 Hasenberg T et al., Colorectal Dis 2010 Oct; 12
37 Shang E et al., J Parenter Enteral Nutr 2006; 30:222–230
38 Van der Schueren MAEB et al., Cancer 1999; 86:519–527
39 Shang E et al., J Parenter Enteral Nutr 2006; 30:222–230
40 Finocchiaro E et al., Nutr Ther Metab 2007; 25:31–39
41 Van Bokhorst-de SM et al., Am J Clin Nutr 2001; 73:323–332
42 Ravasco P, et al., Head Neck 2005; 27:659–668
43 Freedman B et al., NEJM 1987; 317:141–145
44 Messing B et al., Gastroenterology 2006; 130:S43–S51
45 Kuizon D et al., Arch Intern Med 2001; 161:406–410
46 Quigley EM et al., Gastroenterology 1993; 104:286–301