Highlights zur Lymphomtherapie
Indolente Lymphome
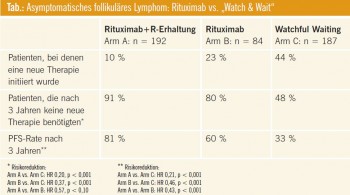
„Watch & Wait“ oder Rituximab? In der Plenarsitzung wurde von der „Britischen Kooperativen Gruppe“ das vorläufige Ergebnis einer Studie bei unbehandelten asymptomatischen follikulären Lymphomen im Stadium I–IV (ohne Bulk) vorgestellt (Abstract #6). 186 Patienten wurde in einen Beobachtungsarm (watch and wait), 84 in einen Therapiearm mit Rituximab-Induktion (375 mg/m2 4-wöchentlich) und 192 in einen Rituximab- Induktionsarm mit anschließender Erhaltung alle 2 Monate über 2 Jahre randomisiert. Der Arm mit alleiniger Induktion wurde frühzeitig geschlossen. Primärer Endpunkt war „Time to next therapy“. Die 3 Arme waren von den Risikofaktoren gut ausgeglichen. Nach 3 Jahren waren 48 % der Patienten im „Watch and wait“-Arm, 80 % der Patienten im Induktionsarm und 91 % der Patienten im Induktions- und Erhaltungsarm ohne neue Therapie (Tab.). Die Daten zur Lebensqualität wurden noch nicht präsentiert. Das Gesamtüberleben war ident, allerdings ist die Beobachtungszeit für diesen Endpunkt sicher zu kurz.
Kommentar: Nachdem im „Watch and wait“-Arm die nächste Therapie zugleich auch die erste Therapie für diese Patienten war und in den beiden anderen Armen die nächste Therapie bereits die 2. Behandlung darstellte, war das Studien – ergebnis nicht überraschend. Klinisch relevant wäre vielmehr der Zeitraum bis zur ersten Rezidivtherapie. Dies würde eine Information über eine sofortige vs. verzögerte Rituximab-Therapie geben. Unklar bleibt auch die Auswirkung auf die Lebensqualität, immerhin sind im Therapiearm 2,5-mal so viele SAE aufgetreten. Wesentliche offene Fragen sind, ob sich im Therapiearm früher Resistenzen auf Rituximab entwickeln und wie sich die frühe Therapie letztlich auf das Überleben auswirkt? Der Schlussfolgerung der Autoren, dass diese Studie das Management von asymptomatischen Patienten mit follikulären Lymphomen verändert, konnten sich in der Diskussion viele nicht anschließen.
Radioimmuntherapie bei FL: Zwei Abstracts berichteten über die Radioimmuntherapie bei follikulären Lymphomen mit 90Yttrium-Ibritumomab-Tiuxetan. Hagenbeek (Abstract #594) brachte ein Update der FIT-Studie, das eine weitere Verbesserung des progressionsfreien Intervalls für die konsolidierende Radioimmuntherapie in erster Remission nach Chemotherapie zeigte, aber auch nach 5,5 Jahren keinen Unterschied im Gesamtüberleben. Scholz et al. berichtete über ein medianes progressionsfreies Überleben von 17,9 Monaten bei Erst – linien-Radioimmuntherapie (Abstract #593) mit einer einmaligen Gabe bei sehr geringer Toxizität.
Kommentar: In beiden Studien waren Patienten mit > 25%igen Knochenmarksbefall oder Bulky Disease ausgeschlossen. Die Ergebnisse müssen daher in diesem Kontext gewertet werden. Für die Konsolidierungstherapie wäre vor allem ein Unterschied im Gesamtüber – leben oder zumindest ein Unterschied zwischen initialer Therapie und Therapie bei Progression klinisch bedeutend.
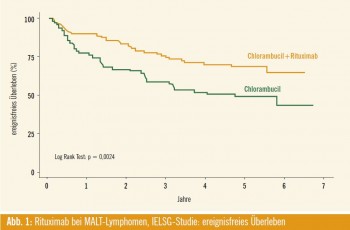
Rituximab bei MALT-Lymphomen: Die Studie 19 der italienisch-schweizerischen Arbeitsgruppe IELSG (Abstract #432) randomisierte MALT-Lymphome, welche für eine lokale Therapie nicht geeignet waren, in einem Arm mit Chlorambucil- Induktion und 4 Kursen Erhaltung gegen einen Arm mit derselben Chemotherapie kombiniert mit Rituximab- Induktion und 4 Kursen Erhaltung alle 4 Wochen. Ein 3. Arm mit Rituximab- Monotherapie wurde später be – antragt, darüber gibt es noch keine Informationen. Wiederum war das EFS signifikant besser im Rituximab-Arm, allerdings gab es noch keinen Unter – schied im Gesamtüberleben nach 5 Jahren (Abb. 1).
Aggressive Lymphome
Das primäre ZNS-Lymphom ist eine sehr aggressive Erkrankung. Therapiekombinationen mit Strahlentherapie sind vor allem bei älteren Patienten durch eine hohe Rate an Neurotoxizität kompliziert, wodurch es zu schweren Beeinträchtigungen kommt. Zu diesem Thema brachte die CALGB-Studie 50202 einen Beitrag (Abstract #763). Es wurden 47 Patienten mit einem medianen Alter von 60 Jahren mit einer Induktionstherapie mit Methotrexat 9 g/m2, Rituximab und Temozolomid über 20 Wochen behandelt. Bei 63 % kam es dadurch zu einer kompletten Remission. Diese Patienten erhielten danach eine Konsolidierungstherapie mit hochdosiertem Cytosin-Arabinosid und Etoposid. Das progressionsfreie Intervall nach 3 Jahren betrug 50 %, das Überleben 67 %. Nur 7 Patienten brauchten eine Salvage-Bestrahlung.
Kommentar: Diese Studie zeigt, dass eine ZNS-Bestrahlung beim primären ZNS-Lymphom kein essenzieller Therapiebestandteil ist und durch Weglassen dieser Option Neurotoxizität vermieden werden kann.
Die französische GELA-Gruppe präsentierte eine randomisierte Studie (LNH03- 2B, Abstract #102). 380 unbehandelte Patienten zwischen 18 und 59 Jahren mit einem negativen Prognosefaktor im Internationalen Prognose-Index (IPI) wurden in 2 Therapiearme randomisiert: In die Standardtherapie mit 8-mal R-CHOP (Cyclophosphamid, Doxorubicin, Vincristin und Prednisolon) und in einen dosisdichten Arm nach dem R-ACVBP-Schema (Rituximab, Doxorubicin, Cyclophosphamid, Vindesin, Bleomycin, Prednison als Induktion; hochdosiertes Methotrexat, Etoposid, Ifosfamid, hochdosiertes Cytosin- Arabinosid als Konsolidierung). Es wurde ein signifikanter Unterschied im ereignisfreien Überleben (EFS) nach 3 Jahren gefunden (67 vs. 81 %). In Anbetracht des Alters und des IPI erscheint das EFS im R-CHOP-Arm mit 67 % allerdings ungewöhnlich niedrig.
Erhaltung mit Rituximab: Ein Update der Intergroup-Studie E4494/C9793 (Abstract #589) nach 9 Jahren zeigte weiterhin keinen Überlebensgewinn für eine Rituximab-Erhaltung bei diffus großzelligem B-Zell-Lymphom, weder nach CHOP- noch nach R-CHOP-Induktion.
Konsolidierung mit Tositumomab: Die SWOG präsentierte 2 Studien: Die Studie S-0433 (Abstract #590) untersucht die Wertigkeit einer Konsolidierungstherapie nach 6-mal R-CHOP gefolgt von 2- mal CHOP mit einer einmaligen Therapie mit 131Iodine-Tositumomab. Das progressionsfreie Überleben nach einem Jahr unterschied sich nicht vom progressionsfreien Überleben, das man ohne Konsolidierung erwarten würde. Interventionen nach der Induktion dürften für die Hochrisikopatienten mit diffus großzelligem B-Zell-Lymphom zu spät kommen.
R-CHOP + Bevacizumab: Die zweite SWOG-Studie, S-0515 (Abstract #591), kombinierte R-CHOP mit Bevacizumab. Die autokrine Gefäßstimulation wird als wichtiger Mechanismus für aggressive Lymphome angesehen. Überraschend war die ungewöhnlich hohe Komplikationsrate dieser Kombination mit 2 therapiebedingten Todesfällen, Darmperforationen, Myokardinfarkten und Thrombosen. Es bleibt zu hoffen, dass andere Möglichkeiten zur Hemmung der Angioneogenese erfolgreicher sein werden.
R-mini-CHOP verwendete die GELA in ihrer Studie LNH03-7B (Abstract #853) bei Patienten im Alter >80 Jahren mit diffus großzelligem B-Zell-Lymphom. Bei diesem schwierig zu behandelnden Patientenkollektiv konnte die Toxizität durch eine Halbierung der CHOP-Dosis verringert werden. Trotzdem kam es immer noch zu 6,7 % toxischen Todes – fällen. Das ereignisfreie Überleben nach 2 Jahren war mit 44,8 % beachtlich.
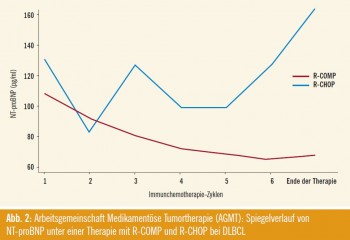
Die österreichische Arbeitsgemeinschaft Medikamentöse Tumortherapie (AGMT) präsentierte eine randomisierte Studie bei unbehandelten diffus großzelligen BZell- Lymphomen, bei denen R-CHOP verglichen wurde mit R-COMP (Abstract #1766). In Letzterem wurde Doxorubicin durch liposomales Doxorubicin ersetzt. Bezüglich Remissionsraten scheint es zwischen beiden Therapien keinen Unterschied zu geben. Das primäre Studienziel, die kardiale Toxizität, wurde durch das liposomale Doxorubicin verringert (Abb. 2).
Das Europäische Mantelzell-Lymphom- Netzwerk präsentierte eine randomisierte Studie bei unbehandelten Mantelzell- Lymphomen. Die Therapie bestand aus 6-mal R-CHOP gefolgt von hoch dosiertem Cyclophosphamid, Ganzkörperbestrahlung und autologer Stammzelltransplantation vs. 3-mal R-CHOP gefolgt von 3-mal R-DHAP (Rituximab, hoch dosiertes Cytosin-Arabinosid, Etoposid, Cisplatin, Methylprednisolon) gefolgt von hoch dosiertem Melphalan, Cytosin-Arabinosid, Ganzkörperbestrahlung und autologer Stammzelltranspantation (Abstract #110). 391 Patienten im Alter unter 65 Jahren wurden randomisiert. Die Rate der kompletten Remissionen nach der Induktionstherapie war im R-CHOP-Arm beträchtlich niedriger (41 % vs. 60 %). Dieser Unterschied glich sich nach der Hochdosistherapie aber wieder aus. Nach einer medianen Beobachtungszeit von 30 Monaten war die mediane Remissionsdauer im Arm mit hoch dosiertem Cytosin-Arabinosid signifikant besser (40 Monate vs. nicht erreicht). Durch eine elegante MRD-Analyse konnte die Wertigkeit von hoch dosiertem Cytosin- Arabinosid besser gezeigt werden als durch das klinische Ansprechen alleine (Abstract #965).
Hodgkin-Lymphom
Die deutsche Hodgkin-Lymphom-Gruppe präsentierte die Studien HD-14 und HD-15.
Die Studie HD-14 (Abstract #765) unter – suchte bei Patienten mit intermediärem Risiko 4-mal ABVD (Doxorubicin, Vinblas – tin, Bleomycin, Dacarbazin) vs. 2-mal BEACOPP (Bleomycin, Etoposid, Doxorubicin, Cyclophosphamid, Vincristin, Procarbazin, Prednisolon) gefolgt von 2-mal ABVD. 1655 Patienten in den Stadien I oder II mit Risikofaktoren wurden randomisiert.
Ergebnisse/Kommentar: Durch die intensivierte Therapie ist das „Freedom From Treatment Failure“ nach 4 Jahren von 89,3 % auf 94,7 % signifikant verbessert worden. Allerdings sind die Grad- 3/4-Toxizitäten auch von 50,7 % auf 87,1 % angestiegen. Die Studie war zwar zur Erkennung eines Unterschieds im Gesamtüberleben nicht ausgelegt – und es wurde auch kein solcher Unterschied gefunden. In Anbetracht der höheren Toxizität muss man sich fragen, ob die 5 % höhere Zahl an Therapieversagern nicht durch eine Salvage-Therapie gerettet werden kann, ohne alle Patienten der höheren Toxizität von BEACOPP auszusetzen.
Die Studie HD-15 untersuchte die Wertigkeit des 18FDG-PET in der Therapieplanung fortgeschrittener Hodgkin-Lymphome (Abstract #764). 728 Patienten aus dieser Studie hatten nach 6–8-mal eskaliertem BEACOPP eine Teilremission mit einem Restherd von mehr als 24 mm. Alle im PET noch speichernden Lymphome wurden bestrahlt. 74,8 % der Patienten speicherten im PET nicht und hatten keine weitere Therapie. Trotz Bestrahlung PET-positiver Patienten war deren Time To Progression nach 3 Jahren 86,1 % gegenüber 92,1 % bei PETnegativen Patienten. In der PET-negativen Gruppe wurden 8 Patienten außerhalb des Protokolls bestrahlt. Von den 23 Rezidiven waren 8 ausschließlich im initial befallenen Areal lokalisiert, 6 waren außerhalb des initial befallenen Areals lokalisiert (und weiter 9 Rezidive sowohl als auch). PET-negative Restlymphome müssen nicht bestahlt werden, zumindest nicht nach 6-mal BEACOPP eskaliert.