Hot am ESMO: Selektion aus den Presidential−Symposien
ESMO 2018, Presidential Symposien – der Gesamteindruck ist, dass die erste Welle der Monotherapiestudien mit Immun-Checkpoint-Inhibitoren vorbei ist und zunehmend Kombinationstherapien, sei es mit zielgerichteter oder mit Chemotherapie, zum Zug kommen.
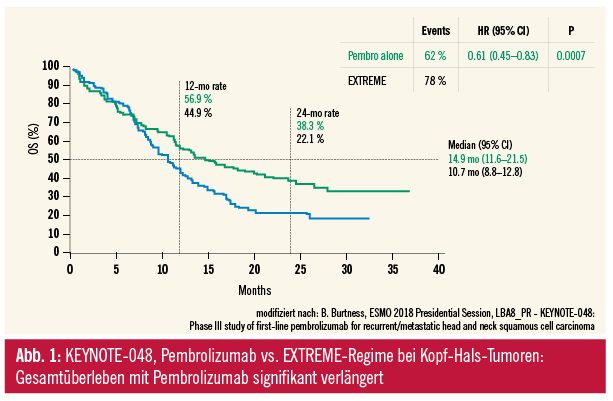
KEYNOTE-048: Pembrolizumab bei Kopf-Hals-Tumoren
Dass Immuntherapie bei Kopf-Hals-Tumoren wirkt, zeigen die bereits erfolgten Zulassungen von Pembrolizumab und Nivolumab als Second-Line-Therapie für fortgeschrittene Tumoren. Aktuell wurde in einem ESMO-Presidential-Symposium die zweite Interimsanalyse der Studie KEYNOTE-048 präsentiert, die Pembrolizumab, Pembrolizumab plus Chemotherapie vs. Chemotherapie plus Cetuximab (Regime der EXTREME-Studie) nunmehr als Erstlinientherapie für rezidivierte/metastasierte Plattenepithelkarzinome im HNO-Bereich (Oropharynx, Mundhöhle, Hypopharynx oder Larynx) untersucht. Pembrolizumab 200 mg (q3w) konnte über bis zu 35 Zyklen verabreicht werden. PD-L1-Expression war ein Stratifikationskriterium; unterschieden wurde in biomarkerangereicherte Subgruppen mit einem kombinierten Immunoscore (CPS) von ≥ 1 oder ≥ 20. Im Ergebnis konnte der primäre Studienendpunkt Gesamtüberleben mit Pembrolizumab als Monotherapie gegenüber dem EXTREME-Schema in beiden Immunoscore-Strata signifikant verlängert werden; in der CPS≥20-Population: 14,9 vs. 10,7 Monate (HR 0,61; p = 0,0007), was als klinisch relevant festgehalten wurde. Die Ansprechraten waren zwar mit Immuntherapie geringer, eindrucksvoll war aber die Ansprechdauer, die in beiden Immunoscore-Strata über 20 Monate betrug – gegenüber etwa 4 Monaten mit dem EXTREME-Schema. Das EXTREME-Schema hatte erwartungsgemäß mehr Nebenwirkungen als die Monotherapie mit Pembrolizumab. Im Arm mit Pembrolizumab + Chemotherapie konnte das Gesamtüberleben ebenfalls signifikant verbessert werden (bei fehlendem PFS- oder ORR-Benefit).
ESMO-Diskussion: Mit diesen Daten wurde Pembrolizumab – als Monotherapie und kombiniert mit Chemotherapie – in der ESMO-Conclusion als ein neuer Erstlinientherapiestandard für Patienten mit PD-L1-exprimierenden Plattenepithelkarzinomen im HNO-Bereich vorgeschlagen. Bei stabilen Patienten mit hohem CPS-Immunoscore könnte eine Monotherapie mit Pembrolizumab ausreichend sein. Umgekehrt könnte sich bei stabilen Patienten mit geringerem CPS-Immunoscore oder bei Patienten mit hohem Tumordruck die Kombination aus Pembrolizumab plus Chemotherapie als bevorzugte Option herausstellen.
JAVELIN Renal 101: Avelumab + Axitinib beim Nierenzellkarzinom
JAVELIN Renal 101 ist eine Phase-III-Studie mit dem PD-L1-Inhibitor Avelumab (zugelassen beim Merkelzellkarzinom) in Kombination mit dem VEGFR-Tyrosinkinasehemmer Axitinib, der beim Nierenzellkarzinom bereits als Second-Line-Therapie zugelassen ist. Der Vergleichsarm dieser Studie mit insgesamt 886 Patienten mit klarzelligem Nierenzellkarzinom war Sunitinib. Primäre Studienendpunkte waren das progressionsfreie und das Gesamtüberleben bei PD-L1-positiven Patienten (63 % der Gesamtpopulation, n = 560). Im Ergebnis zeigte sich ein signifikant längeres progressionsfreies Überleben im kombinierten Immuntherapiearm: 13,8 vs. 7,2 Monate (HR 0,61; p < 0,0001) – Gleiches gilt auch für die Gesamtpopulation (sekundärer Endpunkt), auch hier war das PFS signifikant besser. Zusätzlich waren die Ansprechraten in der PD-L1-positiven Gruppe gegenüber Sunitinib mehr als doppelt so hoch, 55 % vs. 26 % (mit vergleichbaren Ergebnissen auch in der Gesamtpopulation). Das Ansprechen war zum Zeitpunkt der Auswertung bei 73 % der Patienten in der PD-L1-positiven Gruppe anhaltend. Das Gesamtüberleben war in beiden Armen noch nicht erreicht, scheint aber laut ersten Meldungen ebenfalls signifikant verbessert. Insgesamt war die Wirksamkeit der Therapie unabhängig von der PD-L1-Expression und der MSKCC-Risikogruppe.
ESMO-Conclusion: Die Ergebnisse der JAVELIN-Renal-101-Studie mit Avelumab plus Axitinib waren so überzeugend und wurden ohne substanzielle Erhöhung der Toxizität erzielt, dass die Kombination aus Immun- und zielgerichteter Therapie als ein neuer Erstlinientherapiestandard bei Patienten mit Nierenzellkarzinom vorgeschlagen wurde. Der Kombination wurde von der FDA bereits eine Breakthrough-Designation zugesprochen, die insgesamt zweite für Avelumab.