Immun-Checkpoint-Inhibitor-assoziierte Kardiotoxizität
Der Wirkmechanismus der sogenannten Checkpoint-Inhibitoren (immune checkpoint inhibitors, ICIs) beruht auf einer Aktivierung der T-Zell-mediierten Immunantwort gegen Tumorzellen. Die zu erwartenden Nebenwirkungen stellen daher überschießende Immunreaktionen dar, die gut dokumentiert und meist auch gut behandelbar sind. Deutlich seltener treten kardiotoxische Nebenwirkungen wie Peri- und Myokarditiden auf, aber auch systolische Dysfunktion, atrioventrikuläre (AV)-Blockierungen und ventrikuläre Arrhythmien sind beschrieben. Diese kardialen Nebenwirkungen können jedoch schwerwiegende, lebensbedrohliche Komplikationen darstellen.
ICI-Therapie und Herz
ICIs sind monoklonale Antikörper und blockieren inhibitorische Rezeptoren, die auf T-Zellen exprimiert werden, wie „cytotoxic T-lymphocyte associated protein-4“ (CTLA-4) und „programmed cell death protein-1“ (PD-1) oder deren korrespondierende Liganden auf Tumorzellen wie den „programmed cell death 1 ligand-1“ (PD-L1). Die monoklonalen Antikörper gegen CTLA-4 (Ipilimumab), PD-L1 (Atezolizumab, Avelumab oder Durvalumab) und PD-1 (Nivolumab oder Pembrolizumab) führen so zu T-Zell-mediierter Immunantwort gegen Tumorzellen. Diese gesteigerte Immunantwort führt zu einer Reihe von Autoimmunreaktionen, wobei die häufigsten Nebenwirkungen gastrointestinale Erkrankungen wie Diarrhoe und Kolitis sowie erhöhte Leberenzyme sind.
Kardiotoxische Effekte von ICIs sind noch nicht lange bekannt, erst mit der Veröffentlichung von zwei Fällen von fulminanter Myokarditis nach Verabreichung einer kombinierten ICI-Therapie erlangte diese Nebenwirkung 2016 große Aufmerksamkeit.1 In einer Metaanalyse von 2017, die 22 Studien zu anti-PD-1 und anti-PD-L1 untersuchte, lag die Inzidenz von Herzkreislaufstillstand bei 1 %, von Herzinsuffizienz bei 2 %, von Myokardinfarkt bei 1 % und von Insult bei 2 %.2 In einer Abfrage der Arzneimittel-Sicherheitsdatenbank der Firma Bristol-Myers Squibb (Hersteller von Ipilimumab und Nivolumab) fanden sich 18 Fälle von Myokarditis bei über 20.000 mit ICIs behandelten Patienten (0,09 %), wobei die Inzidenz deutlich höher war, wenn Patienten eine Kombinationstherapie aus beiden Antikörpern erhielten. Insgesamt dürfte die Inzidenz von kardiovaskulären toxischen Nebenwirkungen seit den ersten publizierten Fällen jedenfalls steigen. Gründe hierfür sind vermehrte Kombinationstherapien mit zwei ICIs, Kombinationen mit anderen kardiotoxischen Substanzen (z. B. VEGF-Inhibitoren, Anthrazyklinen oder Strahlentherapie), laufend neue Indikationen und Zulassungen von ICIs, genauere und häufigere kardiale Verlaufsuntersuchungen und die steigende Awareness der behandelnden Ärzte.
Der zugrundeliegende Pathomechanismus, der zu einer ICI-mediierten Myokarditis führt, ist bisher noch nicht ganz geklärt. Histologische Untersuchungen konnten eine massive Anreicherung von CD4- und CD8-positiven T-Zellen und Makrophagen begleitet von extrazellulärer Matrixablagerung im Herzmuskel zeigen, was eine On-target-Toxizität nahelegt. Bei der Sequenzierung von T-Zellrezeptoren in Herzmuskel, Skelettmuskel und Tumor konnten ähnliche Klone von T-Zellen nachgewiesen werden, was ein gemeinsames Epitop nahelegen würde.1
Klinische Präsentation der ICI-assoziierten Kardiotoxizität
Die klinische Manifestation der ICI-assoziierten Myokarditis ist sehr variabel und reicht von unspezifischen Symptomen wie Müdigkeit, Thoraxschmerzen und Dyspnoe, die fälschlicherweise als Symptome der onkologischen Grunderkrankung missinterpretiert werden können, bis hin zu Arrhythmien, akuter Herzinsuffizienz und plötzlichem Herztod. Oft betrifft der inflammatorische Prozess auch das Perikard und tritt dann als Perimyokarditis mit Perikarderguss auf. Hinweisend auf eine begleitende Perikarditis sind ein neu aufgetretener Perikard- erguss und im EKG PR-Senkungen bzw. diffuse ST-Streckenhebungen mit J-Punkt-Erhöhung. Als Komplikation kann es zu atrialen oder ventrikulären Arrhythmien bzw. einer Perikardtamponade kommen.
Auch Überleitungsstörungen wie AV-Blöcke oder Sinus-Bradykardien können im Rahmen einer ICI-assoziierten Myokarditis auftreten. Myokardinfarkte wurden nach Einnahme von Atezolizumab ebenfalls beschrieben. Es ist noch unklar, ob die beschriebenen Troponin-Erhöhungen auf atherosklerotische Plaqueruptur, ICI-getriggerte koronare Vaskulitis oder missinterpretierte fokale Myokarditis zurückzuführen sind. Es ist aber durchaus denkbar, dass aktivierte Inflammation durch ICIs bei vorbestehenden athero-sklerotisch veränderten Koronargefäßen zu Plaqueruptur und akuter Koronarthrombose führen kann.
Eine Beeinträchtigung der systolischen Funktion nach ICI-Therapie ist eine relativ häufige Nebenwirkung. Meist kommt es aber nur zu einer leichten, transienten Einschränkung der systolischen Linksventrikelfunktion. Präklinische Studien konnten zeigen, dass es durch T-Zell-Aktivierung zu einer Progression vorbestehender kardialer Erkrankungen kommen kann, was Dekompensationen bei zuvor subklinischer Herzinsuffizienz erklären könnte.3 Außerdem kommt es wahrscheinlich durch eine gesteigerte systemische Immunantwort (u. a. durch TNF-a) zur Progression einer vorbestehenden Herzinsuffizienz.
Die Diagnostik der ICI-assoziierten Myokarditis beruht im Wesentlichen auf den Diagnoserichtlinien zu Myokarditis anderer Genese.4 Zur definitiven Diagnose „ICI-assoziierte Myokarditis“ ist neben Enzymdiagnostik (Troponin- und CK-Erhöhung), kardialer Bildgebung (Echokardiographie, kardiales MRI), 18F-Fluorodeoxyglukose PET/CT und evtl. Myokardbiopsie v. a. auch eine besondere Aufmerksamkeit der betreuenden Ärzte erforderlich.
Typischerweise treten kardiale Nebenwirkungen schon sehr früh nach ICI-Verabreichung auf: In einem französischen Register betrug das mediane Intervall zwischen erster Dosis und klinischen Symptomen 56 Tage (allerdings mit einer großen Bandbreite von 2–454 Tagen), was ca. drei ICI-Zyklen entspricht.5 Der WHO-Datenbank VigiBase zufolge traten 64 % der ICI-assoziierten Myokarditis-Fälle nach der ersten oder zweiten ICI-Dosis auf und sogar 76 % innerhalb der ersten sechs Therapiewochen.6 Die Ergebnisse dieser Studien lassen vermuten, dass prädisponierende Faktoren bzw. klinische Risikofaktoren für die frühe Manifestation der kardiotoxischen Nebenwirkungen mitverantwortlich sind. So war z. B. das NT-proBNP bei all jenen Patienten dieser Studien erhöht, bei denen es zum Auftreten von kardialen Nebenwirkungen kam. Erhöhte Troponin-Werte dürften nach derzeitigem Stand mit einem erhöhten Risiko für inflam-matorische Nebenwirkungen assoziiert sein, nicht aber mit anderen nicht-inflammatorischen Effekten.
Vorgehen beim Auftreten von kardiotoxischen Nebenwirkungen
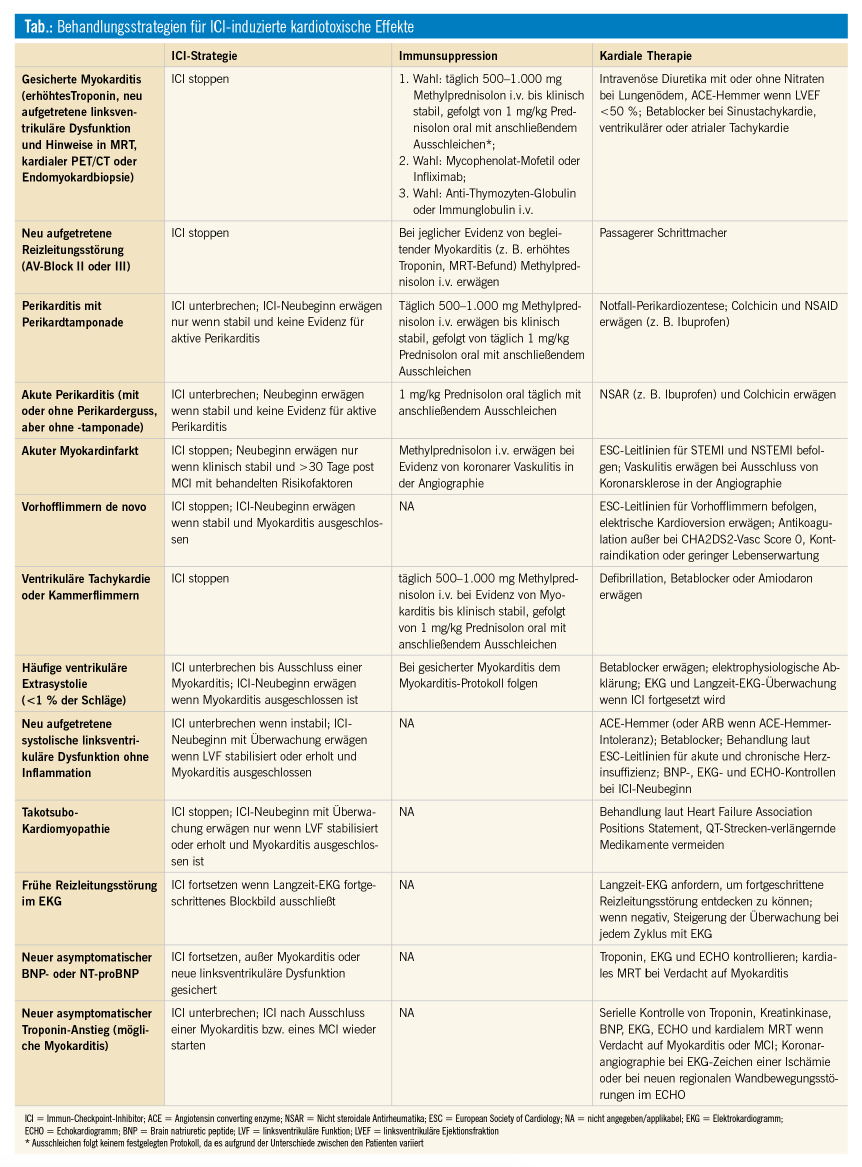
Die derzeit empfohlene Therapie basiert auf den Empfehlungen der American Society of Clinical Oncology (ASCO)7 bzw. der National Comprehensive Cancer Network (NCCN)8 Gruppe. Die erste Maßnahme ist meist die Beendigung der ICI-Therapie, wobei hier eine gemeinsame Entscheidung durch Onkologen und Kardiologen getroffen werden soll. Außerdem soll eine konventionelle Therapie der aufgetretenen Herzerkrankung je nach klinischer Manifestation durchgeführt werden. Eine EKG-Überwachung von Patienten mit Thoraxschmerzen, erhöhten Herzenzymen, klinischen Zeichen von Herzinsuffizienz oder Arrhythmien ist auf jeden Fall indiziert. Eine weitere Behandlungsstrategie besteht in der Verabreichung von Kortikosteroiden, die Dosierung richtet sich hierbei nach der Intensität der Symptomatik. Bei Versagen der Steroidtherapie kommen weitere Immunsuppressiva zum Einsatz (Tab.).
Es gibt bisher keine Empfehlungen, wie ICI-assoziierte kardiotoxische Nebenwirkungen verhindert bzw. überwacht werden können. Vorgeschlagen werden derzeit die Durchführung von EKG und Echokardiographie bzw. die Bestimmung von Brain natriuretic peptide (BNP) und Troponin zu Beginn der Therapie und eine Wiederholung dieser Untersuchungen vor dem zweiten und vierten Zyklus.
Resümee
Aufgrund der relativ geringen Inzidenz ICI-assoziierter Nebenwirkungen sind neben prospektiven klinischen Studien auch internationale, multi-institutionelle Bestrebungen notwendig, um Prävalenz und Manifestationen weltweit zu erfassen und die Definitionen zu harmonisieren. Nur durch standardisiertes Management und Monitoring-Richtlinien können diese oft lebensbedrohlichen Nebenwirkungen behandelt bzw. vermieden werden.