Immunonkologische Ansätze beim Ovarialkarzinom
Einleitung
Aufgrund der nach wie vor schlechten Prognose mit hohen Rezidivraten nach aggressiver Primäroperation und Kombinationschemotherapie wurde und wird eine sehr hohe Erwartung in den Einsatz von Immunonkologika beim Ovarialkarzinom gesetzt. Leider dürfte das epitheliale Ovarialkarzinom eher zu der Gruppe der immunologisch „kalten“ Tumoren zählen. Dementsprechend zeigten die bisher durchgeführten Mono-Checkpointinhibitor-Studien nur sehr limitierte Ansprechraten bei Patientinnen mit Ovarialkarzinom. Die Kombination mit antiangiogenetischen Substanzen oder auch PARP-Inhibitoren dürfte diese Ansprechraten deutlich erhöhen.
Checkpointinhibitoren – Mono- und Kombinationstherapien
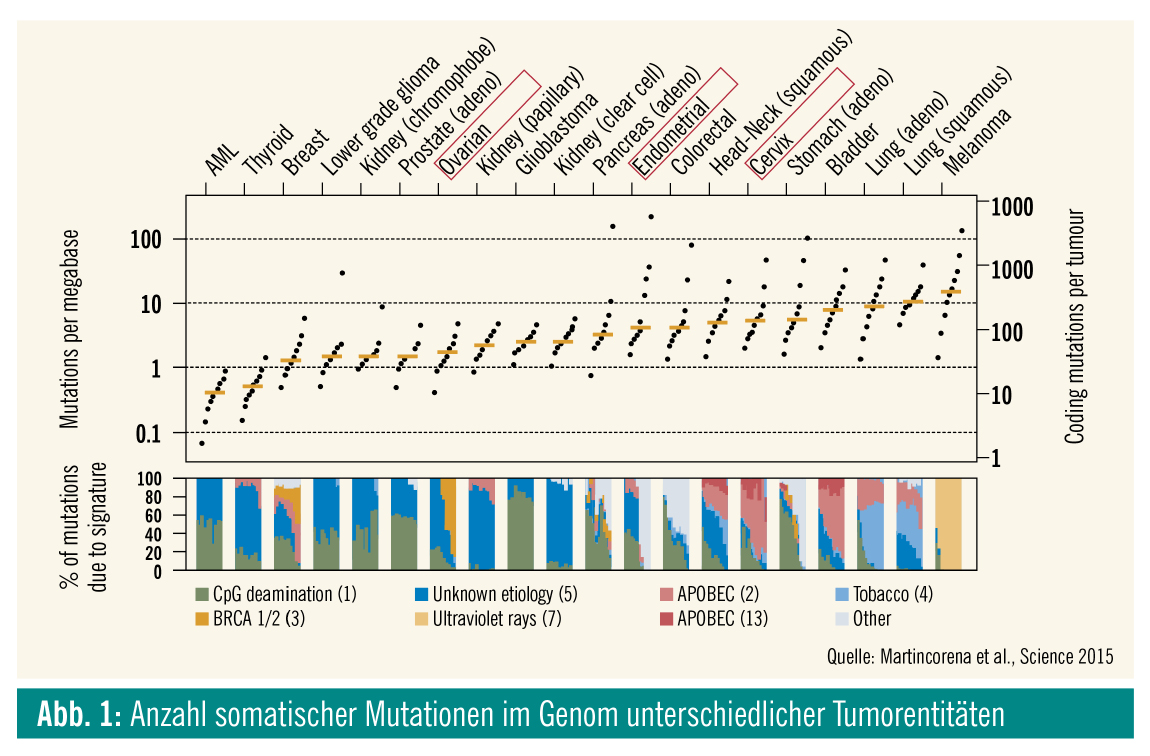
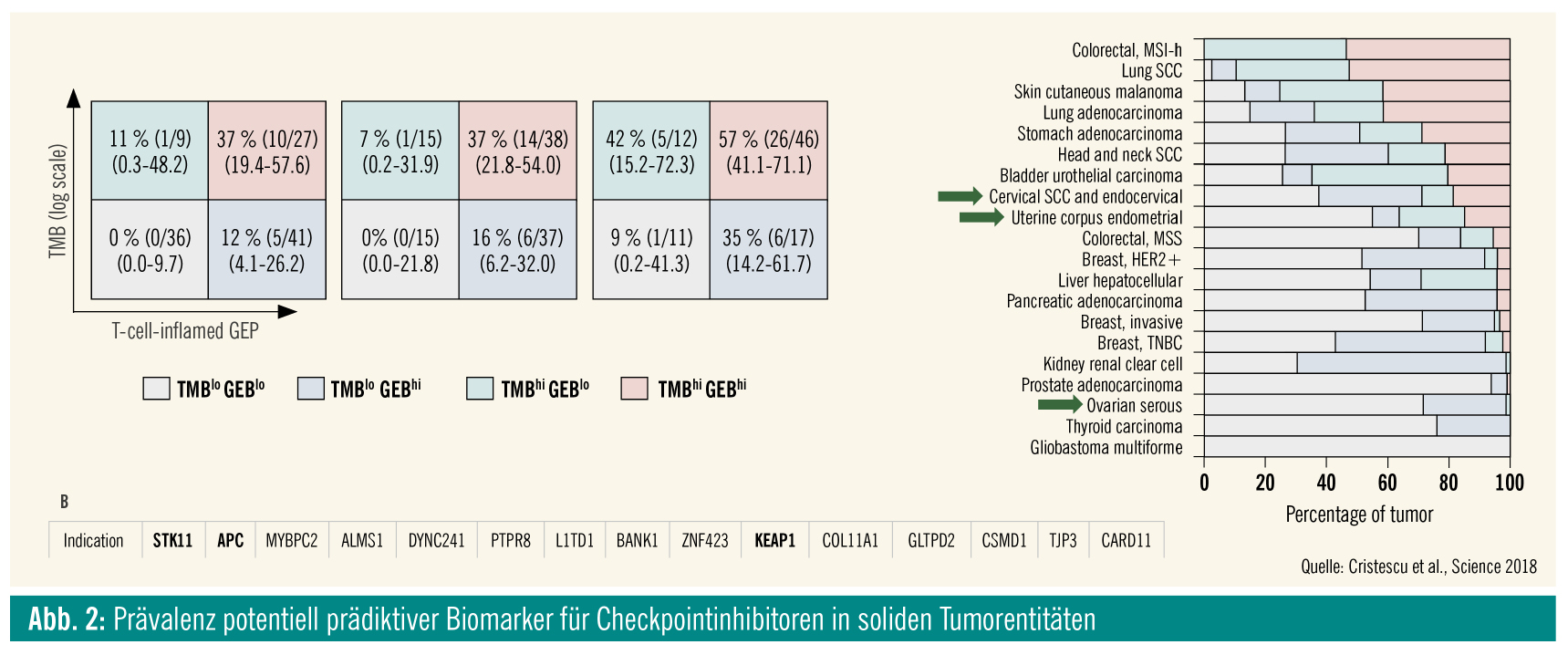
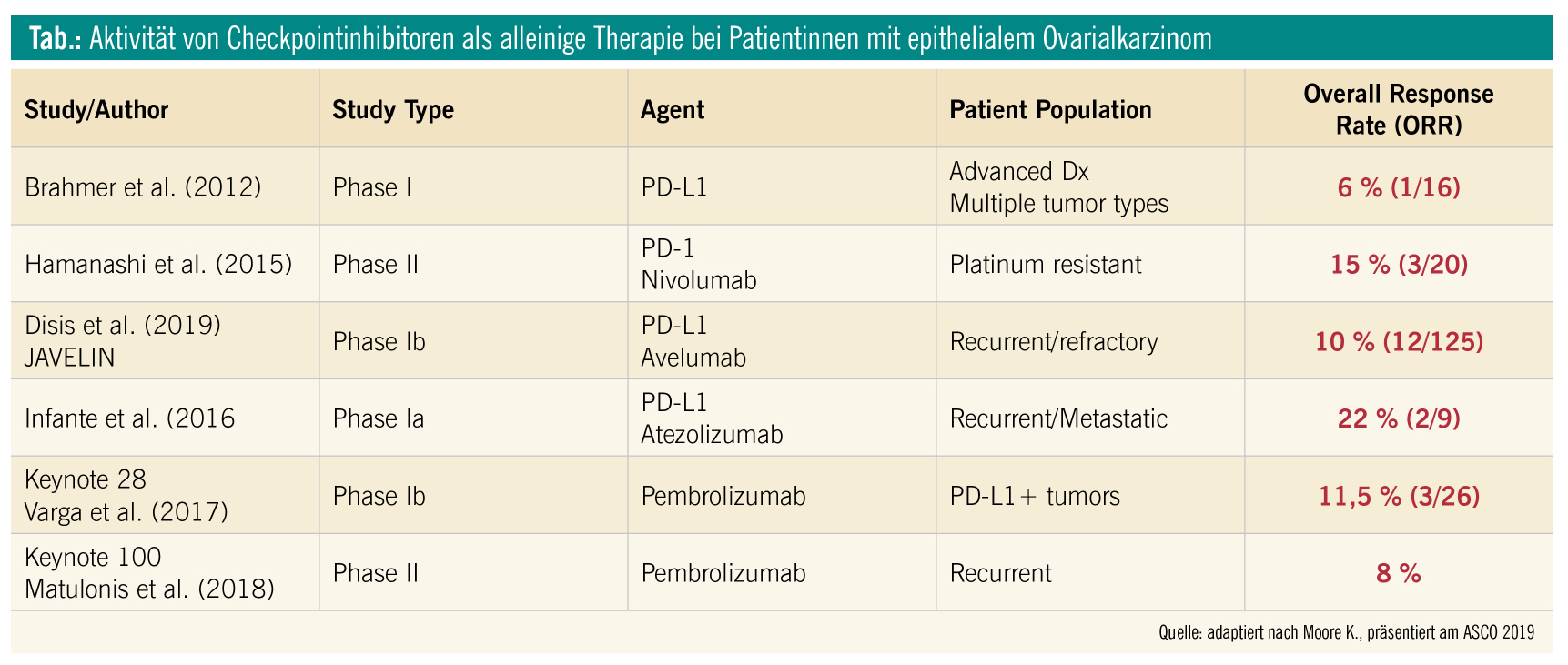
In den letzten Jahren zeigte sich, dass das epitheliale Ovarialkarzinom (EOC) eher zu den immunologisch „kalten“ Tumoren zählen dürfte. Dies zeigt sich in der Tatsache, dass das EOC eine sehr niedrige Mutationsfrequenz im Vergleich zu den meisten anderen soliden Tumoren aufweist (Abb. 1). Darüber hinaus zeigte sich auch in weiteren Untersuchungen mit anderen potentiell prädiktiven Biomarkern, dass das EOC für eine Mono-Checkpointinhibitor-Therapie eher wenig empfänglich sein dürfte (Abb. 2). Dies bestätigte sich auch in den bisherigen klinischen Phase-I- und -II-Studien. Eine Übersicht über die bislang durchgeführten kleineren Monotherapie-Studien zeigt Ansprechraten von 6–22 % (Tab.). Die mit Abstand größte PD-1/PD-L1-Inhibitor-Studie beim Ovarialkarzinom ist die KEYNOTE-100-Studie, in die insgesamt 376 Patientinnen mit rezidiviertem EOC eingeschlossen sind, die mit Pembrolizumab therapiert wurden. Dabei zeigte sich ein relativ moderates Ansprechen: eine Gruppe mit einem „combined positive score“ (CPS) < 1: objektive Ansprechrate (ORR) 5 % (95 % KI = 2–10); CPS > 1: ORR 10,2 % (95 % KI = 6,3–15,2) und CPS > 10: 17,1 % (95 % KI = 9,7–27,0).
Daher wird der Schwerpunkt im Bereich der PD-1/PD-L1-Inhibitoren auf den Einsatz von Kombinationstherapien gesetzt: Die Rationale für die Kombination von PD-1/PDL-1-Inhibitoren mit PARP-Inhibitoren liegt in der Tatsache, dass PARP-Inhibitoren die Anzahl an Tumor-Neoantigenen erhöhen und darüber hinaus über den STING-Pathway zu einer Aktivierung des Immunsystems führen und die Infiltration des Tumorgewebes mit aktiven T-Zellen erhöhen. Dieses Konzept konnte in einer Phase-II-Studie (TOPACIO-Studie: Niraparib + Pembrolizumab) mit 62 Patientinnen mit rezidiviertem EOC bestätigt werden. Dabei zeigten sich eine ORR von 35 % und eine Krankheitskontrollrate von 67 %. Leider konnte in dieser Studie kein prädiktiver Biomarker (weder BRCA-Status noch HRD-Status oder PD-L1-Status) für das Therapieansprechen identifiziert werden. Noch größer war der klinische Benefit in einer Studie (MEDIOLA-Studie: Olaparib + Durvalumab), in die 32 Patientinnen mit rezidiviertem EOC und BRCA-Mutation eingeschlossen wurden. Die ORR lag in dieser teilweise sehr stark vorbehandelten Gruppe sogar bei 72 %. Die Triple-Therapie PD-1/PD-L1-Inhibitor, PARP-Inhibitor und antiangiogenetische Substanz wird derzeit in zwei Phase-III-Studien in der Primärtherapie (DUO-O-Studie: Olaparib + Durvalumab + Bevacizumab und FIRST-Studie: Niraparib + TSR-042 + Bevacizumab) und einer Phase-II-Studie im Rezidivsetting (OPAL-Studie: Niraparib + TSR-042 + Bevacizumab) untersucht. Derzeit liegen noch keine Daten zur Wirksamkeit dieser Substanzen vor.
Weitere immunonkologische Ansätze
Im Bereich der chimeren Antigenrezeptoren (CAR) T-Zellen gibt es bislang einige Phase-I-Studien beim EOC. Bei den sehr kleinen Fallzahlen zeigt sich bislang definitiv ein „proof of concept“ mit teilweise sehr hohen Ansprechraten. Dennoch liegen bislang noch keine Daten von Phase-II-Studien in diesem Bereich vor. In dem Bereich der T-Zellrezeptor (TCR) T-Zellen gibt es ebenfalls nur einige Phase-I-Studien, wobei die Wirksamkeitsraten unter jenen der CAR-T-Zell-Studien liegen und insbesondere das Nebenwirkungsprofil mit febriler Neutropenie und relativ hohen „cytokine release syndrome“ (CRS)-Raten eher ungünstig erscheint. Diverse Vakzinstudien zeigen bislang „proof of concept“, jedoch mit sehr heterogenen Ansprechraten von 10–66 %. Limitierend sind hier natürlich die kleinen Fallzahlen, die zwischen 8 und 20 Patientinnen pro Studie liegen.
Resümee
Mono-Checkpointinhibitor-Studien zeigten bislang unbefriedigend niedrige Ansprechraten bei Patientinnen mit Ovarialkarzinom. Die Kombination mit antiangiogenetischen Substanzen bzw. PARP-Inhibitoren dürfte die Wirksamkeit der Checkpointinhibitoren deutlich erhöhen. Derzeit laufende Phase-III-Studien evaluieren daher ausschließlich Kombinationsansätze im Rahmen von Dual-Therapien (PARP-Inhibitor + PD-1/PD-L1-Inhibitor) bzw. Triple-Therapien (PARP-Inhibitor + Antiangiogenese + PD-1/PD-L1-Inhibitor). Alle anderen IO-Ansätze befinden sich beim Ovarialkarzinom noch in sehr frühen Entwicklungsstadien und werden kurzfristig keinen Eingang in die klinische Praxis finden.