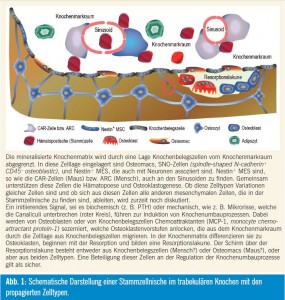
Knochen und Stammzelle
Als erste Stufe der Differenzierung mesenchymaler Stammzellen werden Osteochondroprogenitorzellen angenommen. Diese Zellen differenzieren einerseits in Osteoblasten und andererseits in die Chondroblastenlinie, welche in Prächondrozyten, proliferierende und prähypertrophe Chondroblasten eingeteilt werden. Diese Reihe endet schließlich mit hypertrophen Chondroblasten, die letztlich in Apoptose gehen. Diese Zellen sind für die Bildung des Säulenknorpels verantwortlich und bilden als häufigste Proteine Kollagen II, Kollagen X sowie Osteokalzin. Die beiden letzteren Gene findet man vor allem in hypertrophen Chondroblasten. Die Expression von Osteokalzin, eines osteoblastenspezifisches Gens, ist unter anderem ein Grund, warum für beide Linien eine gemeinsame Vorstufe angenommen wird. Nach der Apoptose wird dieser Bereich mineralisiert, der interessanterweise einen höheren Mineralgehalt als der Knochen aufweist. Später wird der mineralisierte Knorpel resorbiert und in Knochen umgebaut. Dafür wird von manchen Autoren die Mitwirkung von Chondroklasten angenommen.
Osteochondroprogenitorzellen differenzieren aber auch in Osteoblasten, die in Präosteoblasten, synthetisierende (proliferierende) und reife Osteoblasten eingeteilt werden. Letztere differenzieren in der Folge entweder in Osteozyten, die im Knochen eingemauert werden, oder in Knochenbelegszellen (lining cells), welche die Trabekeloberfläche bilden und somit das Knochenmark vom mineralisierten Knochen trennen. Jedem dieser Zelltypen wird bei der Knochenbildung eine definierte Funktion zugeordnet. Während in der Vergangenheit die Auffassung vorherrschte, dass die Zellen dieses Differenzierungsschema durchlaufen müssen, um schließlich ein Osteozyt oder eine Knochenbelegszelle zu werden, wird neuerdings angenommen, dass sich Osteoblasten mit spezifischen Funktionen ausbilden, die ineinander übergehen können, d. h. eine Knochenbelegszelle kann wieder in einen synthetisierenden Osteoblasten differenzieren. Zusätzlich zu den proliferierenden Präosteoblasten, die sich vermehren und mittels Kollagen I und zahlreicher anderer Proteinen die Knochenmatrix aufbauen, wird auch ein mineralisierender Osteoblast benötigt, der in die gebildete Knochenmatrix die Einlagerung von Hydroxyapatit steuert. So kann man davon ausgehen, dass nach der Synthese von Knochenmatrix die Produktion von matrixbildenden Proteinen (u. a. Typ-I-Kollagen) zurückgenommen wird und Gene, die für die Mineralisierung notwendig sind, angeschaltet werden.
Osteozyten entwickeln sich, wie bereits erwähnt, aus Osteoblasten. Während in der Vergangenheit die Meinung vorherrschte, dass die Osteozyten mehr oder weniger wahllos in die Knochenmatrix eingemauert werden, dürfte auch das, wie in biologischen Systemen üblich, ein koordinierter Prozess sein.
Während der Bildung der Knochenmatrix durch Osteoblasten differenzieren diese zu Osteozyten, die in der Knochenmatrix zurückbleiben. Mithilfe von Proteasen (MMP14) wird ein enges Netzwerk von Kanälen (Canaliculi) ausgebildet. Dieses Netzwerk verbindet sowohl die einzelnen Osteozyten untereinander als auch mit den Knochenbelegszellen1. Diese Kanäle werden durch Proteinkomplexe (GAPJunctions, Connexine) gebildet, welche die zytoplasmatischen Kompartimente der verschiedenen Zellen miteinander verbinden. So ermöglicht dieses Netzwerk eine intensive Kommunikation der Zellen untereinander, um einerseits regulatorische Aufgaben wahrzunehmen, die den gesamten Knochenmetabolismus betreffen, dient aber vielmehr auch der Sensorik. Dabei wird die Wahrnehmung mechanischer Einflüsse und (Zer-)Störungen der Struktur des Knochens, durch Änderungen der Druckverteilung oder von Strömungen der Flüssigkeit in den Canaliculi an die Knochenbelegszellen durch dieses System weitergegeben, die dann entweder Resorption oder Neuanbau von Knochenmatrix einleiten. Störungen des Kanalsystems durch Mikrorisse oder apoptotische Osteozyten können so erkannt und in der Folge kann ein Umbau dieses Knochenareals eingeleitet werden. Dass Osteozyten an der Mineralisierung des Knochens beteiligt sind, gilt mittlerweile als gesichert2.
Während der letzten Jahre wurde die Bedeutung der Osteozyten für die Regulierung des gesamten Knochenmetabolismus immer besser definiert. Wie bereits erwähnt, wurden dem Osteozyten als eine seiner ersten Funktionen die Übertragung mechanischer Einflüsse auf den Knochenmetabolismus zugeordnet; dabei ist zu beachten, dass der Knochenumbau in Richtung der Krafteinflüsse, die auf den Knochen einwirken, voranschreitet. Das bedeutet, dass beide, Osteoklasten und Osteoblasten, am rechten Ort zur rechten Zeit aktiviert werden müssen. Osteozyten reagieren wesentlich sensitiver auf Mikroströmungen in den Canaliculi mit Änderungen der intrazellulären Ca2+-Ionen-Konzentrationen und scheinen so für die komplexe Regulation der Osteoblasten und Knochenbelegszellen verantwortlich zu sein. Als „Transmittersubstanzen“ der beiden Zelltypen sind vor allem das Stickoxyd NO und Prostaglandine (wieder) im Gespräch. Dabei dürften die beiden lokalen Faktoren das RANK-RANKL-OPGSystem deutlich beeinflussen. RANKL (TNFSF11, tumor necrosis factor (ligand) superfamily, member 11) interagiert mit RANK (TNFRSF11A, tumor necrosis factor receptor superfamily, member 11a), der an der Oberfläche der reifen Osteoklasten und dessen Vor läufer – zellen gefunden wird und die Differenzierung und Funktion dieser Zellen regu liert. OPG (Osteoprotegerin, TNFRSF11B), das vornehmlich von Osteoblasten synthetisiert wird, kann diese Interaktion unterbinden und verhindert damit letztlich die Knochenresorption. In einer rezenten Studie werden die Osteozyten als eigentliche Quelle von RANKL beschrieben, welche damit die Regulation der Osteoklastendifferenzierung und deren Funktion übernehmen und dadurch die Knochenresorption steuern3.
Interessanterweise kann den Osteozyten auch eine endokrine Funktion zugeschrieben werden: Sie erzeugen den
fibroblastenähnlichen Wachstumsfaktor 23 (FGF23), der in den Parathyreoidea die Synthese des Parathormons unterdrückt und in der Niere die Rückresorption von Phosphat hemmt. Bei machen Tumoren oder bei angeborenen Enzymdefekten kommt es zu erhöhten FGF23- Spiegeln im Blut, die zu verringertem Serumphosphat führen und damit zu einer hypophosphatämischen Osteomalazie. Auch eine Unterdrückung der Vitamin-DHydroxylierung in der Niere durch FGF23 wird diskutiert4.
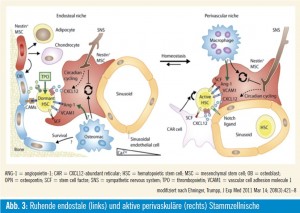
Knochenbelegszellen (bone lining cells) sind an der Oberfläche der mineralisierten Matrix zu finden und grenzen den Knochen zum Knochenmarkraum bzw. zur Stammzellnische ab. Ebenso wie Osteozyten werden auch die Knochenbelegszellen als fortgeschrittener Differenzierungszustand der Osteoblasten betrachtet. Knochenbelegszellen werden durch Mikrorisse im Knochen, wahrscheinlich via Osteozyten, aktiviert und differenzieren in synthetisierende Osteoblasten, die neue Knochenmatrix produzieren. Anschließend gehen diese Zellen wieder in einen ruhenden Zustand, d. h. sie werden wieder Knochenbelegszellen, oder sie wandern in die Knochenmatrix ein und werden zu Osteozyten5. Der größte Teil geht aber, wie bereits erwähnt, in Apoptose. Neben diesen Knochenbelegszellen werden noch andere Zelltypen in der Stammzellnische beschrieben, die sich von mesenchymalen Stammzellen ableiten. Eingelagert in die Schicht aus Knochenbelegszellen sind SNO (spindle-shaped N-cadherin+ CD45). Nestin+-mesenchymale Stammzellen werden aber auch an den Gefäßen gefunden, die das Knochenmark versorgen. Diese Zellen, perivaskuläre Nestin+- mesenchymale Stammzellen, ähneln den CAR-Zellen (CXCL12-abundant reticular). Diese Zellen synthetisieren CXCL12 (chemokine C-X-C motif ligand 12), KITLG (KIT ligand oder stem cell factor, SCF), ANGPT1 (Angiopoetin-1, Ang-1), IL7 (Interleukin-7), VCAM1 (vascular cell adhesion molecule 1) und Osteopontin (SPP1, secreted phosphoprotein 1), in bedeutenden Mengen6.
Diese CAR-Zellen, welche in der Maus beschreiben wurden, entsprechen mit großer Wahrscheinlichkeit den ARC (adventitial reticular cells) im Menschen. Diese Zellen unterstützen einerseits die Hämatopoese, differenzieren aber andererseits nach Aktivierung in Osteoblas – tenvorstufen. Parathormon stimuliert die Proliferation dieser Zellen und induziert auch deren Differenzierung zu Osteo – blastenvorstufen. Gleichzeitig wird aber auch die Anzahl hämatopoetischer Stammzellen erhöht. Diese Zellen sind auch mit adrenergen Nerven des sympathischen Nervensystems assoziiert, das deren Mobilisierung reguliert und für deren zirkadiane Schwankungen verantwortlich ist.
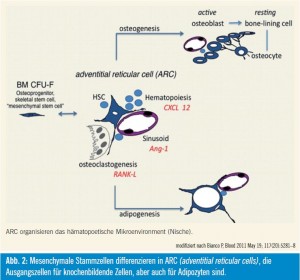 Diese CAR-Zellen bzw. ARC unterstützen aber nicht nur die Hämatopoese und sind osteogene Vorläuferzellen, sondern können auch in Adipozyten differenzieren. Fortschreitendes ektopisches Akkumulieren von Fettzellen im Knochenmark dürfte in einer altersbedingten Dysfunktion der Hämatopoese begründet sein. Ablation der Hämatopoese geht mit einer Umwandlung von rotem Knochenmark in gelbes einher. Obwohl dieser Prozess im Prinzip reversibel ist, wird für die altersbedingte Bildung von Adipozyten eine Dysdifferenzierung diskutiert, die nicht mehr reversibel ist. Damit hätte das alternde Knochenmark eine verminderte Fähigkeit zur Blutbildung und zur Knochenneubildung7, 8.
Diese CAR-Zellen bzw. ARC unterstützen aber nicht nur die Hämatopoese und sind osteogene Vorläuferzellen, sondern können auch in Adipozyten differenzieren. Fortschreitendes ektopisches Akkumulieren von Fettzellen im Knochenmark dürfte in einer altersbedingten Dysfunktion der Hämatopoese begründet sein. Ablation der Hämatopoese geht mit einer Umwandlung von rotem Knochenmark in gelbes einher. Obwohl dieser Prozess im Prinzip reversibel ist, wird für die altersbedingte Bildung von Adipozyten eine Dysdifferenzierung diskutiert, die nicht mehr reversibel ist. Damit hätte das alternde Knochenmark eine verminderte Fähigkeit zur Blutbildung und zur Knochenneubildung7, 8.
Osteoklasten, die hämatopoetischen Ursprungs sind, sind für den Knochenabbau verantwortlich. Sie differenzieren aus frühen myeloischen Vorläuferzellen, die wiederum in der endostealen Nische in Osteoklastenvorläuferzellen (Präosteoklasten) differenzieren. Präosteoklasten, die Rezeptoren, wie z. B. CSF1R (colony stimulating factor 1 receptor) für CSF1 (macrophage colony-stimulating factor 1) und RANK für RANK-Ligand tragen, sind möglicherweise jene Zellen, welche als knochenspezifische Makrophagen, Osteomacs, bezeichnet werden. Rezente Untersuchungen ordnen Osteomacs eine bedeutende Funktion bei der Erhaltung reifer Osteoblasten zu9. CSF1 und RANK sowie andere Faktoren, die von mesenchymalen Zellen erzeugt werden, steuern die weitere Differenzierung dieser Vorstufen in aktive Osteoklasten.
Für diesen Prozess dürfte eine Interaktion mit Osteoblasten notwendig sein. Es wird angenommen, dass Präosteoklasten die Schicht aus Knochenbelegszellen durchwandern und darunter, nach Differenzierung zu aktiven Osteoklasten, mit der Resorption beginnen. Die Hypothese wird auch dadurch unterstützt, dass Osteozyten neuerdings als wesentliche RANKL-Quelle gesehen werden. Die so entstandenen Zellen synthetisieren TRAP (ACP5; acid phosphatase 5, tartrate resistant) und werden daher auch als TRAP-positive mononukleäre Zellen bezeichnet. Als nächster Schritt erfolgt eine – durch RANKL regulierte – Fusion der Präosteoklasten in reife Osteoklasten, multinukleäre Zellen, die nach Aktivierung Knochen resorbieren. Ähnlich wie beim Osteoblasten können je nach Funktion – oder, besser: Fehlfunktion – verschiedene Zelltypen definiert werden. Als Beispiel mögen die Osteoklasten einer Form von Osteopetrose dienen, bei der eine Untereinheit der Protonenpumpe (TCIRG1) fehlt oder mutiert ist, oder auch die Pyknodysostose (Toulouse-Lautrec), die durch Mutationen des Cathepsin- K-Gens (CTSK-Gens) charakterisiert ist. Osteoklasten, die nach Aktivierung eine „sealing zone“ bilden, die zur Abgrenzung des sauren Milieus innerhalb der Zelle dient, um einerseits das Kollagen zu hydrolysieren bzw. das Knochenmineral zu lösen, können im ersten Fall das saure Milieu nicht erzeugen, und eine große Anzahl schlecht resorbierender Osteoklasten ist die Folge. Im zweiten Fall kommt es aufgrund fehlender Proteolyse zu stark vermindertem Kollagenabbau mit einer normalen Anzahl schlecht resorbierender Osteoklasten10.
Während in der Vergangenheit sehr bald erkannt wurde, dass die mesenchymalen Zellen des Knochenmarkstromas die Hämatopoese unterstützen, ist die unterstützende Funktion hämatopoetischer Stammzellen für die Bildung der Knochenzelle Resultat rezenter Untersuchungen. Auch wenn man mittlerweile die wesentlichen Komponenten und deren Wechselwirkungen untereinander zu erkennen beginnt, ist noch viel Forschungsarbeit notwendig, um die Vorgänge in der Stammzellnische bei der Hämatopoese und der Knochenbildung, aber auch der Entstehung und Persistenz von malignen Erkrankungen zu verstehen.
FACT-BOX
• Die Stammzellen, sowohl für die Knochenneubildung als auch für die Resorption, befinden sich in der Stammzellnische des trabekulären Knochens.
• Mesenchymale Stammzellen differenzieren in CAR-Zellen (CXCL12-abundant reticular) bzw. ARC (adventitial reticular cells), die wiederum Ausgangszellen für knochen – bildende Zellen, aber auch für Adipozyten sind.
• Osteoblasten sind für die Knochenmatrixsynthese und die Mineralisierung des Knochens verantwortlich, während die Osteozyten und Knochenbelegszellen den Knochenanbau und -abbau regulieren.
• Hämatopoetische Stammzellen differenzieren über Präosteoklasten in multinukleäre Osteoklasten, die für den Knochenabbau verantwortlich sind. Hämatopoetischen Ursprungs sind auch die Osteomacs (osteale Gewebsmakrophagen), die an der Steuerung des Knochenumbaus beteiligt sein dürften.
• Zellen mesenchymalen und hämatopoetischen Ursprungs interagieren und regulieren den Knochenmetabolismus und die Hämatopoese.
1 Holmbeck K et al., The metalloproteinase MT1-MMP is required for normal development and maintenance of osteocyte processes in bone. J Cell Sci 2005 Jan 1; 11:147–56
2 Bonewald LF, The amazing osteocyte. J Bone Miner Res 2011 Feb; 26(2):229–38
3 Nakashima T et al., Evidence for osteocyte regulation of bone homeostasis through RANKL expression. Nat Med. [Research Support, Non-U.S. Gov’t] 2011 Oct; 17(10):1231–4.
4 Neve A et al., Osteocytes: Central Conductors of Bone Biology in Normal and Pathological Conditions. Acta Physiol (Oxf). 2011 Nov 20
5 Landry P et al., Apoptosis is coordinately regulated with osteoblast formation during bone healing. Tissue Cell 1997 Aug; 29(4):413–9
6 Nagasawa T et al., Control of hematopoietic stem cells by the bone marrow stromal niche: the role of reticular cells. Trends Immunol 2011 Apr 29
7 Ehninger A, Trumpp A, The bone marrow stem cell niche grows up: mesenchymal stem cells and macrophages move in. J Exp Med 2011 Mar 14; 208(3):421–8
8 Bianco P, Bone and the hematopoietic niche: a tale of two stem cells. Blood 2011 May 19; 117(20):5281–8
9 Raggatt LJ et al., Cellular and molecular mechanisms of bone remodeling. J Biol Chem 2010 Aug 13; 285(33):25103–8
10 Henriksen K et al., Osteoclast activity and subtypes as a function of physiology and pathology – implications for future treatments of osteoporosis. Endocr Rev 2011 Feb; 32(1):31–63