Kurative und palliative interventionelle Therapien
Lokalablative, kurative Behandlungsmöglichkeiten
Unter Tumorablation versteht man die Zerstörung von Tumorgewebe mithilfe unterschiedlicher Verfahren, die lokal appliziert werden und direkt auf das Tumorgewebe wirken. Im Rahmen der interventionell- radiologischen Therapien erfolgt dabei die perkutane Positionierung der therapeutischen Sonden mithilfe verschiedener Bildgebungsmodalitäten, wie Ultraschall, Computertomographie oder auch Magnetresonanztomographie. In den letzten 25 Jahren wurden viele verschiedene thermische und chemische Ablationsverfahren entwickelt. Neueste Entwicklungen, die sich derzeit in klinischer Erprobung befinden, verwenden nichtthermische und nichtchemische Ablationsmethoden.
Perkutane Alkohol-Instillation (PEI)
Die perkutane Alkohol-Instillation (PEI, Percutaneous Ethanol Injection) ist eine günstige und weit verbreitete Methode, bei der zwischen 2 und 20 ml 95%-Alkohol über eine Nadel in das HCC eingebracht werden. Dies führt einerseits durch Dehydrierung des Zytoplasmas und Proteindenaturierung zu einer Koagulationsnekrose, andererseits durch Nekrose des vaskulären Endothels mit anschließender Thrombose zu einer ischämischen Nekrose. Da der Tumor, im Gegensatz zur umgebenden zirrhotischen Leber eine relativ weiche Konsistenz aufweist und teilweise auch eine Kapsel besitzt, verteilt sich der Alkohol relativ gut innerhalb der Läsion, wobei intratumorale Septen, welche insbesondere bei größeren Tumoren häufig sind, die homogene intratumorale Alkoholausbreitung behindern. Typischerweise sind daher zumindest 2–3 Behandlungen pro Läsion notwendig. Weiters entgehen auch peritumorale Mikrometastasen („Satellitenläsionen“) der PEI-Behandlung, da der Alkohol großteils auf den Tumor beschränkt bleibt. Bei kleinen HCC-Herden bis 2 cm Durchmesser ist die PEI mit Nekroseraten von 90–100 % eine effektive Behandlungsmethode1. Allerdings fällt die Nekroserate auf ca. 70 % bei Tumoren mit 2–3 cm Größe und auf 50 % bei Läsionen mit 3–5 cm Durchmesser1. Obwohl keine prospektiven randomisierten Studien vorliegen, welche die PEI mit symptomatischer Behandlung oder Resektion vergleichen, zeigen mehrere retrospektive Studien die Effizienz der Behandlungsmethode, da Child-Pugh- A-Patienten mit HCC, die mittels PEI behandelt werden, 5-Jahres-Überlebensraten von ca. 50 % erreichen1, 2. Dabei stellt die PEI mit Mortalitätstraten von weniger als 1 % und Moribiditätsraten von etwa 10 % eine sichere und minimalinvasive Behandlungsform dar, die üblicherweise in Sedo-Analgesie und örtlicher Betäubung durchgeführt werden kann.
Radiofrequenzablation (RFA)
Die Radiofrequenzablation (RFA) ist die derzeit am häufigsten eingesetzte interventionelle Ablationsmethode. Dabei wird das (Tumor-)Gewebe um die Elektrodenspitze durch Anlage von hochfrequentem (100–500 kHz) Wechselstrom primär durch die Bewegung der Ionen erhitzt („Joule-Effekt“). Eine Temperatur von mehr als 50° C über eine Dauer von mehr als 5 Minuten wird allgemein als ausreichend betrachtet, um eine Koagulationsnekrose im Gewebe zu induzieren. Falls die Temperatur um die Nadelspitze jedoch zu hoch wird (> 100°), kommt es zu einer Karbonisation des Gewebes durch Wasserverdampfung. Dadurch wird die elektrische Leitfähigkeit eingeschränkt, was zu einer deutlich verminderten Erhitzung des Gewebes führt. Derzeit sind ein Reihe unterschiedlicher RFA-Systeme am Markt erhältlich, wobei die Unterschiede hauptsächlich im Durchmesser (zwischen 13 und 17 Gauge [= 2,3–1,4 mm]) und der Konfiguration der Sonden liegen, wobei jedes System spezifische Vor- und Nachteile aufweist. Um eine möglichst große Ablationszone zu erreichen, haben manche Sonden zum Beispiel ausfahrbare Zinken, andere wiederum gekühlte Spitzen (Abb. 1). Der kleinere Durchmesser der typischerweise eiförmigen Ablationszone liegt dabei ungefähr zwischen 2,5 und 4 cm. Um größere Ablationszonen zu erzielen, kann die Sonde umpositioniert werden oder es können mehrere Sonden gleichzeitig verwendet werden. Die Größe der Ablationszone ist allerdings auch von anderen, nicht vorhersagbaren Faktoren, wie z. B. der primären Höhe des elektrischen Widerstandes, abhängig. Weiters kommt es in der Nähe von größeren Gefäßen zu einer Kühlung des Gewebes durch den Blutfluss, was die Wahrscheinlichkeit einer inkompletten Nekrose in diesen Arealen deutlich erhöht („heat sink effect“).
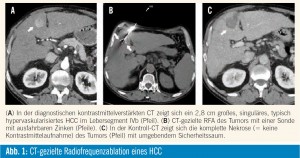 Das Ziel jeder RFA ist es, den gesamten Tumor sowie einen 0,5–1 cm breiten Saum an umgebendem gesunden Gewebe („safety margin“) zu ablieren, um mit Sicherheit sämtliche periphere Tumoranteile und auch etwaige peritumorale Mikrometastasen zu eradizieren, was die Lokalrezidivrate signifikant verringert (2,6 % vs. 20 % bei einer durchschnittlichen Tumorgröße von 2,3 ± 0,9 cm in 181 Patienten)3. Weiters ist bekannt, dass die Lokalrezidivrate auch mit der Mortalität korreliert, sodass das Erreichen eines „safety margins“ wahrscheinlich auch zu einer niedrigeren Mortalität führt3. Um eine niedrige Lokalrezidivrate zu erreichen, ist somit ein erfahrener interventioneller Radiologe sowie ein intrainterventionelles Monitoring der Ablationszone empfehlenswert, da somit etwaige inkomplette Ablationen noch in derselben Sitzung behandelt werden können. Da die RFA Temperaturen von bis zu 100° C induziert und somit periinterventionell äußerst schmerzhaft ist, sollte die Intervention immer in tiefer Sedo- Analgesie oder Intubationsnarkose durchgeführt werden. Mit einer Mortalität von 0,3–0,5 % und einer Komplikationsrate (major + minor complications) von 7,1–9 % ist die RFA eine sichere Methode3. Die Lokalisation des HCC ist dabei für eine sichere RFA ein entscheidender Faktor, da die Hitzeentwicklung auch umgebende Strukturen verletzen kann. Eine Nahbeziehung des Tumors zur Gallenblase, dem Herz, dem Magen, dem Darm und insbesondere zu den zentralen Gallenwegen gilt daher als eine relative Kontraindikation. Durch Anwendung der Hydro- oder Pneumodissektion, bei denen über eine Nadel 5 % Glukose oder Luft zwischen die Leber und umgebende Strukturen (v. a. Darm) eingebracht werden, werden diese suffizient vor thermischen Schäden geschützt. Mit dieser Technik lassen sich die Indikationen für eine RFA deutlich ausdehnen3. Postinterventionelles leichtes Fieber und/oder grippeähnliche Symptome werden als Post-Ablations-Syndrom bezeichnet. Dies ist bei ungefähr drei Viertel aller Patienten zu erwarten, wobei die Ausprägung von der Größe und Lokalisation der Ablationszone abhängig ist. Die Symptome sind typischerweise am 3. postinterventionellen Tag am stärksten ausgeprägt und klingen von selbst nach spätestens 10 Tagen vollständig ab.
Das Ziel jeder RFA ist es, den gesamten Tumor sowie einen 0,5–1 cm breiten Saum an umgebendem gesunden Gewebe („safety margin“) zu ablieren, um mit Sicherheit sämtliche periphere Tumoranteile und auch etwaige peritumorale Mikrometastasen zu eradizieren, was die Lokalrezidivrate signifikant verringert (2,6 % vs. 20 % bei einer durchschnittlichen Tumorgröße von 2,3 ± 0,9 cm in 181 Patienten)3. Weiters ist bekannt, dass die Lokalrezidivrate auch mit der Mortalität korreliert, sodass das Erreichen eines „safety margins“ wahrscheinlich auch zu einer niedrigeren Mortalität führt3. Um eine niedrige Lokalrezidivrate zu erreichen, ist somit ein erfahrener interventioneller Radiologe sowie ein intrainterventionelles Monitoring der Ablationszone empfehlenswert, da somit etwaige inkomplette Ablationen noch in derselben Sitzung behandelt werden können. Da die RFA Temperaturen von bis zu 100° C induziert und somit periinterventionell äußerst schmerzhaft ist, sollte die Intervention immer in tiefer Sedo- Analgesie oder Intubationsnarkose durchgeführt werden. Mit einer Mortalität von 0,3–0,5 % und einer Komplikationsrate (major + minor complications) von 7,1–9 % ist die RFA eine sichere Methode3. Die Lokalisation des HCC ist dabei für eine sichere RFA ein entscheidender Faktor, da die Hitzeentwicklung auch umgebende Strukturen verletzen kann. Eine Nahbeziehung des Tumors zur Gallenblase, dem Herz, dem Magen, dem Darm und insbesondere zu den zentralen Gallenwegen gilt daher als eine relative Kontraindikation. Durch Anwendung der Hydro- oder Pneumodissektion, bei denen über eine Nadel 5 % Glukose oder Luft zwischen die Leber und umgebende Strukturen (v. a. Darm) eingebracht werden, werden diese suffizient vor thermischen Schäden geschützt. Mit dieser Technik lassen sich die Indikationen für eine RFA deutlich ausdehnen3. Postinterventionelles leichtes Fieber und/oder grippeähnliche Symptome werden als Post-Ablations-Syndrom bezeichnet. Dies ist bei ungefähr drei Viertel aller Patienten zu erwarten, wobei die Ausprägung von der Größe und Lokalisation der Ablationszone abhängig ist. Die Symptome sind typischerweise am 3. postinterventionellen Tag am stärksten ausgeprägt und klingen von selbst nach spätestens 10 Tagen vollständig ab.
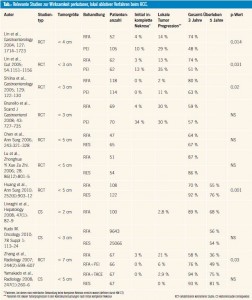
RFA versus PEI: Mehrere randomisierte Studien konnten zeigen, dass die RFA einen signifikanten Vorteil gegenüber der PEI bezüglich der Lokalrezidivrate und des Gesamtüberlebens bietet (Tab.). Somit ist die RFA als die Ablationsmethode der Wahl zu sehen. Weiters hat die RFA auch den Vorteil, dass im Vergleich zur PEI weniger Behandlungen notwendig sind, um die gewünschte Ablationszone zu erreichen. Allerdings kann die PEI im Gegensatz zur RFA auch dann eingesetzt werden kann, wenn der Tumor in Nahebeziehung zu kritischen umgebenden Strukturen wie z. B. dem Herz oder den zentralen Gallenwegen steht, da das Risiko einer iatrogenen Schädigung dieser Strukuren bei einer PEI minimal ist. Auch dem Tumor benachbarte größere Gefäße (RFA-„Heat sink effect“) beeinflussen eine PEI nicht wesentlich. Somit sind die PEI und die RFA nicht als kompetitive, sondern als komplementäre Methoden zu betrachten, die im Rahmen einer optimalen Behandlung, abhängig von Tumorlokalisation und Größe, gemeinsam eingesetzt werden sollten (Tab.).
RFA-Indikationen (Resektion versus RFA): Patienten mit „very early“ oder „early stage“ HCC entprechend dem BCLC-Staging System (= Child Pugh AB, ECOG Performance Status 0, _ 3 HCC-Herde < 3 cm oder ein HCC < 5 cm, keine Lymphknoten-oder Fernmetastasen, keine makroskopische Gefäßinvasion), bei denen eine Resektion oder Transplantation wegen Begleiterkrankungen oder erhöhtem Pfortaderdruck nicht sinnvoll ist, sollten primär mittels RFA behandelt werden. Inwieweit die RFA prinzipiell als eine äquivalente Alternative zur Resektion zu sehen ist, wird weiterhin kontroversiell diskutiert. Bisher liegen drei randomisierte kontrollierte Studien vor, welche die RFA und die Resektion miteinander vergleichen (Tab.). Zwei (methodisch angreifbare) Studien zeigten keinen signifikanten Unterschied. Die größte Studie konnte ein signifikant besseres Gesamtüberleben der resezierten Patientengruppe nachweisen, wobei in dieser Studie allerdings kein Patient aufgrund der Tumorlokalisation exkludiert wurde, was per se eine erhöhte Komplikations- und Lokalrezidiv – rate (nicht angegeben) nach RFA implementiert.
Da die Effizienz der RFA wesentlich von der Tumorgröße abhängig ist, ist die Resektion für Tumoren mit mehr als 3 cm Durchmesser derzeit allerdings mit Sicherheit weiterhin die primäre Therapiemethode. Für Tumoren mit weniger als 3 cm Durchmesser und abhängig von der Tumorlokalisation sind die beiden Modalitäten höchstwahrscheinlich ebenbürtig, was in den japanischen konsensusbasierten Leitlinien bereits auch implementiert ist3. Dies wird durch Daten aus großen retrospektiven Kohortenstudien unterstützt (Tab.) und wird derzeit in einer prospektiven japanischen Studie verifiziert (SURF Trial). Ein wesentlicher Faktor für eine erfolgreiche RFA ist vor allem auch der durchführende Interventionist, was sich anhand der deutlich unterschiedlichen Lokalrezidivraten in verschiedenen Studien (Tab.) leicht nachvollziehen lässt. Bei Tumoren mit einem Durchmesser von mehr als 3 cm kann die Effizienz der RFA durch eine vorherige Lipiodol-Chemoembolisation (TOCE) möglicherweise erhöht werden, da dadurch der Kühlungseffekt minimiert wird und Satellitenläsionen wahrscheinlich effizienter behandelt werden. Obwohl noch keine prospektiven randomisierten Studien zu dieser Fragestellung vorliegen, wird diese Technik bereits vielfach in der klinischen Praxis angewandt3.
Andere Ablationstechniken
Mikrowellenablation: Die Mikrowellenablation (MWA), bei der das Gewebe mittels Mikrowellensonden (900–2500 kHz) erhitzt wird, ist eine Ablationsmethode, die in den letzten Jahren zunehmend Beachtung findet. Sie bietet, insbesonders mit den neueren Sonden, im Vergleich zur RFA den Vorteil, dass die Nekrose schneller erreicht wird, potenziell größer ist und der „heat sink effect“ weniger ausgeprägt sein soll. Aufgrund der Datenlage kann jedoch noch nicht eindeutig beurteilt werden, inwieweit sie die RFA ablösen wird.
Laserablation: Auch bei der Laserablation wird durch Hitze, die durch Laserstrahlen induziert wird, die Gewebsnekrose erreicht. Diese Technik wird derzeit allerdings nur in sehr wenigen Zentren eingesetzt und ist durch die geringe Größe der Nekrosezone limitiert. Weiters gibt es auch die Möglichkeit der Cryoablation, bei der die Behandlung einen Eisball im Gewebe erzeugt. Aufgrund der hohen Komplikationsrate ist diese Methode bei der Behandlung von HCC jedoch nicht empfehlenswert2. Auch die Behandlung mit Essigsäure, die als Alternative zur PEI propagiert wurde, hat sich nicht durchgesetzt.
Irreversible Elektroporation, „lichtinduzierte medikamentöse Therapie“: Beachtung sollte allerdings zwei neuen, weder thermischen noch chemischen Ablationsverfahren geschenkt werden, die derzeit in ersten klinischen Studien getestet werden. Bei der irreversiblen Elektroporation (IRE) wird der Zelltod durch Anlegen einer hohen elektrischen Spannung (bis zu 3000 Volt) induziert, wodurch kein „heat sink effect“ auftritt und angeblich auch die biliäre Komplikationsrate deutlich niedriger ist. Bei der „lichtinduzierten medikamentösen Therapie“ wird durch eine in den Tumor eingebrachte lichtemittierende Sonde ein zuvor intravenös verabreichter zytotoxischer Wirkstoff (Talaporfin Sodium), der sich im Tumorgewebe anreichert, aktiviert. Dadurch soll die Wirksamkeit ebenfalls unabhängig von der Tumorlokalisation gegeben sein2.
FACT-BOX 1
• RFA ist die Ablationsmethode der Wahl.
• Kombination mit PEI kann sinnvoll sein (abhängig von Tumorlokalisation und Größe).
• Mikrowellenablation: potenzielle Alternative zur RFA.
• RFA indiziert bei: _ 3 HCC-Herde < 3 cm oder ein HCC < 5 cm, keine Lymphknoten- oder Fernmetastasen, keine makroskopische Gefäß invasion.
• RFA ist primäre Alternative zur Resektion bei HCC bis 3 cm (abhängig von Tumorlokalisation und Expertise des Zentrums).
• Bei HCC größer 3 cm kann eine vorherige Chemoembolisation die Effektivität der RFA möglicherweise verbessern, die Resektion ist, wenn möglich, vorzuziehen.
Transarterielle, palliative Behandlungsmethoden
Zur palliativen interventionellen Behandlung des fortgeschrittenen HCC steht die transarterielle Tumorembolisation zur Verfügung. Dabei werden über einen von inguinal in die tumorversorgeneden Arterien eingebrachten (Mikro-)Katheter verschiedene Wirkstoffe (Chemo- oder Radiotherapeutikum) appliziert bzw. die tumorversorgenden Gefäße embolisiert. Da HCCs im Gegensatz zum normalen Leberparenchym, das zu ca. 80 % aus der Pfortader versorgt wird, eine beinahe ausschließlich arterielle Blutversorgung aufweisen, gelangt bei arterieller Applikation der Großteil des Wirkstoffs in den Tumor, während das umgebende Leberparenchym weitgehend geschont wird. Derzeit sind viele unterschiedliche Embolisationstechniken im klinischen Einsatz: die transarterielle Embolisation (TAE, transarterial embolization), die transarterielle Chemoembolisation (cTACE, conventional transarterial chemoembolization; DEB TACE, drug eluting bead transarterial chemoembolization), die transarterielle Chemoembolisation mit Lipiodol (TOCE, transarterial oily chemoembolization) und die Radioembolisation (TARE, transarterial radioembolization; SIRT, selective internal radiotherapy). Im Folgenden sollen die wichtigsten davon beleuchtet werden.
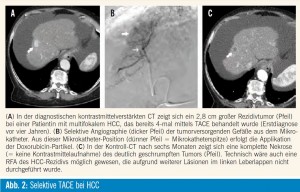
Embolisationstechnik und Risiken: Um das „normale“ Lebergewebe zu schonen und die Leberfunktion somit möglichst wenig zu beeinträchtigen, sollten möglichst nur die tumorversorgenden Gefäßäste embolisiert werden (= selektive Embolisation, Abb. 2) . Falls keine selektive Embolisation möglich ist bzw. falls bei multinodulärem HCC einzelne Tumoren angiographisch nicht abgrenzbar sind, gilt es individuell (abhängig von Leberfunktion, Tumorlokalisation und Tumoranzahl) abzuwägen, ob eine nichtselektive Embolisation sinnvoll ist oder ob einzelne Tumoren nicht besser mittels lokalablativer Verfahren behandelt werden können. Dieser Behandlungsalgorithmus wurde allerdings noch nicht durch Studien verifiziert bzw. wurde in den meisten Studien eine nichtselektive Embolisationtechnik angewandt. Weiters ist anhand der Literatur auch nicht belegt, ob ein fixer Behandlungsplan (typischerweise 3-mal TACE in den ersten drei Monaten nach Diagnose) oder ein individueller Algorithmus (TACE nur wenn vitaler [= Kontrastmittel aufnehmender] Tumor in der Bildgebung nachweisbar ist) zu einem besseren Ergebnis führen. In Zusammenschau mit der potenziellen Verschlechterung der Leberfunktion durch die TACE ist jedoch der individuelle („on demand“) Algorithmus sicherlich zu präferieren, dieser wird mittlerweile auch international mehrheitlich praktiziert.
Die publizierten Komplikationsraten nach TACE sind äußerst unterschiedlich, insgesamt jedoch nicht unbeträchtlich. Das selbstlimitierende Post-Embolisations- Syndrom, das durch leichtes Fieber und Oberbauchschmerzen für 3–4 Tage gekennzeichnet ist, tritt nach 60–80 % aller Chemoembolisationen auf4. In ca. 20 % der Patienten kommt es bei zentraler Embolisation zu einer signifikanten Verschlechterung der Leberfunktion, die in etwa 3 % der Fälle irreversibel ist. Weiters kann eine Fehlembolisation zu einer Cholezystitis, Pankreatitis oder gastroduodenalen Ulzeration mit konsekutiver oberer GI-Blutung (in ca. 3 % der Fälle) führen. In bis zu 2,8 % der Patienten (häufig assoziiert mit Diabetes mellitus) kommt es zu einer irreversiblen Verschlechterung der Nierenfunktion. Abszesse oder Biliome finden sich nach ca. 2–3 % der Behandlungen. Die Mortalitätsrate beläuft sich auf durchschnittlich 2,4 %4.
Konventionelle Chemoembolisation (cTACE), TAE und TOCE
Die Chemoembolisation wird in verschiedenen Zentren mit einer Vielzahl unterschiedlicher Zytostatika durchgeführt, wobei am häufigsten Doxorubicin verwendet wird. Daneben werden auch Cisplatin, Epirubicin, Mitomycin C, Mitoxantron und SMANC verwendet. Eine Überlegenheit eines einzelnen Chemotherapeutikums konnte in verschiedenen (auch prospektiv randomisierten) Studien bisher nicht nachgewiesen werden4. Um eine möglichst hohe lokale und möglichst geringe systemische Dosis zu erzielen, wird das Chemotherapeutikum mit LipiodolTM vermischt, das sich selektiv im HCC anreichert und einen inkompletten Gefäßverschluss auf kapillärer Ebene erzeugt. Durch die hydrophoben Eigenschaften von Lipiodol (basiert auf Mohnöl) und dem hydrophilen Charakter der Chemotherapeutika ist die Bindung jedoch instabil. Um den Embolisationseffekt zu verstärken beziehungsweise eine komplette, länger anhaltende Embolisation zu erreichen, stehen ebenfalls verschiedene Embolisationspartikel zur Verfügung (autologes Blutkoagel, PVAPolyvinylalkohol- Partikel [Contour-SE®], Gelatineschwamm [Gelfoam®], Mikrosphären [Bead-Block®], Stärkepartikel [EmboCept®]), die sich bezüglich ihrer Größe und der Dauer des Embolisationseffekts (passager versus permanent) unterscheiden. Aufgrund der Verwendung in 2 positiven randomisiert kontrollierten Studien5–6 sind Gelatineschwämme (Gelfoam ®) derzeit immer noch als Goldstandard anzusehen, wobei sich in der Praxis auch PVA-basierte Partikel als Alternative anbieten. Auch wenn die Ergebnisse aus Metaanalysen keinen eindeutigen Vorteil der TACE gegenüber der blanden Embolisation (TAE) nachweisen konnten, ist die TACE, ent sprechend den europäischen Leitlinien, trotzdem zu präferieren, da nur für sie prospektiv ein signifikanter Überlebensvorteil im Vergleich zur konservativen Behandlung nachgewiesen werden konnte4–6. Die Behandlung mittels Lipiodol-Zytostatikum ohne zusätzliche Embolisation (TOCE) ist nicht empfehlenswert.
Chemoembolisation mit beladenen Mikrosphären (DEB-TACE)
Bei der DEB-TACE („drug eluting bead“ TACE) werden mit Chemotherapeutikum beladene Mikrosphären verwendet, die seit Kurzem zur Verfügung stehen. Diese binden das Chemotherapeutikum im Vergleich zu Lipiodol deutlich besser, sodass eine deutlich geringere Doxorubicin- Menge systemisch wirksam wird. Weiters sind sie in verschiedenen Größenkategorien (100–300 μm, 300–500 μm, 500-700 μm) verfügbar, sodass durch ihre Verwendung die Chemoembolisation deutlich homogener ausfällt, was in Anbetracht der vielen praktizierten Methoden der cTACE (siehe oben) im Sinne einer besseren Vorhersagbarkeit und Vergleichbarkeit der Behandlung ein deutlicher Fortschritt ist. In einer prospektiven randomisierten Studie konnte gezeigt werden, dass die DEB-TACE mit DC
BeadsTM (= Doxorubicin-beladene Partikel) bei signifikant geringeren Doxorubicin- assoziierten Nebenwirkungen und signifikant geringerer Lebertoxizität zumindest eine gleich wirksame Tumorkontrolle wie die cTACE erzielt7. Bei fortgeschrittenen Tumoren wies sie eine signifikant bessere Ansprechrate als die cTACE auf. Weiters konnte auch die Überlegenheit der Chemoembolisation (DEB-TACE) im Vergleich zur blanden Embolisation (TAE) mit Mikrosphären hinsichtlich Tumorprogression und der Tumornekroserate in zwei anderen Studien nachgewiesen werden2. Somit wird die DEB-TACE von vielen europäischen Zentren als Chemoembolisationsmethode der Wahl angesehen. Dabei sollten bei selektiver Applikation wahrscheinlich am besten Partikel mit 100–300 μm Größe, bei zentraler Applikation (aufgrund der Gefährdung der Gallenwege) 300–500 μm große Mikrosphären verwendet werden. Dieses Behandlungsschema muss jedoch erst mittels größerer Studien verifiziert werden.
Radioembolisation
Bei der Radioembolisation oder SIRT („selective internal radiation therapy“) werden Mikrosphären (20–60 μm), die mit Yttrium 90, einem Beta-Strahler, beladen sind, intraarteriell (aus der zentralen rechten und linken A. hepatica) eingebracht. Diese reichern sich durch die intraarterielle Applikationsmethode in den HCC-Herden an und führen durch die radioaktive Strahlung und den Embolisationseffekt zur Tumornekrose. Im Vergleich zur TACE ist der Embolisationseffekt dabei jedoch geringer, was prinzipiell zu einer geringeren Schädigung des gesunden Leberparenchyms führen soll und auch den Einsatz bei Pfortaderthrombose ermöglicht. Inwieweit, beziehungsweise bei welchen Indikationen, die SIRT der TACE überlegen ist, kann zum jetzigen Zeitpunkt jedoch noch nicht beurteilt werden, da noch keine aussagekräftigen Daten vorliegen2.
TACE-Indikationen und Kontraindikationen
Nachdem unterschiedliche Ergebnisse über die Wirksamkeit der (Chemo-)Embolisation für inoperable Patienten mit HCC publiziert wurden, konnten 2 prospektive, randomisierte Studien einen eindeutigen Überlebensvorteil durch die Behandlung nachweisen5, 6. Für Patienten mit intermediärem HCC nach der BCLC-Klassifikation (Child Pugh A-B, ECOG 0, mehr als 3 Herde > 3 cm oder ein nichtoperabler Herd > 5 cm, keine Gefäßinvasion, keine Lymphknoten- oder Fernmetastasen) ist die TACE daher die Therapie der Wahl. Inwieweit, wie in den europäischen Leitlinien empfohlen, eine TACE bei Patienten mit segmentaler Pfortaderthrombose nicht indiziert ist, ist aufgrund der geringen Datenlage6 derzeit nicht eindeutig zu beantworten. Weiters wurde in einer rezenten Arbeit nachgewiesen, dass eine TACE, sofern eine selektive Embolisation des Tumors erfolgt, auch bei Pfortaderthrombose sicher durchgeführt werden kann8. Eine Studie, die mehr Aufschluss über diese Fragestellung geben wird, wurde gerade in den USA initiiert (ECOG E-1208). Auch die Festlegung der europäischen Leitlinien auf einen ECOG-Status von 0 ist zu diskutieren, da in der positiven asiatischen Studie Patienten bis ECOG-Status 4 eingeschlossen wurden und ein ECOGStatus von 1 (= Einschränkung bei körperlich schwerer Tätigkeit) als Ausschlusskriterium für die wahrscheinlich wirkungsvollste Therapieoption jedenfalls zu hinterfragen ist.
Schlussfolgerung
Die kurativen und palliativen interventionellen Therapieoptionen beim HCC bestehen aus einer Vielzahl unterschiedlicher Behandlungstechniken für eine äußerst inhomogene Patientengruppe. Die Datenlage ist bei vielen Fragestellungen dünn, da die interventionellen Behandlungen oft technisch unterschiedlich durchgeführt wurden und nur wenige prospektiv randomisierte Studien mit einer ausreichenden Anzahl an Patienten verfügbar sind. Die bestmögliche Behandlung sollte somit immer individuell, abhängig von der Tumorlokalisation, der Leberfunktion und der Expertise des Interventionisten sowie multidisziplinär festgelegt werden, wobei die Kombination der unterschiedlichen Verfahren wahrscheinlich oft Vorteile für den Patienten bietet.
FACT-BOX 2
• TACE ist die Behandlungsmethode der Wahl beim intermediären HCC nach der BCLC-Klassifikation.
• Bei segmentaler Pfortaderthrombose und ECOG-Status 1–2 ist die TACE eine Therapieoption, die individuell diskutiert werden sollte.
• Aufgrund der geringeren systemischen Nebenwirkungen, der besseren Reproduzierbarkeit und zumindest gleich guten Wirksamkeit sollte primär eine DEB-TACE („Drug eluting bead“ TACE) durchgeführt werden.
• Die Embolisation sollte möglichst selektiv erfolgen.
• Eine Re-Embolisation sollte bei bildgebend nachweisbarem vitalem Tumor erfolgen.
1 Bruix J et al., Management of hepatocellular carcinoma: an update. Hepatology 2011; 53(3):1020–1022. doi: 10.1002/hep.24199
2 Lencioni R, Loco-regional treatment of hepatocellular carcinoma. Hepatology 2010; 52(2):762–773. doi: 10.1002/hep.23725
3 Kudo M, Radiofrequency ablation for hepatocellular carcinoma: updated review in 2010. Oncology 2010; 78 Suppl 1:113–124. doi: 000315239 [pii] 10.1159/000315239
4 Marelli L et al., Transarterial therapy for hepatocellular carcinoma: which technique is more effective? A systematic review of cohort and randomized studies. Cardiovasc Intervent Radiol 2007; 30(1):6–25. doi: 10.1007/s00270-006-0062-3
5 Llovet JM et al., Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 2002; 359(9319):1734–1739. doi: S0140-6736(02)08649-X [pii] 10.1016/S0140-6736(02)08649-X
6 Lo CM et al., Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002; 35(5):1164–1171. doi: S0270913902877138 [pii] 10.1053/jhep. 2002.33156
7 Lammer J et al., Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study. Cardiovasc Intervent Radiol 2010; 33(1):41–52. doi: 10.1007/s00270-009-9711-7
8 Kothary N et al., Transarterial chemoembolization for primary hepato – cellular carcinoma in patients at high risk. J Vasc Interv Radiol 2007; 18(12):1517–1526; quiz 1527. doi: 18/12/1517 [pii] 10.1016/j.jvir.2007. 07.035