Leukämien, Lymphome, Myelome
Chronisch myeloische Leukämie
In der Hämatologie wurden die größten Therapiefortschritte in den letzten Jahren bei Patienten mit chronisch myeloischer Leukämie (CML) erzielt. Mit Hilfe der neuen Tyrosinkinase-Inhibitoren kann die Lebenserwartung von CML-Patienten nahe an jene von Normalpersonen herangeführt werden. Dies wird auch durch die Langzeitergebnisse von zwei Vergleichsstudien (24 Monate Nachbeobachtung) mit Dasatinib bzw. Nilotinib jeweils gegen Imatinib (Hochhaus A et al.) offensichtlich. Für beide Substanzen wurde eine signifikant höhere Rate an molekularen Remissionen im Vergleich zu Imatinib nachgewiesen und eine geringere Mortalitätsrate berichtet. In der BELA-Studie (Brümmendorf T et al.), in der Bosutinib mit Dasatinib verglichen wurde, konnte allerdings der primäre Studienendpunkt, definiert als höhere Rate molekularer Remissionen, nicht erreicht werden. Obwohl mittlerweile bereits 3 TKI für die Behandlung der CML zugelassen sind, steht für Patienten mit BCR-ABL-Fusionsgen und Mutation 315 allerdings noch keine wirksame Therapie zur Verfügung. Ein wesentlicher Faktor für den Therapieerfolg ist die exakte Einnahme der Therapie. Patienten, die nur zwei Dosen Imatinib pro Monat ausgelassen haben, wiesen bereits ein schlechteres Überleben im Vergleich zu Patienten auf, die voll compliant waren und Imatinib wie vorgeschrieben täglich eingenommen haben.
Erhaltungstherapie bei Mantelzell-Lymphom
Eine Studie des Europäischen Mantelzell- Netzwerks hat eine Erhaltungstherapie mit Rituximab als neuen Standard bei Patienten, die mit einer R-CHOP oder R-FC-Induktionstherapie in Remission gebracht worden waren, etabliert. Nach Erreichen der Remission wurden die Patienten entweder in einen Therapiearm mit Interferon bzw. PEG-Interferon oder mit Rituximab randomisiert. Die Erhaltungsbehandlung wurde bis zur Progression oder bis zur Intoleranz verabreicht. Durch die Immuntherapie mit Rituximab konnte das progressionsfreie Überleben im Vergleich zu IFN verdoppelt werden (51 vs. 24 Monate), bezüglich Überleben wurde allerdings nur eine tendenzielle Verbesserung erreicht (Nelemans JK et al.). Im Interferon-Arm brachen 51 % und in der Rituximab-Gruppe 30 % der Patienten die Therapie ohne Progression wegen Nebenwirkungen oder aus anderen Gründen ab.
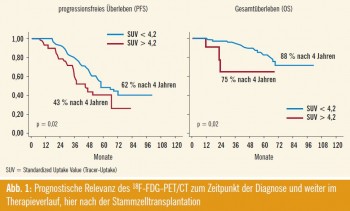
PET-CT bei multiplem Myelom
Dem Ergebnis einer PET/CT-Untersuchung zum Zeitpunkt des Therapiebeginns und nach Stammzelltransplantation kommt prognostische Bedeutung zu. Patienten, die zu Diagnosezeitpunkt ≥ 3 Läsionen im PET/CT aufwiesen oder einen besonders starken Tracer-Uptake mit einem SUV > 4,2 und/oder eine extramedulläre Manifestationen gezeigt haben, wiesen ein signifikant kürzeres progressionsfreies (PFS) und Gesamtüberleben (OS) auf. Im prospektiven Teil der Studie konnte gezeigt werden, dass ein positives PET/CT-Ergebnis nach Stammzelltransplantation mit einer kürzeren PFS und OS korreliert, während umgekehrt ein negativer PET-Befund mit einem langem PFS und OS verbunden ist (Abb. 1). Somit stellt die PET/CT-Untersuchung das erste bildgebende Verfahren dar, welchem – posttherapeutisch an – gewandt – prognostische Relevanz zukommt (Zamagni E et al.).
CD30-Antikörper-Toxin-Konjugat bei Lymphomen
Bisherige Phase-II-Studien haben eine hervorragende Wirkung von Brentuximab- Vedotin beim rezidivierten bzw. auf konventionelle Therapie refraktären M. Hodgkin gezeigt. Dieser monoklonale Antikörper gegen CD30 ist mit einem Anti- Mikrotubulus-Toxin (Monomethyl Auris – tatin E) konjugiert und bleibt auch nach Infusion in der Zirkulation stabil. Beim diesjährigen EHA-Meeting konnte nun auch bei Patienten mit rezidiviertem/refraktärem anaplastischem großzelligem Lymphom eine hohe Remissionsrate nachgewiesen werden. 86 % der Patienten erreichten eine objektive Remission. Außerdem konnte bei 14 von 15 Patienten, die auch Hautmanifestationen aufwiesen, eine komplette Rückbildung der Hautläsionen beobachtet werden. Das Antikörper-Toxin-Konjugat wird relativ gut toleriert, bei einem Teil der Patienten wurde Temperaturanstieg, Durchfall oder Obstipation beobachtet, Grad-4-Toxizi – täten wurden nicht beschrieben (Advani R et al.).
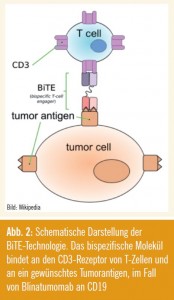
Bispezifischer CD3xCD19-Bite-Antikörper
Zu den bemerkenswerten neueren Substanzen zählt auch das bispezifische Molekül Blinatumomab, das sowohl Bindungsstellen für CD3 als auch für CD19 aufweist. Das Konzept einer dualen Bindungsfähigkeit wird auch Bite-Technologie genannt. Es handelt sich nicht um einen kompletten Antikörper, sondern um ein kleines Molekül mit kurzer Halbwertszeit, sodass die Substanz kontinuierlich infundiert werden muss, wobei in der vorliegenden Studie eine Infusionsdauer von 28 Tagen gewählt wurde. Nachdem Blinatumomab bereits in einer Phase-I-Studie eingesetzt worden war, wurde nun eine Phase-II-Studie bei 12 Patienten mit relapsierter/refraktärer BPrecursor- ALL, von denen die meisten nach einer allogenen Transplantation relapsiert sind, durchgeführt. Neun der 12 Patienten erreichten eine molekulare Remission. Dieses Ergebnis wurde bereits nach dem ersten Zyklus erzielt. Ein Patient entwickelte ein Zytokin-Release- Syndrom, und zwei weitere zeigten neurologische Veränderungen, die sich nach Unterbrechen der Therapie komplett normalisierten (Topp M et al.). Mittlerweile wird dieses Prinzip der bispezifischen Moleküle auch auf andere Targetstrukturen und damit andere maligne Erkrankungen erweitert.
Chronisch lymphatische Leukämie
Neben dem neuen bei der chronisch lymphatischen Leukämie (CLL) erfolgreich eingesetzten Antikörper Ofatumumab und mehreren in klinischer Erprobung befindlichen CD20-Antikörpern zählt das Anti-Bcl-2-Molekül Navitoclax zu einem wichtigen Hoffnungsträger bei der CLL. Navitoclax inaktiviert das bei verschiedenen B-Zell-Lymphomen überexprimierte Bcl-2, überwindet damit die Bcl-2-mediierte Blockade der Apoptose und befördert den Zelluntergang. In einer Phase-II-Studie konnte bei 33 % der Patienten mit relapsierter/refraktärer B-CLL ein Ansprechen und bei 58 % der Patienten mit nodalen Manifestationen eine zumindest 50%-Rückbildung der Lymphome erreicht werden (MacCallum P et al.). Die Substanz führte bei 2 von 5 Patienten mit der Hochrisiko-Konstellation del 17p sowie bei 3 von 6 Patienten mit del 11 zu einer partiellen Remission. Das mediane PFS lag bei fast 9 Monaten. Navitoclax scheint auch aufgrund der spezifischen Wirkmechanismen als Kombinationspartner für andere Therapien ideal geeignet. Zu den Nebenwirkungen zählen Thrombopenie, Lymphopenie und gastrointestinale Symptome. Die Thrombopenie ist als Folge des spezifischen Wirkmechanismus von Navitoclax anzusehen, das neben den Bcl-2-Proteinen auch Bcl-w blockiert. Gegenwärtig wird an der Entwicklung spezifischerer Nachfolgepräparate gearbeitet, bei denen es zu keiner Blockierung der Thrombopoese kommen soll.
BRAF-Mutationen bei Haarzell-Leukämie
Bei der Haarzell-Leukämie wurde bei allen untersuchten Patienten eine Mutation an Stelle V600E im BRAF-Onkogen nachgewiesen, während bei allen anderen untersuchten B-Zell-Lymphomen kein entsprechender Nachweis gelang. Damit eröffnet sich bei der Haarzell- Leukämie erstmals ein spezifischer Therapieansatz. Inhibitoren von BRAF werden derzeit bereits erfolgreich bei Patienten mit malignem Melanom, die eine Mutation in BRAF-Onkogen aufweisen, eingesetzt (Falini B et al.). In ersten Untersuchungen konnte nun gezeigt werden, dass diese Inhibitoren auch bei der Haarzell-Leukämie wirksam sind. Der Nachweis gelang durch Untersuchung aller kodierenden Exons, die nur ca. 1 % der genomischen DNA ausmachen. Diese Befunde weisen darauf hin, dass die Haarzell-Leukämie eine Erkrankung ist, bei der ähnlich wie bei der CML eine einzige Mutation für die maligne Transformation verantwortlich sein dürfte.
Diese und viele andere neuen Ergebnisse und Erkenntnisse machen deutlich, dass sich sowohl Grundlagen- als auch klinische Forschung im Bereich der Hämatologie in einer äußerst dynamischen Phase befinden, die zu zahlreichen neuen Erkenntnissen und Therapiemaßnahmen geführt hat und für die Zukunft weitere rasante Fortschritte erwarten lässt.