mTOR-Inhibition bei Brustkrebs – Überwindung der endokrinen Resistenz?
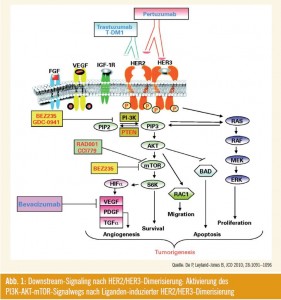
Der PI3K/AKT/mTOR-Pathway moduliert Signalantworten zwischen dem Östrogenrezeptor und der Epidermal- Growth-Factor-Rezeptor-Familie und spielt damit eine bedeutende Rolle bei der Resistenz von antihormonellen Therapien (Abb. 1). Präklinische Studien bestätigten, dass Mammakarzinomzellen mit upreguliertem AKT-Signalwegresistent gegen Hormontherapie sind. Die derzeitige Hypothese, durch präklinische und frühe klinische Studien gestützt, besteht darin, dass die Sensitivität durch eine Therapie mit mTOR-Inhibitoren wieder hergestellt werden kann. Insgesamt werden zwei Rapamycinähnliche Substanzen klinisch beim Mammakarzinom geprüft: Temsirolimus und Everolimus.
TAMRAD-Studie
Präklinische und klinische Daten 1–4 konnten zeigen, dass Everolimus als potenter mTOR-Inhibitor bei hormonresistenten Zellen signifikant wirksam ist. Eine vielversprechende Aktivität konnte in Kombination mit Letrozol bei Patientinnen mit hormonresistentem, metastasiertem Mammakarzinom gezeigt werden, und auch im neoadjuvantem Setting führte die Zugabe von Everolimus zu einer signifikanten Steigerung der Wirksamkeit von Letrozol4.
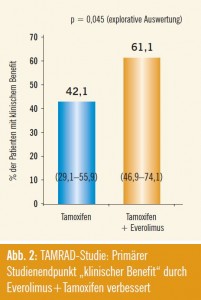
Everolimus + Tamoxifen: TAMRAD ist eine randomisierte Phase-II-Studie, die Everolimus in Kombination mit Tamo – xifen vs. Tamoxifen alleine bei Patien – tinnen mit hormonrezeptorpositivem, HER2-negativem, metastasiertem Mammakarzinom nach stattgefundener Aromatasehemmertherapie überprüft. Resultate der Studie wurden in San Antonio 2010 von Thomas Bachelot (Centre Léon- Bérard Lyon) präsentiert. Frühere randomisierte Studien zur First-Line-Therapie mit mTOR-Inhibitoren und Hormontherapie haben beim metastasierten Mammakarzinom zwar eher enttäuschende Ergebnisse erbracht, es wurde aber von der Hypothese ausgegangen, dass der PI3K/AKT/mTOR-Pathway nach vorheriger Aromatasehemmertherapie aktiviert ist. Daher wurden Patientinnen mit metastasiertem Mammakarzinom nach vorheriger (adjuvanter oder palliativer) Aromatasehemmertherapie randomisiert, in Tamoxifen als Monotherapie (n = 57) oder in die Kombination aus Tamoxifen und Everolimus (n = 54). Nach einem medianen Follow-up von 22 Monaten betrug die „Clinical Benefit“-Rate (das primäre Studienziel) 61,1 % im Tamoxifen-Everolimus-Arm und 42,1 % im Tamoxifen-Monotherapie-Arm (p = 0,045). Die mediane „Time to Progression“ war 8,6 vs. 4,5 Monate (HR: 0,53, p = 0,0026) (Abb. 2). Die Toxizität im experimentellem Arm mit Everolimus war wie erwartet hauptsächlich Fatigue, Stomatitis, Rash, Anorexie und Diarrhoe, in den meisten Fällen als Grad-1/2-Nebenwirkung. Patientinnen mit primärer Hormonresistenz hatten keinen wesentlichen Benefit durch die Zugabe von Everolimus. Jedoch scheinen Patientinnen mit initialem Ansprechen auf Aromatasehemmer und sekundärer Resistenz von der Kombination zu profitieren.5
Everolimus + Fulvestrant: In der Posterpräsentation wurden erste Beobachtungen einer Phase-II-Studie von Massarweh aus Kentucky gezeigt: „Everolimus in Kombination mit Fulvestrant beim metastasiertem Mammakarzinom“. Da erst 11 Patientinnen inkludiert sind, sind aus dieser Untersuchung noch keine endgültigen Schlüsse zu ziehen. Die Kombination aus Everolimus und Fulvestrant hat jedoch managebare Toxizitäten und erreicht eine mediane „Time to Progression“ von 8 Monaten. Die Studie ist zur Rekrutierung offen.6
Ein weiteres Poster von Zhang et al., China, zeigte in vitro, dass Everolimus effektiver gegen Mammakarzinomstammzellen wirkt als Docetaxel und die Wirkung von Docetaxel gegen Mammakarzinomstammzellen intensiviert.7 Die Autoren schließen daraus, dass die Kombination von Docetaxel und Everolimus klinisch geprüft werden sollte.
In einem dritten Poster von Conolly et al., New York, USA, wurde in Tiermodellen gezeigt, dass die katalytische mTOR-Inhibition mit PP242 (einer investigativen Substanz, die die ATP-Domäne von mTOR hemmt) im Unterschied zu Everolimus die Radiosensitivität bei inflammatorischem Mammakarzinomen steigert.8
Zusammenfassung
Die TAMRAD-Studie ist ein weiteres Steinchen im Mosaik der Hormonresistenz-Mechanismen, legt eine zentrale Rolle von mTOR nahe und zeigt, dass die Kombination von Tamoxifen und Everolimus bei sekundärer Hormonresistenz nach Aromatasehemmertherapie wirksam ist. Trotzdem sind noch viele Fragen offen, inwieweit die Kombination eines mTOR-Inhibitors und einer Hormontherapie die Entwicklung der Hormonresistenz hinausschieben, verhindern oder aufheben kann.
FACT-BOXPräklinische Daten zeigen, dass der aktivierte PI3K/Akt/mTOR-Pathway eine wichtige Rolle bei der Hormonresistenz des Mammakarzinoms spielt. Die TAMRAD-Studie ist ein weiterer Mosaikstein auf dem Weg zum „Proof of Principle“. Bis dato ist weiterhin unklar, ob die Zugabe eines mTOR-Inbitors zur Hormontherapie die endokrine Resistenzsituation überwinden kann.
1 Boulay et al., Clin Cancer Res 2005; 11:5319–5328
2 Ellard SL et al., J Clin Oncol 2009; 27:4536–4541
3 Awada A et al., Eur J Cancer 2008; 44:84–91
4 Baselga J et al., J Clin Oncol 2009; 27:2630–2637
5 Bachelot T et al., SABCS 2010; Abstr. #S1-6
6 Badin F et al., SABCS 2010; Abstr. #P4-02-05
7 Zhang J et al., SABCS 2010; Abstr. #PD02-09
8 Conolly EP et al., SABCS 2010; Abstr. #P5-06-05