Neoadjuvante und operative Therapie bei Lebermetastasen
Das Auftreten von Lebermetastasen (CRC-LM) stellt die häufigste Form der Tumorprogression dar und bestimmt vor allem das Gesamtüberleben der Patienten. Zum Zeitpunkt der Diagnose des Primärtumors ist bereits bei 15–25 % der Patienten eine synchrone Lebermetastasierung zu beobachten und 25–30 % der Patienten entwickeln im weiteren Verlauf Ihrer Krankheit metachrone Lebermetastasen (ca. 50 % der Patienten mit CRC haben Lebermetastasen). Unbehandelt liegt die Lebenserwartung im Mittel bei 6 Monaten.
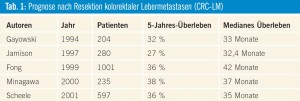
Trotz fehlender randomisierter Studien hat die chirurgische komplette Resektion von CRC-LM auch heute weiterhin als einziges Therapieverfahren mit Chance auf Langzeitüberleben und Heilung einen festen Stellenwert. Durch gezielte Patientenselektion, durch verbesserte Operationstechniken und durch ein modernes perioperatives Management wurden Leberresektionen zum Standardeingriff etabliert. Eine Reihe von retrospektiven Studien belegen den Vorteil der Leberresektion mit einem medianen Überleben von 25–40 Monaten und einem 5-Jahres-Überleben von 25–50 %, bei einer perioperativen Morbidität und Letalität von < 5 %.
Das wesentliche Problem bei der chirurgischen Behandlung von Lebermetastasen ist die Tatsache, dass nur eine Minorität von 15–20 % der Patienten für ein chirurgisches Vorgehen tatsächlich geeignet ist (chirurgisch-technisch, extrahepatale Manifestation, Begleiterkrankungen). Darüber hinaus besteht trotz der radikalen Leberresektion eine hohe Rezidivrate von 60–70 %. In den letzten 10 Jahren konnte durch die Ausweitung der chirurgischen Resektionsgrenzen (portalvenöse Embolisation, zweizeitige Operationen, lokale Ablationsverfahren) und durch die Entwicklung neuer Zytostatika und monoklonaler Antikörper (VEGF, EGFR) neue Strategien entwickelt werden, einerseits mit dem Ziel, den Anteil der Patienten, die potenziell kurativ reseziert werden können, zu erhöhen und andererseits die Rezidivrate nach Leberresektion zu senken. Solche Therapieziele sind aber nur durch die Etablierung von interdisziplinären Tumorboards – ein heute leider vielfach überstrapazierter Begriff – umzusetzen.
Präoperative Diagnostik
Lebermetastasen machen in der Regel keine klinischen Beschwerden und werden im Rahmen der Nachsorge bzw. beim primären Tumorstaging diagnostiziert. Kapselspannungsschmerz bei fortgeschrittener Erkrankung, Ikterus bei Kompression oder Infiltration des Hauptgallengangs sind mögliche klinische Erscheinungsbilder. Bei etwa der Hälfte der Patienten mit CRC-LM findet man auch einen extrahepatalen Tumorbefall. Zur Vermeidung unnötiger Laparotomien ist daher eine gewissenhafte präoperative Diagnostik zu fordern. Sonographie (US), Computertomographie (CT) und Magnetresonanztomographie (MRT) werden routinemäßig eingesetzt. Erst durch den Einsatz moderner Schnittbildverfahren (geringe Schichtdicke, mehrere Phasen, gute Kontrastierung) und neuer Kontrastmittel ist die Beurteilung einer Raumforderung in der Leber möglich geworden. So stellen der kontrastmittelverstärkte Ultraschall und die leberspezifischen Kontrastmittel in der MRT einen klaren Fortschritt dar. Eine weitere Entwicklung stellt die 3-D-Rekonstruktion von Raumforderungen in der Leber, die Volumetrie mit Beurteilung der Restleber dar. Mit solchen speziellen Softwareprogrammen (MeVis, Bremen) ist bei großen Resektionen eine genaue präoperative OP-Planung möglich. Dennoch ist die Diagnose einer peritonealen Karzinose, positiver Lymphknoten im Ligamentum hepatoduodenale bzw. zusätzlich nicht erkannter Lebermetastasen oft schwierig. In dieser Situation ist der Einsatz einer Positronenemissionstomographie (PET) in Kombination mit einer CT und 18F-Fluordeoxyglucose (FDG) als Radiopharmakon sinnvoll. Eine wichtige Ergänzung zur Beschreibung des intrahepatischen Tumorbefalls ist die intraoperative Sonographie (IOUS) in Kombination mit der manuellen Palpation der Leberoberflä-
che, da in zahlreichen Studien gezeigt werden konnte, dass durch den Einsatz des IOUS in bis zu 15 % der Patienten zusätzliche Metastasen entdeckt wurden und daher die operative Strategie verändert werden musste. Die Durchführung eines IOUS ist bei jeder Leberoperation notwendig. Der Stellenwert der diagnostischen Laparoskopie in Kombination mit dem laparoskopischen Ultraschall zur Vermeidung unnötiger Laparotomien wird in Studien evaluiert.
Resektion von Lebermetastasen
Definition und Indikation: Das Ziel der chirurgischen Therapie von CRC-LM ist die lokale Tumorfreiheit (R0-Resektion), da eindeutig gezeigt werden konnte, dass Patienten nach einer palliativen, also nichtradikalen Metastasenoperation, keinen Überlebensvorteil haben.
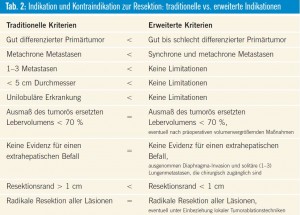
Extrahepatische Manifestation: Die Prognose bei extrahepatischem Tumorbefall ist mit einem schlechten Langzeitüberleben verbunden. In einer Analyse des Memorial Sloan-Kettering Cancer Center betrug die 5-Jahres-Überlebensrate der Patienten mit und ohne extrahepatischen Tumorbefall 18 % vs. 38 %. Eine Indikation zur Leberresektion beim extrahepatischen Tumorbefall ergibt sich daher nur bei resektablem Primärtumor, bei radikaler Resektion einzelner Karzinoseherde sowie bei vereinzelten resektablen Lungenmetastasen.
Lymphknotenstatus: Eine besonders schlechte Prognose haben Patienten mit Lymphknotenmetastasen im Leberhilus, sodass dies als Zeichen einer systemischen Tumormanifestation gedeutet werden muss. Das Vorhandensein von klinisch oder histologisch positiven Lymphknoten im Ligamentum hepatoduedenale bzw. entlang der Aorta abdominalis wird daher aus onkologischer Sicht als Kontraindikation zur Leberresektion betrachtet.
Resektionsabstand: Patienten mit positivem Resektionsrand haben ein signifikant schlechteres medianes Überleben im Vergleich zu Patienten mit negativem, tumorfreien Resektionsrand. Unklar ist jedoch das Ausmaß des Resektionsabstandes: ein minimaler Resektionsrand von > 5 mm wird als ausreichend angesehen. Durch die neuen blutsparenden Resektionstechniken mit CUSA (Ultraschalldissektor) und Water-Jet sind einerseits selektive Resektionen an ungüns – tigen Metastasenlokalisationen (Leber – vene, portale Trias) möglich geworden, andererseits ist die Bestimmung des Resektionsabstandes oft schwierig, da ein großer Teil der Leberzellen durch diese Resektionsmethode abgesaugt wird. Der Pathologe kann daher den exakten Abstand nur in Absprache mit dem Chirurgen bestimmen.
Anzahl der Metastasen: Das Ziel einer R0-Resektion wird auch durch die Anzahl und das Verteilungsmuster der Metastasen bestimmt. Viele Studien zeigen, dass eine Metastasenanzahl < 4 einen wesentlichen prognostischen Faktor darstellt. Minagawa et al. konnte in seiner rezenten Analyse zeigen, dass Patienten mit einer solitären Lebermetastase das beste Langzeitüberleben hatten, aber dass kein Unterschied im 5- und 10- Jahres-Überleben zwischen Patienten mit 2–4 und Patienten mit > 4 Metastasen bestand. Die Metastasenanzahl selbst ist daher kein Ausschlussgrund für die Evaluierung einer Metastasenchirurgie.
Metastasenmuster: Um die Resektabilität von CRC-LM standardisiert zu beurteilen, wurde von der European Colorectal Metastases Treatment Group (ECMTG) eine neue Klassifikation des Metastasenmusters erarbeitet: Danach gilt M1a als primär resektabel, M1b als möglich resektabel und M1c als nicht resektabel. Nach ECMTG werden die Metastasen als resektabel eingestuft, wenn alle Metastasen sicher entfernt werden können und ein Restlebervolumen von > 30 % erhalten wird. Neben dieser technischen und funktionellen Beurteilung der Resektabilität und neben der Begutachtung der allgemeinen Operationsfähigkeit ist vor allem die Frage des onkologischen Nutzens und der Prognose für jeden Patienten zu beantworten.
Prognose: Trotz radikaler Operation erleiden 60–70 % der Patienten ein Tumorrezidiv, sodass nur eine bestimmte, selektionierte Patientengruppe von der alleinigen chirurgischen Therapie profitiert. Satellitenmetastasen, eine große Anzahl an Metastasen (> 4), synchrone Metastasierung oder ein kurzer Zeitverlauf (< 2 Jahre) zwischen Operation des Primärtumors und der Lebermetastasierung, große Tumorlast in der Leber (> 50 % der Lebermasse) sowie ein geringer Resektionsabstand (< 1 cm) zum Tumor, die Verteilung der Metastasen in der Leber (unilobulär, bilobulär), der extrahepatische Tumorbefall und ein hohes CEA werden als negative prognostische Parameter bewertet. Anhand der Risikoanalysen von Nordlinger et al. und dem Clinical Risk Score von Fong variiert daher für Patienten mit schlechter bzw. guter Prognose das 5-Jahres-Überleben zwischen 14 % und 60 %. Es sollte präoperativ eine entsprechende Klassifizierung durchgeführt werden, um das Rezidivrisiko besser abschätzen zu können, um eventuell ein multimodales Therapiekonzept zur Anwendung zu bringen.
Multimodale Therapie von CRC-Lebermetastasen
In den letzten Jahren wurden die traditionellen Indikationen und Kontraindikationen zur Metastasenchirurgie, vor allem unter dem Aspekt multimodaler Therapiekonzepte (Chemotherapie, lokale ablative Verfahren) hinterfragt und verändert.
Resektable Lebermetastasen und adjuvante Chemotherapie: Die radikale Resektion von Lebermetastasen stellt weiterhin die Standardtherapie dar. Der Einsatz einer adjuvanten Chemotherapie mit 5-FU zur Verbesserung des Patientenüberlebens hat leider keinen durchschlagenden Erfolg gebracht: Weder die alleinige systemisch intravenöse noch die lokoregionäre intraarterielle Chemotherapie mit 5-FU konnten eine signifikante Lebensverlängerung erreichen. Im Gegensatz hierzu wurde nur von N. Kemeny et al. bei einer kombinierten intraarteriellen Chemotherapie mit FUDR und systemischer 5-FU/Folinsäure-Chemotherapie eine signifikant verbesserte progressionsfreie Überlebensrate und ein signifikant verbessertes Gesamtüberleben nach 2 Jahren erzielt.
Neoadjuvante Chemotherapie: Viel versprechend sind neoadjuvante Chemotherapiekonzepte mit der Möglichkeit, das Ansprechen der Metastasen auf die Chemotherapie präoperativ zu überprüfen, eine Größenreduktion der Metastasen und somit eine mögliche risikoärmere Operation zu erreichen und eine suspizierte Mikrometastasierung zu behandeln. Giachetti et al. konnte bei ca. 15 % der Patienten mit primär nicht resektablen Lebermetastasen ein technisch resektables Tumorstadium erzielen. Diese nun resektablen Patienten hatten ein gleich langes 5-Jahres-Überleben wie primär resektable Patienten mit kolorektalen Lebermetastasen. Insgesamt konnte daher die Gesamtresektionsrate von CRC-LM auf 35 % gesteigert werden.
– Ansprechrate: 50–60 % der Patienten zeigen ein partielles Ansprechen des Tumors auf eine präoperative Chemotherapie, lediglich bei 20 % der Patienten ist eine Tumorprogression zu beobachten. R. Adam berichtete, dass das 5-JahresÜberleben der „Responder“ mit 37 % signifikant höher ist, verglichen mit 8 % bei den „Nonrespondern“. Die neoadjuvante Chemotherapie stellt daher ein zusätzliches biologisches positives Selektionskriterium bei der Beurteilung der Operationsindikation zur Leberresektion dar.
– Nebenwirkungen: Zu den Argumenten gegen den Einsatz einer präoperativen Chemotherapie zählt die nicht unerhebliche Toxizität, die zu einer erhöhten Morbidität und Mortalität führen kann. CASH als chemotherapieassoziierte Steatohepatitis und „blue liver“ als obstruktive Veränderung der Lebersinusoide sind in der Literatur gut beschriebene Nebenwirkungen einer Langzeitchemotherapie. Die postoperative Komplikationsrate steigt mit der Länge der applizierten Chemotherapie. Ein anderer Nachteil bei zu langer Gabe der Chemotherapie ist das schlechte Erkennen der Metastasen bei der Operation und die dadurch fehlende OP-Planung und Resektionsmöglichkeit.
– Antikörpertherapie: Eine besondere Rolle kommt der Antikörpertherapie mit dem VEGF-Antikörper Bevacizumab und dem EGFR-Antikörper Cetuximab zu, speziell bei den KRAS-Wildtyp-Patienten. Die lokalen Ansprechraten konnten auf 50–60 % erhöht werden, und es konnte gezeigt werden, dass die Resektion nach einer solchen Therapie sicher ist. Die Frage nach dem optimalen Operationszeitpunkt bleibt aber unter dem Gesichtspunkt der beschriebenen Nebenwirkungen der Chemotherapie weiterhin unbeantwortet.
Neoadjuvante Chemotherapiekonzepte bei primär resektablen Metastasen werden aber weiterhin kritisch diskutiert. Die EORTC-Studie 40983 überprüfte die Hypothese, ob durch eine neoadjuvante Chemotherapie mit 5-FU/Oxaliplatin 3 Monate vor und 3 Monate nach einer Leberresektion das rezidivfreie Intervall verlängert werden kann (gegenüber einer Patientengruppe mit alleiniger Leberresektion). Das PFS war bei den Patienten mit neoadjuvanter Chemotherapie absolut um 9,1 % (p < 0,025) höher, die Rate an reversiblen Komplikationen war aber mit 25 % in der Chemotherapiegruppe höher als mit 16 % in der alleinigen Operationsgruppe. Zum Gesamtüberleben wurden bis heute noch keine Daten publiziert. Lediglich 6 % der Patienten hatten eine Tumorprogression unter der Chemotherapie; diese Patienten wurden sofort operiert, kein Patient war inoperabel. Das Konzept ist faszinierend, die Datenlage ist aus meiner Sicht überzeugend, eine weitere Studie, welche die neoadjuvante Chemotherapie gegen eine Nullgruppe vergleicht, wird es wahrscheinlich in Zukunft nicht mehr geben.
Zusammenfassung
Die Leberresektion hat in der Behandlung kolorektaler Lebermetastasen einen großen Stellenwert. Zur Verbesserung der Überlebensraten sind jedoch multimodale Therapiekonzepte notwendig, die nur durch eine enge interdisziplinäre Zusammenarbeit innerhalb eines Tumorboards möglich sind.
Literatur:
– Nordlinger B et al., Lancet 2008; 371:1007–1016
– Adam R, J Clin Oncol 2009; 27:1829-1835
– Folprecht G et al., Ann Oncol 2005; 16:1311–1319
– Karoui M et al., Ann Surg 2006; 243:1–7
– Adam R et al., Ann Oncol 2010; 21:1579–1584
– Nordlinger B et al., Ann Oncol 2009; 20:985-992