Neue Konzepte in der Krebsforschung – Welche Alternativen gibt es zum Stammzellmodell?
Experimentelle Belege für Stammzellen bei soliden Tumoren
Experimentelle Befunde zur Bestätigung des Stammzellmodells bei Karzinomen kamen von der Isolierung von Tumorzellen aus klinischen Präparaten mittels bestimmter Oberflächenmarker und dem Nachweis der Bildung von Tumoren in immundefizienten Mäusen durch geringe Zellmengen dieser „angereicherten Tumorstammzellen“, im Gegensatz zur verbleibenden restlichen Zellpopulation. Beispiele dafür sind etwa die Beschreibung der CD44+/CD24–/low-Brustkrebszellen und der CD133+-Gliom- und Kolontumorzellen in den Jahren 2003 bis 2007. Mittlerweile wurden Tumorstammzellen in den meisten weiteren Karzinomen beschrieben. Diese Zell – marker eignen sich aber nicht als therapeutische Targets, da sie auch auf normalen Zelltypen vorkommen, variabel und transient exprimiert werden und oft nur die Kombination zweier Antigene eine Population charakterisiert. Der derzeitige Standard für den Nachweis der Tumorstammzellen ist die Initiierung von Tumoren, die alle Eigenschaften des ursprünglichen Tumorgewebes aufweisen, in immundefizienten Mäusen. Die Frequenz der so gebildeten Tumoren hängt vom verwendeten Tiermodell, dem Grad der Immundefizienz und den mitinjizierten Materialien und/oder Normalzellen ab. Die Etablierung von Tumoren durch Stammzellen in den Versuchstieren hat wenig mit der Situation im Patienten gemeinsam, da zahlreiche Wachstumsfaktoren nicht über die Speziesbarriere wirken und damit kein permissives Mikroenvironment vorliegt. Bei optimierten Tiermodellen sind die Tumorstammzellen, wie beim Melanom, keine seltenen Populationen, sondern können bis zu 25 % des Tumors ausmachen, zudem könnten im Verlauf der Anreicherung der möglichen Stammzellen Faktoren entfernt werden, die eine Tumorinitiation supprimieren. Selbst beim syngenen Mausmodell sind die Knochenmarkstammzellen mit 10 % nicht selten. Es werden daher neue Methoden zum Nachweis der Tumorstammzellen benötigt, die für die maligne Proliferation im Patienten relevant sind.
Tumorstammzellen – spezifische Population oder variabler Phänotyp?
Nach der Stammzelltheorie sind die Tumoren hierarchisch aufgebaut, und die Elimination einer kleinen Zellpopulation würde genügen, um das maligne Wachstum zu eliminieren. Die Gruppe von Eric Lander konnte jedoch für zwei Mammakarzinomlinien zeigen, dass Stamm – zellen keine definierte Population dar – stellen, sondern einen transienten Zell – zustand. Nach der experimentellen Auftrennung von basalen, luminalen und stammzellartigen Subpopulationen zweier Mammakarzinomlinien durch Sorten und getrennter Kultur für sechs Tage wurde anschließend in allen drei Kulturen spontan das ursprüngliche Gleichgewicht mit den drei differenzierten Populationen wiederhergestellt. Demzufolge sind aus basal und luminal differenzierten Zellkulturen aus Mammakarzinomen wiederum Stammzellen entstanden. Auch bei den Tiermodellen wurde beobachtet, dass stammzelldepletierte Populationen im Tier Tumoren bilden, nur eben mit zeitlicher Verzögerung. Folglich müsste jede Tumortherapie Wirkstoffe gegen stammzellartige und differenzierte Populationen kombinieren, oder die Regeneration von Tumorstammzellen aus den anderen Tumorzelltypen verhindern. Die weitergehenden Untersuchungen dieser Stammzellen solider Tumoren haben in der Zwischenzeit zu zahlreichen Fragen und einem komplexen Bild der Stellung dieser Zellen in der Onkologie geführt.
Zusammenfassend wurden bis heute keine stabilen Stammzellpopulationen, die eine permanente Expression spezifischer Marker aufweisen, definiert, der Nachweis dieser Zellen in immundefizienten xenogenen Versuchstieren ist problematisch und die Bedeutung der so definierten Tumorstammzellen für eine erfolgreiche Therapie der Karzinome nicht geklärt.
Bedeutung der Stammzellen solider Tumoren für die Therapie
Tumorstammzellen könnten die Quelle aller Zellen eines Primärtumors sein, das kleine Reservoir chemotherapieresistenter Zellen ausmachen, oder sie können Ursprung der Metastasen sein. Bis jetzt existieren keine Befunde, die ein verlängertes Überleben in präklinischen Modellen durch die Elimination von Tumorstammzellen nachweisen würden. In der klinischen Situation erzielt die Chemotherapie oft nur eine Reduktion der Tumormasse, folglich stellen damit die Tumorstammzellen nur einen kleinen Anteil der Tumorzellpopulation, und ihre Elimination hätte auf den weiteren Verlauf des Rezidivs nur geringe Auswirkungen. Auch wenn Tumorstammzellen in einer hypoxischen und azidotischen „Nische“ langsam proliferieren und chemoresis – tenter sind, erfolgt durch die teilweise Reduktion des Tumors keine signifikante Anreicherung. Die selektive Schädigung von Tumorstammzellen hätte wahrscheinlich nur nach einer Ausschaltung aller Progenitor- und differenzierten Tumorzellen eine klinische Bedeutung, wie beim Wiederauftreten eines Mammakarzinoms nach einer jahrelangen Latenzzeit durch eine minimale Resterkrankung. Dabei wäre allerdings zu beachten, dass gemäß der Stammzelltheorie jede einzelne Tumorzelle zu einem Rezidiv führen könnte und daher eine restlose Elimination aller Tumorstammzellen erreicht werden müsste, ein Grad der Effizienz, der selbst in vitro unter optimalen Bedingungen kaum erreicht wird.
Konklusion
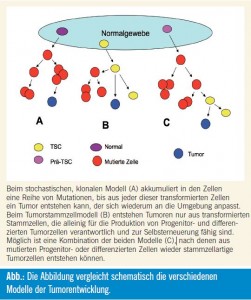
Auch wenn sich das Stammzellkonzept in der derzeitigen Form nicht bestätigt, wurde dadurch der Anstoß gegeben, neue Aspekte der Heterogenität der Entwicklung von Tumoren zu entdecken und daraus neue Ziele für die Therapie zu definieren. Die Tumorstammzellhypothese stellt wahrscheinlich nur eine Ergänzung des klonalen stochastischen Modells der Entwicklung von Tumoren dar (Abb.). Die Elimination einer kleinen Population von Tumorstammzellen könnte das Resultat der Tumorbehandlung nicht verbessern, wenn die große Menge der rasch proliferierenden Tumormasse nicht berücksichtigt wird.
FACT-BOX
Die hierarchische Stammzellhypothese ist eine relative neue, attraktive Theorie der Tumorentwicklung, die zu zahlreichen neuen Erkenntnissen geführt hat, aber experimentell nicht bewiesen ist. Sie stellt lediglich eine mögliche Erweiterung des bisherigen klonalen und stochastischen Modells des malignen Wachstums und der Resistenzentwicklung dar. Auch bei Gültigkeit der Stammzellhypothese für solide Tumoren müssten für eine erfolgreiche Therapie sowohl die Masse der rasch proliferierenden Progenitorzellen und differenzierten Zelltypen reduziert wie auch möglichst jede einzelne Tumorstammzelle eliminiert werden.
Ausgewählte Literatur:
– Hill RP, Identifying cancer stem cells in solid tumors: Case not proven. Cancer Res 2006; 66(4):1891–1896
– Kern SE, Shibata D, The fuzzy math of solid tumor stem cells: a per spective. Cancer Res. 2007; 67(19):8985–8988
– Kelly PN, Dakic A, Adams JM, Nutt SL, Strasser A, Tumor growth need not be driven by rare cancer stem cells. Science 2007; 317(5836):337
– Tomasson MH, Cancer stem cells: A guide for sceptics. J Cellul Biochem. 2009; 106:745–749
– Rosen JM, Jordan CT, The increasing complexity of the cancer stem cell paradigm. Science 2009; 324(5935):1670–1673
– Rahman M et al., The cancer stem cell hypothesis: failures and pitfalls. Neurosurgery 2011; 68(2):531–545
– Clevers H, The cancer stem cell: premises, promises and challenges. Nature Med 2011; 17(3):313–319
– Gupta BP et al., Stochastic State Transitions Give Rise to Phenotypic Equilibrium in Populations of Cancer Cells. Cell 2011; 146(4):633–644
– Olszewski U, Liedauer R, Ausch C, Thalhammer T, Hamilton G, Over – expression of CYP3A4 in a COLO 205 Colon Cancer Stem Cell Model in vitro. Cancers 2011; 3:1467–1479