Neue Tyrosinkinasehemmer bei CML, individualisierte Antikörper-Therapie bei CLL – Chronische Leukämien
Chronische myeloische Leukämie
Neue Optionen für die Erstlinientherapie der CML
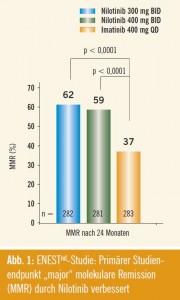
In der ENESTnd-Studie wird Nilotinib in einer Dosierung von 300 mg 2-mal täglich sowie Nilotinib 400 mg 2-mal täglich mit Imatinib 400 mg 1-mal täglich verglichen. Der primäre Endpunkt dieser Studie war das Erreichen einer major molekularen Remission (MMR) nach 12 Monaten. Es zeigte sich, dass die Rate an MMR nach 12 Monaten im Vergleich zu Imatinib verdoppelt werden konnte (44 % bzw. 43 % für Nilotinib 300 mg bzw. 400 mg 2-mal täglich versus 22 % für Imatinib 400 mg 1-mal täglich). Diese Unterschiede waren hoch signifikant. Am ASH-Meeting wurden nun Followup- Daten nach 24 Monaten gezeigt (Abstract #207). Hier zeigte sich, dass dieser Unterschied weiter signifikant bleibt mit 62 % MMR (Nilotinib 300 mg 2-mal täglich) bzw. 59 % (Nilotinib 400 mg 2- mal täglich) versus 37 % MMR für Imatinib (Abb. 1). Obwohl sich dies derzeit nicht in einem signifikant verbesserten Gesamtüberleben niederschlägt (97,4 % für Nilotinib 300 mg 2-mal täglich bzw. 97,8 % für Nilotinib 400 mg 2-mal täglich; 96,3 % für Imatinib 400 mg 1-mal täglich) kommt es unter Nilotinib-Therapie zu signifikant geringeren Übergängen in eine akzelerierte Phase (AP) oder Blas tenkrise (BC; 0,7 % bzw. 1,1 % für Nilotinib vs. 4,2 % für Imatinib) während der ersten 2 Jahre.
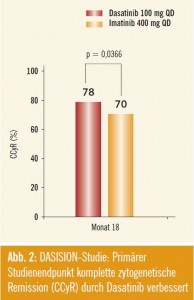
DASISION-Studie: In einer ähnlichen Studie (DASISION; Abstract #206) wurde Imatinib 400 mg bei neu diagnostizierten CML-Patienten gegen Dasatinib 100 mg 1-mal täglich getestet. Der primäre Endpunkt dieser Studie war das Erreichen einer kompletten zytogenetischen Remission (CCyR) nach 12 Monaten. Diese Studie zeigte eine signifikante Verbesserung der CCyR-Rate nach 12 Monaten für Dasatinib (77 %) im Vergleich zu Imatinib (67 %; p = 0,0086). Das 18-Monate-Update am heurigen ASH-Meeting bestätigt diesen Trend mit signifikant besseren CCyR-Raten für Dasatinib (78 %) im Vergleich zu Imatinib (70 %; p = 0,0086) (Abb. 2). Die MMRRaten nach 12 Monaten sind ähnlich wie in der ENESTnd-Studie mit 46 % MMR für Dasatinib besser als mit Imatinib (28 %). Dieser Unterschied zeigte sich zudem in allen Euro-Hasford-Risikogruppen. Auch in dieser Studie zeigt sich unter Imatinib eine etwas höhere Rate an Transformationen (AP, BC) (3,5 % vs. 2,3 % für Dasatinib).
Verträglichkeit der neuen Tyrosinkinasehemmer: Bezüglich relevanter Nebenwirkungen kommt es unter Nilotinib zu geringerer Übelkeit, weniger Durchfällen und Erbrechen sowie zu geringerer Ödemneigung und Muskelkrämpfen im Vergleich zu Imatinib. Häufiger treten Hautausschläge, Hautjucken und Kopfschmerzen unter Nilotinib-Therapie auf. Die Hämatotoxizität zwischen Nilotinib und Imatinib scheint ähnlich, die Rate an Neutropenien ist unter Nilotinib geringer. Erhöhungen der Lipase, der Glutamin- Pyruvat-Transaminase (GPT), des Bilirubins sowie des Nüchternglukosespiegels finden sich vermehrt unter Nilotinib. Zwischen Dasatinib und Imatinib scheint es ebenfalls keine signifikanten Unterschiede in der Hämatotoxizität zu geben, die Thrombozytopenie und Anämie ist tendenziell häufiger unter Dasatinib. WHO-Grad-I/II-Pleuraeffusionen treten bekanntermaßen primär unter Dasatinib auf, Ödemneigung, Myalgien, Übelkeit und Erbrechen sind häufiger unter Imatinib. Kein wesentlicher Unterschied scheint im Auftreten von Diarrh ö – en, Müdigkeit, Kopfschmerzen und Hautausschlägen zu bestehen.
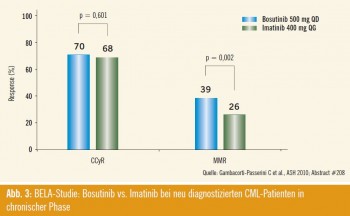
Bosutinib: Ein weiterer, bislang noch nicht käuflich verfügbarer Dritte-Genera – tion-Tyrosinkinasehemmer namens Bosutinib, der ähnlich wie Dasatinib kompetitiv SRC- und ABL-Tyrosinkinasen hemmt, nicht jedoch PDGFR und c-Kit, wurde ebenfalls als Erstlinientherapie in einer Dosierung von 500 mg/Tag mit Imatinib 400 mg/Tag verglichen (Ab – s tract #208). Nach 12 Monaten war die Rate an kompletten zytogenetischen Remissionen in beiden Armen ähnlich (70 % für Bosutinib, 68 % für Imatinib), die MMR-Raten mit 39 % für Bosutinib vs. 26 % für Imatinib jedoch signifikant besser (Abb. 3). Auch unter Bosutinib war die Transformation in Akzeleration oder Blas tenkrise mit 2 % für Bosutinib vs. 4 % unter Imatinib deutlich besser (p = 0,053), das Gesamtüberleben in der ITT-Population tendenziell besser für Bosutinib, jedoch nicht signifikant unterschiedlich im Vergleich zu Imatinib. Unter Bosutinib kommt es zu höheren Werten an SGOT, SGPT sowie der Lipase. Weiters sind Durchfälle, Erbrechen, Fieber und Bauchschmerzen unter Bosutinib häu figer als unter Imatinib. Periorbitale Ödeme, Muskelkrämpfe und Knochenschmerzen finden sich häufiger unter Imatinib.
Zusammenfassend kann gesagt werden, dass für die Behandlung der CML in erster chronischer Phase drei interessante, neue Tyrosinkinasehemmer zur Verfügung stehen, welche sich im Vergleich zu Imatinib durch höhere Raten an kompletten zytogenetischen Remissionen und major molekularen Remissionen auszeichnen. Zudem treten diese Remissionen rascher ein. Inwieweit diese Substanzen zum gegebenen Zeitpunkt Imatinib als Erstlinientherapie ablösen werden bzw. sollten, bleibt zu diskutieren. Im Einzelfall wird auch auf mögliche individuelle Nebenwirkungen einzugehen sein. Offen bleiben zudem mögliche, bisher nicht bekannte Langzeittoxizitäten dieser neuen TKI. Weiters konnte bisher trotz der höheren und rascher einsetzenden zytogenetischen und molekularen Remissionen kein sicherer Überlebensbenefit gezeigt werden.
Hoffnung für CML-Patienten mit T315I-Mutation
Ein interessanter neuer Tyrosinkinasehemmer wurde im Rahmen einer Phase- I-Studie vorgestellt (Abstract #210). Ponatinib ist ein speziell für die BCR/ ABL-Tyrosinkinase designter Tyrosinkinasehemmer, der auch Wirkung gegenüber der T315I-Mutation aufweist (Abb. 4). Neben der BCR/ABL-Tyrosinkinase hemmt Ponatinib auch FLT-3, FGFR, VEGFR, PTGFR und c-Kit. Der Großteil der in dieser Phase-1-Studie behandelten Patienten waren Patienten mit CML in CP, AP oder BC. 95 % der Patienten hatten bereits 2 oder mehr Vortherapien mit Tyrosinkinasehemmern erhalten. 28 % der Patienten hatte eine T315I Mutation. Insgesamt konnte bei diesen schwer vorbehandelten Patienten in 95 % der Fälle eine komplette hämatologische Remission (CHR), in 66 % eine major zytogenetische Remission (MCyR) und bei 53 % eine CCyR erzielt werden. Interessant war, dass speziell Patienten mit einer T315I-Mutation exzellent auf Ponatinib angesprochen haben. 100 % der Patienten (n = 9) erzielten eine CHR und MCyR, 89 % erzielten zudem eine CCyR. Interessant ist dabei auch, dass diese Remissionen von längerer Dauer zu sein scheinen. 89 % der Patienten mit T315I-Mutation sind auch nach einem Jahr noch in zytogenetischer Remission. Eine Phase-2-Studie mit Ponatinib wurde im September 2010 initiiert.
Chronische lymphatische Leukämie
R plus Chlorambucil für weniger fitte CLL-Patienten? In der deutschen CLL-8- Studie konnte kürzlich gezeigt werden, dass bei fitten CLL-Patienten die Chemoimmuntherapie mit Fludarabin, Cyclophosphamid und Rituximab (FCR) nicht nur höhere Raten an kompletten Remissionen erzielt, sondern dass durch die Wahl der Erstlinientherapie auch das Gesamtüberleben dieser Patienten signifikant verbessert werden kann. Die FCRTherapie ist jedoch nur sehr fitten Patienten zumutbar, demgemäß betrug die Zahl der Patienten in der CLL-8-Studie > 70 Jahre nur 10 %. Mehr als die Hälfte aller CLL-Patienten ist jedoch älter als 70 Jahre. Für diese weniger fitten Patienten wurde eine Phase-2-Studie vorgestellt, in der Chlorambucil mit dem Antikörper Rituximab kombiniert getestet wurde (Abstract #697). Dabei wurde Rituximab in der üblichen Dosierung (350 mg/m2 im Zyklus 1, anschließend 500 mg/m2 in Zyklus 2–6) verabreicht. Chlorambucil wurde in einer Dosierung von 10 mg/m2 täglich für 7 Tage mit anschließend 21 Tagen Pause gegeben. Die Ergebnisse dieser Studie wurden mit einer historischen Kontrolle von Patienten verglichen, welche lediglich Chlorambucil erhielten. Diese Patienten waren hinsichtlich Geschlechtsverteilung, medianem Alter, BINET- Stadium, Immunglobulinschwerketten- Gen-Rearrangement sowie Zytogenetik vergleichbar. Im Wesentlichen kam es unter der Therapie mit Chlorambucil plus Rituximab zu hämatotoxischen Nebenwirkungen wie Neutropenie, Leukozytopenie, Anämie und Thrombozytopenie; eine febrile Neutropenie bzw. eine neutropenische Sepsis sind jedoch erfreulicherweise nur in 5 % bzw. 4 % der Fälle aufgetreten. In überwiegendem Maße wurde durch diese Therapie eine partielle Remission erzielt (68 %), in 12 % der Fälle eine komplette Remission. Im Vergleich zu den Patienten, die lediglich Chlorambucil erhielten, scheint es insgesamt zu höheren Remissionsraten als unter Chlorambucil-Monotherapie zu kommen. Das mediane progressionsfreie Überleben betrug 24 Monate für R-Chlorambucil, in der historischen Vergleichsgruppe mit Chlorambucil alleine waren es 18 Monate. Inwieweit sich diese Daten tatsächlich bestätigen, bleibt abzuwarten. Diesbezüglich läuft derzeit eine randomisierte Phase-3-Studie für ältere, weniger fitte Patienten mit chronischer lymphatischer Leukämie in Deutschland und Österreich (DCLLSG-11-Studie).
Kann man Fludarabin und Cyclophosphamid im FCR-Schema oral einsetzen? Die australasiatische Leukämieund Lymphomgruppe (ALLG, CLLARC) untersuchte, inwieweit im FCR-Schema auch orales Fludarabin und orales Cyclophosphamid bei Patienten _ 65 Jahren eingesetzt werden kann (Abstract #699). Der primäre Endpunkt dieser ersten Analyse war die Komplettierung von 6 Behandlungszyklen. In dieser multizentrischen Phase-2-Studie wurden 3 Ko – horten untersucht. Die erste Kohorte („FR5“) erhielt lediglich orales Fludarabin (24 mg/m2 Tag 1–5) und i.v. Rituximab (375 mg/m2 Zyklus 1 bzw. 500 mg/m2 Zyklus 2–6). In einer zweiten Kohorte („FCR3“) erhielten die Patienten zusätzlich zu oralem Fludarabin und i.v. Rituximab 150 mg/m² Cyclophosphamid oral über 3 Tage, in der dritten Kohorte („FCR5“) erhielten die Patienten die idente Dosierung wie in FCR3 über 5 Tage. Trotz der niedrigen Dosierung komplettierten nur 46 % aller Patienten alle 6 Zyklen, 29 % mussten die Therapie wegen WHO-Grad-III/IV-Toxizität vorzeitig beenden. Zudem wurden in 61 % der Fälle Dosisverschiebungen während der Behandlung durchgeführt. Trotz dieser Tatsache kam es jedoch bei 92,8 % der Patienten zu einem Ansprechen, 39 % erzielten eine komplette Remission und 18 % eine noduläre partielle Remission bzw. 36 % eine partielle Remission. Die Studienrekrutierung in dieser Studie läuft weiter, die finale Analyse bleibt abzuwarten.