OeGHO-Frühjahrstagung | Innovative Therapien bei myelodysplastischen Syndromen
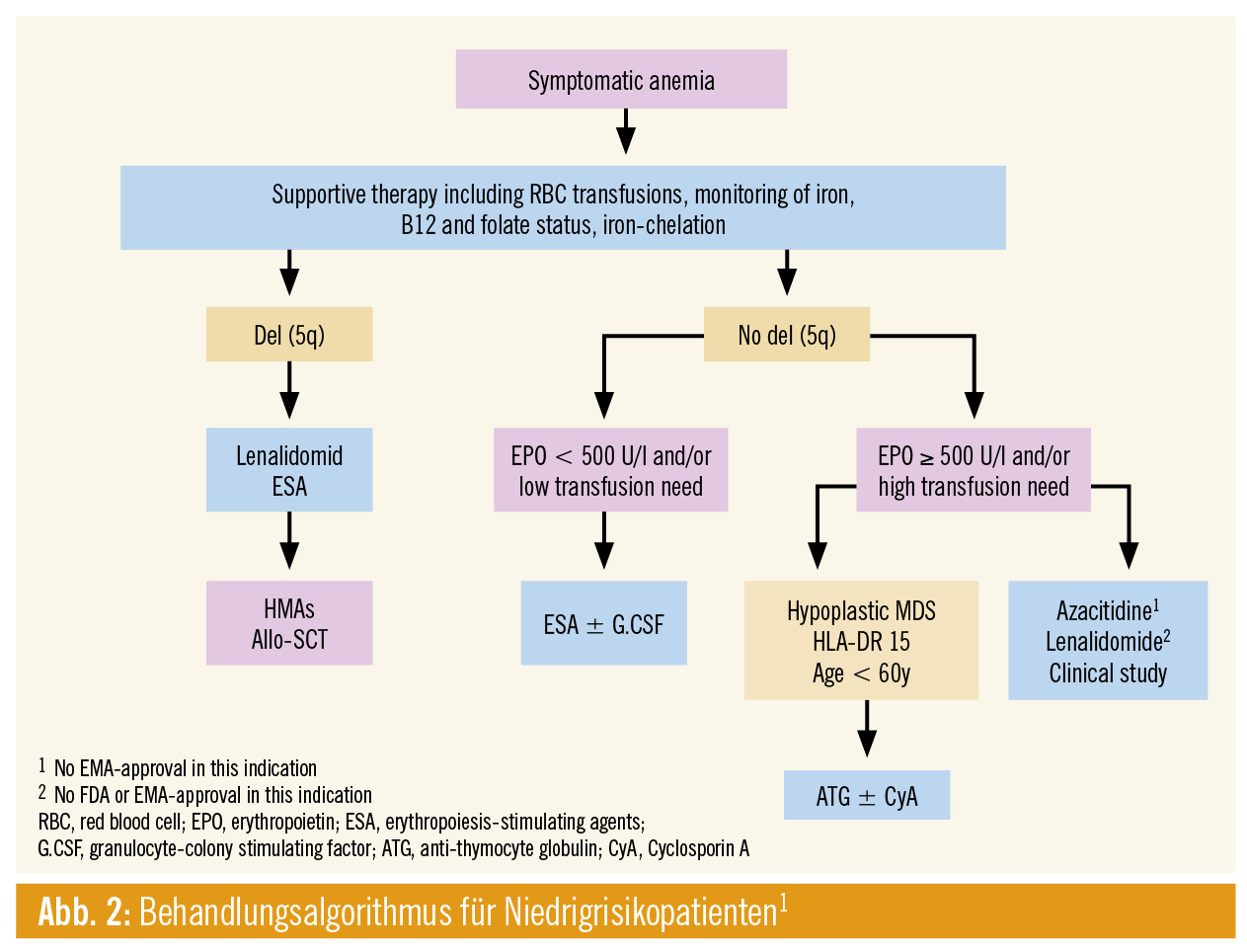
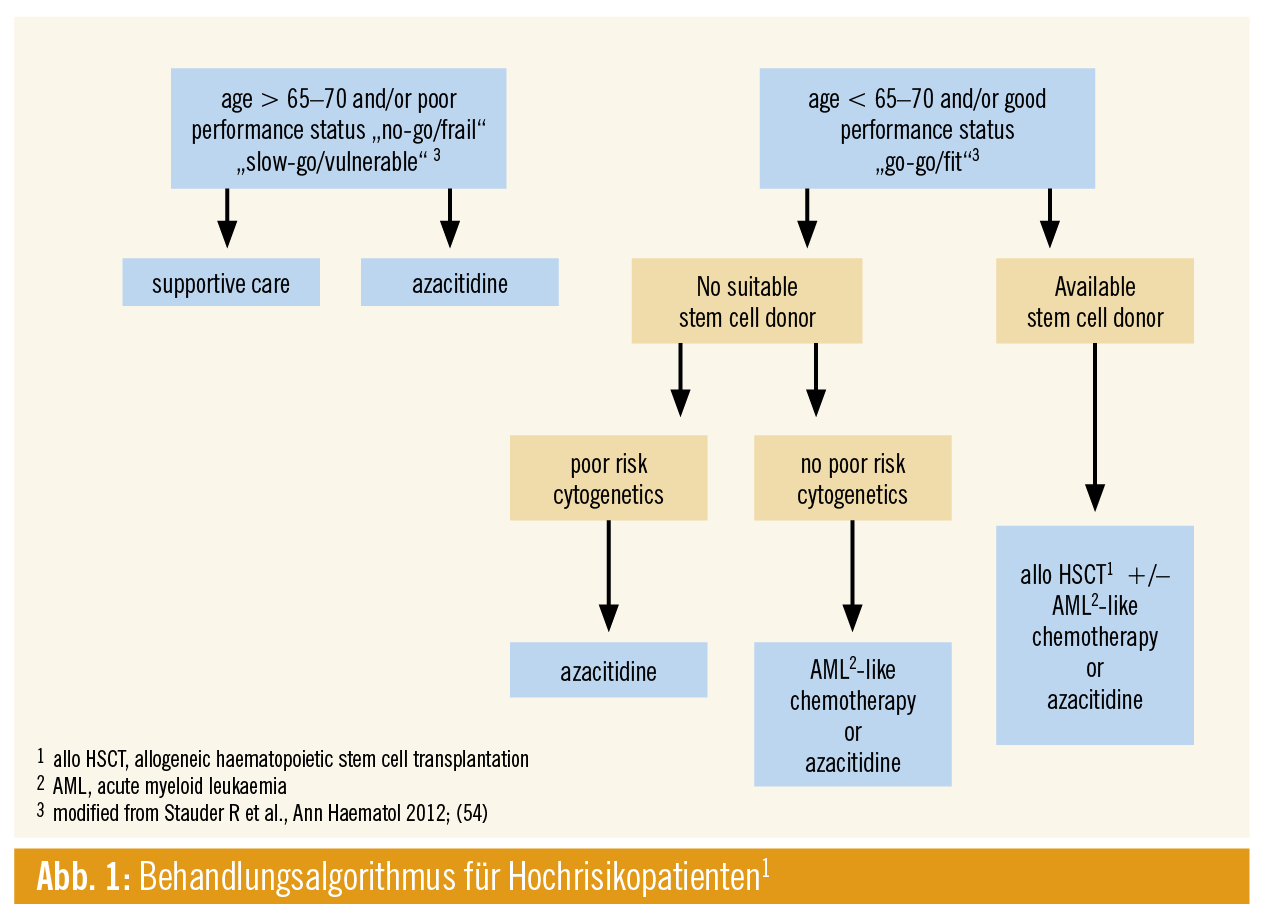
Die aktuell etablierte Therapie myelodysplastischer Syndrome (MDS) hängt neben Alter und Komorbiditäten des Patienten von der Risikostratifizierung der Erkrankung ab. Für fitte, jüngere Patienten im Höherrisiko-Setting bietet sich bei verfügbarem Spender eine intensive Chemotherapie mit allogener Stammzelltransplantation an (Abb. 1). Für alle anderen Patienten umfasst das verfügbare therapeutische Spektrum zum jetzigen Zeitpunkt den Einsatz hypomethylierender Substanzen und Best Supportive Care – wiederum abhängig vom Alter und Komorbiditätsspektrum des jeweiligen Patienten (Abb. 2). Bei Vorliegen einer Deletion 5q wird die immunmodulatorische Substanz Lenalidomid eingesetzt.1
Berücksichtigt man die Altersverteilung der Erkrankung und die damit verbundenen Komorbiditäten, wird der Großteil der MDS-Patienten im Höherrisiko-Setting mit hypomethylierenden Substanzen behandelt, da diese Patienten nicht für eine allogene Stammzelltransplantation geeignet sind. Insgesamt sprechen etwa 40 % auf hypomethylierende Therapie an, und praktische alle werden refraktär. Das Outcome dieser Patientengruppe ist besonders schlecht, das mediane Überleben beträgt 5,6 Monate nach Versagen auf Azacitidin, die mediane 2-Jahres-Überlebensrate beträgt 15 %.2 Innovative Therapiestrategien werden somit dringend benötigt. Aber auch für Niedrigrisiko-MDS-Patienten gibt es Bedarf an wirksamen neuen Therapien. Versagt eine Therapie mit erythropoietinstimulierenden Substanzen (ESA), lässt sich das Überleben durch den Einsatz gängiger Zweitlinientherapien (Azacitidin, Lenalidomid) nicht wesentlich beeinflussen.3 Verbesserungen im Bereich von Best Supportive Care könnten mit Luspatercept, welches die Ausreifung und Differenzierung von erythropoietischen Vorläuferzellen fördert, erzielt werden. Phase-II-Daten, die am ASH 2015 präsentiert wurden, zeigten eine HI (haematologic improvement) bei 22/32 Patienten mit Versagen/Intoleranz gegenüber ESA. Transfusionsunabhängigkeit konnte bei 11/22 Patienten erreicht werden.4
Schwere Thrombopenien sind bei Niedrigrisikopatienten selten. Bei Auftreten sind jedoch Transfusionen und hypomethylierende Substanzen die bislang einzigen Therapieoptionen. Der Nutzen neuer Therapiemöglichkeiten mit Romiplostim und Eltrombopag wurde in mehreren Studien gezeigt. Verglichen mit Placebo zeigten Patienten in der Romiplostim-Gruppe weniger Blutungskomplikationen, sie benötigten weniger Transfusionen und hatten höhere Thrombozytenzahlen. Das initial häufigere Auftreten einer AML im Romiplostim-Arm konnte nach einem längeren Follow-up nicht bestätigt werden.5 Auch mit Eltrombopag konnte im Vergleich zu Placebo gezeigt werden, dass in der Verumgruppe signifikant mehr Patienten (47 % vs. 3 %) einen Anstieg der Thrombozytenzahlen erreichten. Hinsichtlich der Progression in eine AML zeigte sich in dieser Studie kein signifikanter Unterschied.6
Durch die Kombination von hypomethylierenden und anderen Substanzen wird das Ziel verfolgt, ein adäquates Ansprechen häufiger und länger zu erreichen und somit das Überleben zu verlängern. Ein getesteter Kombinationspartner für Azacitidin war Lenalidomid. In einer frühen Auswertung konnte ein vielsprechendes Gesamtansprechen von 72 % gezeigt werden.7 Diese Ergebnisse konnten in einer späteren Auswertung nicht reproduziert werden, hier zeigte sich kein Unterschied in den Ansprechraten durch die Zugabe von Lenalidomid oder Vorinostat.8
Die Kombination mit anderen HDAC-Inhibitoren wie Vadastuximab Talirine (SGN-CD33A) scheint vielversprechend zu sein.9 Andere in Studien getestete Kombinationspartner von hypomethylierenden Substanzen sind Nivolumab, Lirilumab und Nivolumab, Atezolizumab, Deferasirox, Eltrombopag, Ibrutinib, Hedgehog-Inhibitoren (PF-04449913, LDE255, Erismodegib), PLK-1-Inhibitoren (Volasertib, Rigosertib) und viele mehr.10 Hier sind Ergebnisse noch ausständig.
Rigosertib zeigte in einer Phase-III-Studie, die die Substanz mit Best Supportive Care (BSC) nach Versagen von hypomethylierenden Substanzen untersuchte, ein medianes Überleben von 8,2 Monaten im Rigosertib-Arm gegenüber 5,9 Monaten im BSC-Arm.11 Erste interessante Daten sind für Tosedostat, einen Aminopeptidase-Inhibitor, und SGI-110 verfügbar.12, 13 IDH-Mutationen bieten einen sehr vielversprechenden Angriffspunkt in der Behandlung von MDS. AG-221, ein IDH-2-Inhibitor, konnte bei 50 % von 14 Patienten ein Ansprechen erzielen.14
Chronische myelomonozytäre Leukämie (CMML)
Die Therapie von Patienten mit chronischer myelomonozytärer Leukämie stellt nach wie vor eine Herausforderung dar. In einer Phase-I-Studie zeigten sich erste interessante Daten mit dem Einsatz von Lenalidomid. Knapp die Hälfte der Patienten erreichte eine Stabilisierung der Erkrankung, einzelne Patienten profitierten bis zu 49 Monate, sodass der weitere Einsatz der Substanz, eventuell in Kombination mit anderen Substanzen wie Ruxolitinib, von Interesse sein könnte.15 Ruxolitinib erzielte erste positive Ergebnisse in einer Phase-I-Studie bei Patienten mit vorherrschender B-Symptomatik.16
Fazit
Nach Einführung der hypomethylierenden Substanzen stellen sich Fortschritte in der Therapie myelodysplastischer Syndrome nur sehr langsam und zäh ein. Die Testung jeder einzelnen zielgerichteten Substanz beginnend bei Phase I bis zur Phase III im Vergleich zu Best Supportive Care könnte möglicherweise nicht die optimale Strategie darstellen, um rasch gut wirksame Substanzen herauszufiltern. Kreative neue Wege, die Molekulargenetik, neue medikamentöse Substanzen und zukunftsorientierte Studiendesigns verbinden, werden benötigt.